


【培优导学案】浙教版科学九年级全册:2、常见碱与碱的性质 学案(含解析)
展开常见碱与碱的性质
【回顾】
一、碱
1.碱的定义:电离出的阴离子全部是OH-的化合物,如Ca(OH)2、NaOH等。
2.碱的电离:NaOH===Na++OH-;Ca(OH)2===Ca++2OH-;Ba(OH)2===Ba++2OH-。
碱溶液的pH大于7,但pH大于7的溶液不一定都是碱溶液。
3.常见的碱
(1)NaOH
俗称烧碱、火碱、苛性钠。白色片状固体,易潮解,溶于水放出大量的热。
(2)Ca(OH)2
俗称熟石灰、消石灰。白色粉末状固体,建筑材料,制取漂白粉的原料。
二、碱的通性
(1)碱能使酸碱指示剂变色
碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红。
注意:有些碱不能溶于水,如氢氧化铜、氢氧化铁,由于不溶于水,它们不能使紫色石蕊试液、无色酚酞试液变色。
(2)碱+酸―→盐+水
中和反应:酸和碱反应生成盐和水的反应。
中和反应的实质:酸电离出的H+与碱电离出的OH-结合成中性的水。
H++OH-===H2O
(3)碱+某些非金属氧化物―→盐+水
①工业上常用氢氧化钠溶液来吸收二氧化硫:SO2+2NaOH===Na2SO3+H2O。
工业上常用碱溶液来吸收有毒的酸性气体,如:H2S、SO2、HCl。
②盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,而是用橡皮塞或木塞的原因:SiO2+2NaOH===Na2SiO3+H2O。
③氢氧化钠或氢氧化钠溶液不能敞口放置的原因:CO2+2NaOH===Na2CO3+H2O(常以实验探究题考查变质问题)。
(4)碱+某些盐―→新碱+新盐
注意:两种反应物必须是溶液,生成物必须要有一种是难溶于水的。
三、碱性气体氨气
(1)氨水(NH3·H2O)是氨气溶于水得到的一种弱碱,易挥发,易分解。NH3·H2O===NH3↑+H2O。可以用湿润的红色石蕊试纸检验氨气的存在,试纸由红色变成蓝色。
(2)氨气可以用碱石灰(NaOH和CaO的混合物)来干燥。碱石灰具有吸水性,常作为干燥剂,用于干燥碱性或中性气体,不能干燥酸性气体,但可以用于吸收酸性气体。
![]()
例1 下列物质加入无色酚酞试液中,能使酚酞变红的是( )
A.Ca(OH)2 B.CuO
C.Cu(OH)2 D.Fe(OH)3
[答案] A
碱性溶液能使无色酚酞试液由无色变为红色。氢氧化钙溶液显碱性,能使无色酚酞试液变红,氧化铜、氢氧化铜、氢氧化铁均难溶于水,都不能使无色酚酞试液变红。
[方法点拨] 溶于水的碱[NaOH、Ca(OH)2(微溶)、KOH、NH3·H2O]能电离出氢氧根离子,才能使酚酞试剂变红或者使石蕊试剂变蓝。只有溶于水的碱对应的碱性氧化物才能直接与水化合成碱,如:CuO就不能与水反应;不溶于水的碱受热易分解为对应的碱性氧化物。
例2 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动。
[对固体猜想]
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:是NaOH和Na2CO3的混合物。
[实验和推断]
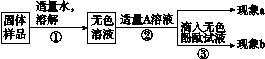
图2-1
(1)若现象a为有气泡产生,则加入的A溶液是________,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是____________________________,该反应的基本反应类型为______________________。
(2)若A是Ca(OH)2溶液,现象a为有白色沉淀,现象b为无色酚酞试液变红,则白色沉淀为________(填化学式),该实验________(填“能”或“不能”)说明样品中有NaOH。
(3)若A是CaCl2溶液,当实验现象a为____________________,现象b为________________时,猜想Ⅱ成立。
[反思] 久置的氢氧化钠变质的原因是______________________________________________
(用化学方程式表示)。
[答案] [实验和推断] (1)稀盐酸(合理即可) Na2CO3+2HCl===2NaCl+CO2↑+H2O(合理即可) 复分解反应 (2)CaCO3 不能
(3)有白色沉淀产生 无色酚酞试液不变色
[反思] 2NaOH+CO2===Na2CO3+H2O
[实验和推断] (2)Ca(OH)2和Na2CO3反应会生成CaCO3沉淀和NaOH,引入了氢氧根离子,所以该实验不能说明样品中有NaOH。
(3)CaCl2和Na2CO3反应生成CaCO3沉淀和NaCl,所以若A是CaCl2溶液,当实验现象a为有白色沉淀产生,现象b为无色酚酞试液不变色时,猜想Ⅱ成立。
[反思] 根据氢氧化钠和二氧化碳反应生成碳酸钠和水进行分析。
[方法点拨] 检验氢氧化钠变质有多种方法:①生成物中有气体:依据碳酸钠和盐酸反应会生成氯化钠、水和二氧化碳;②生成物中有沉淀:依据氯化钙或者氯化钡和碳酸钠反应会生成碳酸钙沉淀。检验原物质是否存在:碳酸钠溶液显碱性,干扰了氢氧化钠的检验,要检验是否存在氢氧化钠,需要排除碳酸钠的干扰,即用过量的氯化钡或氯化钙除去碳酸钠,再用酚酞试液检验氢氧化钠是否存在。
![]()
1.已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。下列关于氢氧化锂的化学性质的说法中,错误的是( )
A.能与二氧化碳反应
B.能使无色酚酞试液变红
C.能使紫色石蕊试液变红
D.向氢氧化锂溶液中滴加硫酸铜溶液产生蓝色沉淀
2.向氢氧化钠溶液中不断滴入稀盐酸,得到如图2-2所示的曲线,下列有关判断不正确的是( )
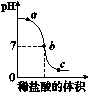
图2-2
A.a点时溶液中有氢氧化钠和氯化钠
B.a点到b点溶液中盐酸的量不断增大
C.b点时,HCl与NaOH恰好完全反应
D.b点到c点时,溶液中氯化钠的量不再增加
3.要检验仓库中的氢氧化钠溶液是否变质,下列检验方法错误的是( )
A.取样品溶于水后加入稀盐酸
B.取样品溶于水后加入酚酞试液
C.取样品溶于水后加入氯化钙溶液
D.取样品溶于水后加入澄清石灰水
4.碱石灰是NaOH与CaO的混合物,取一定量露置于空气中部分变质的碱石灰,加水充分搅拌后过滤,所得物质成分可能是( )
选项 | A | B | C | D |
滤液中 的溶质 | NaOH、 Ca(OH)2 | NaOH | NaOH、 Na2CO3 | Na2CO3 |
滤渣 | CaCO3、 Ca(OH)2 | Ca(OH)2 | CaCO3、 Ca(OH)2 | CaCO3 |
5.下列有关NaOH和Ca(OH)2的性质的叙述中,错误的是( )
①都是白色固体 ②都极易溶于水放出大量热
③溶液都能使无色酚酞试液变红 ④都能和酸发生中和反应 ⑤溶液中通入CO2都生成白色沉淀 ⑥溶液与碳酸钠溶液反应都变浑浊
A.② B.⑤⑥
C.①②⑤ D.②⑤⑥
6.亚硫酸盐的一些性质和碳酸盐的性质类似,如:Na2SO3(亚硫酸钠)溶液呈碱性,BaSO3(亚硫酸钡)是白色难溶于水的固体。工业上常用NaOH来吸收SO2气体。现有吸收SO2一段时间后的NaOH样品,请选用下列试剂:盐酸、稀硫酸、蒸馏水、Ba(OH)2溶液、Ba(NO3)2溶液[已知Ba(NO3)2溶液呈中性]、pH试纸、石蕊指示剂,仪器自选,设计一个简单的实验判断该样品中NaOH是否反应完全,请完成下列实验步骤:
①取少量吸收SO2一段时间后的NaOH样品,用适量蒸馏水完全溶解;
②取少量该样品溶液于试管中;
③往试管中逐滴加入____________________,直到___________________________________时,停止加入;
④后续实验的操作是________________________________________________,若观察到________,则NaOH已完全反应。
7.某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴入某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
[提出问题] 是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
[猜想与假设] 他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
你认为可能还与________(写一条即可)有关。
[设计实验] 三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 设计这一步 骤的目的 | 实验现象 | 实验结论 |
①将NaOH溶液加热煮沸 | __________ __________ | 溶液变红,过一会儿红色消失 | 甲同学猜想______(填“正确”或“不正确”) |
②向冷却后的溶液中滴入酚酞,并滴一些植物油在其上方 | __________ __________ |
(2)乙同学设计如图2-3中Ⅰ装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。请写出CO2与NaOH溶液反应的化学方程式:____________________。甲同学认为乙同学的实验不够严谨,理由是
________________________________________________________________________。
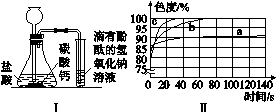
图2-3
(3)丙同学使用了色度传感器测溶液的颜色。他在a、b、c三个比色皿中分别加入等量5%、10%、20%的NaOH溶液,然后各滴加2滴酚酞试液。溶液颜色的变化曲线如图Ⅱ[说明:溶液无色时色度值(透过率)为100%]。请你观察图Ⅱ回答问题。
①写出两条规律性结论:____________________________;____________________________。
②推测5%的NaOH溶液滴加2滴酚酞试液后褪为无色的时间约为________。
A.小于30 s B.30~90 s
C.90~140 s D.140~180 s
E.180~280 s F.大于280 s
8.某研究性学习小组对中和反应进行探究,请你参与实验:
实验1:证明酸与碱发生了反应。
稀盐酸与NaOH溶液混合没有明显现象,小丽同学按图2-4甲进行实验,证明了盐酸与NaOH溶液发生化学反应,她依据的实验现象是_________________________________________。
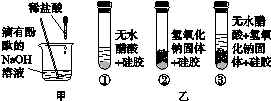
图2-4
实验2:证明酸与碱反应有水生成。
小明同学取变色硅胶固体(吸水后由蓝色变为红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行图乙所示的三个实验。
(1)观察发现实验①②的硅胶不变色,这两个实验的目的是______________________________。
(2)加入试剂后,要迅速塞紧橡胶塞的原因是________________________________________。
(3)能证明酸与碱反应有水生成的现象是____________________________________________
________________________________________________________________________。
实验3:测量酸与碱反应过程的pH、温度变化。
取一定量的稀盐酸,向其中逐滴匀速滴加NaOH溶液,用传感器实时获得溶液的pH、温度变化曲线如图2-5所示。

图2-5
(1)0~t1时,溶液的酸碱性变化情况是____________________________。
(2)由图分析,酸与碱发生了反应的依据是____________________________________,酸与碱的反应是________(填“吸热”或“放热”)反应。
9.实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究。
[发现问题] 该样品中含有哪些物质?
[查阅资料] (1)NaOH在空气中不会转化成NaHCO3。
(2)BaCl2溶液呈中性,Ba(OH)2是可溶性碱。
(3)CO2在饱和的NaHCO3溶液中几乎不溶解。
[提出猜想] 猜想Ⅰ:NaOH;
猜想Ⅱ:Na2CO3;
猜想Ⅲ:NaOH和Na2CO3。
[设计实验]
实验操作 | 实验现象 |
| 步骤①:样品全部溶解 步骤②:观察到现象A |
[收集证据] (1)若现象A是有气泡产生,则X溶液为________,则________(填“猜想Ⅰ”“猜想Ⅱ”或“猜想Ⅲ”)不成立。
(2)若X溶液为BaCl2溶液,现象A是有白色沉淀生成,则产生沉淀的化学方程式是______________________________,取反应后的上层清液,测定其pH,当pH________(填“>”“<”或“=”)7时,证明猜想Ⅲ成立。
[定量分析] 确定部分变质样品中Na2CO3的质量分数。
兴趣小组的同学用如图2-6所示装置进行实验。
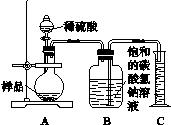
图2-6
步骤如下:①按图连接好装置,并检查气密性;
②准确称取该样品1.0 g,放入烧瓶内;
③打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;
④反应结束后,量筒内液体为55.0 mL(已知:室温条件下,CO2的密度为1.6 g·L-1)。
(1)B装置集气瓶内原有的空气对实验结果______(填“有”或“没有”)影响。饱和NaHCO3溶液如果用水代替,则所测CO2体积________(填“偏大”“偏小”或“不变”)。
(2)计算该样品中Na2CO3的质量分数。(写出计算过程,计算结果保留一位小数)
[实验反思] 有同学指出,上述三种猜想并不全面,请再提出一种猜想:________________________________________________________________________。
答案
1.C 氢氧化锂可溶于水且与氢氧化钠的性质相似,则其具有碱的通性。二氧化碳和氢氧化锂反应生成碳酸锂和水;氢氧化锂溶液能使紫色石蕊变蓝,使无色酚酞变红;氢氧化锂能与硫酸铜溶液反应生成氢氧化铜蓝色沉淀。
2.B a点已经滴入一定量的盐酸,盐酸与氢氧化钠反应生成氯化钠,但溶液的pH仍大于7,说明氢氧化钠还有剩余,故溶液中既有氢氧化钠又有氯化钠;b点溶液的pH等于7,说明盐酸与氢氧化钠恰好完全反应,故从a点到b点溶液中滴入的盐酸完全和氢氧化钠反应,溶液中没有盐酸;b点溶液中氢氧化钠已消耗完全,故b点到c点时,溶液中氯化钠的量不再增加。
3.B 氢氧化钠、碳酸钠均显碱性,遇酚酞试液均显红色,故只选用酚酞试液不能检验氢氧化钠溶液是否变质。
4.A 氢氧化钠与二氧化碳反应会生成碳酸钠,氧化钙与水反应会生成氢氧化钙,氢氧化钙又可以与碳酸钠反应生成碳酸钙和氢氧化钠。①当氢氧化钙与碳酸钠恰好完全反应时,溶液中只有NaOH,滤渣中只有CaCO3;②当碳酸钠过量时,溶液中有NaOH、Na2CO3,滤渣中只有CaCO3;③当氢氧化钙过量时,溶液中有NaOH、Ca(OH)2,滤渣中有CaCO3[或CaCO3、Ca(OH)2,因为Ca(OH)2微溶]。
5.D 氢氧化钙和氢氧化钠都是白色固体;氢氧化钠易溶于水放出大量热,而氢氧化钙微溶于水;氢氧化钙和氢氧化钠溶液都显碱性,都能使无色酚酞试液变红;氢氧化钙和氢氧化钠都能和酸发生中和反应;氢氧化钙溶液中通入CO2生成白色沉淀碳酸钙,而氢氧化钠溶液中通入CO2不生成白色沉淀;氢氧化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀而变浑浊,而氢氧化钠溶液与碳酸钠溶液不反应。
6.③硝酸钡溶液 不再有白色沉淀生成
④用洁净、干燥的玻璃棒蘸取试管中的溶液,滴在pH试纸上,与标准比色卡对比(或向试管中滴入石蕊指示剂) pH等于7(或溶液显紫色)
③实验要判断氢氧化钠是否反应完全,因为亚硫酸钠呈碱性,所以要消除亚硫酸钠的影响,滴加硝酸钡溶液至不再有沉淀产生,说明亚硫酸钠已经完全反应。④通过判断溶液的酸碱性,来判断溶液中是否有氢氧化钠,用pH试纸或者紫色石蕊指示剂都可以,若观察到pH等于7或者溶液为紫色,证明氢氧化钠已经反应完了。
7.[猜想与假设] 滴入酚酞试液的多少(或滴入酚酞试液的浓度大小或氢氧化钠溶液中含有的杂质等,合理即可)
[设计实验] (1)除去溶液中的氧气 隔绝氧气
不正确
(2)2NaOH+CO2===Na2CO3+H2O 若制取的二氧化碳气体中混有氯化氢气体,试管中溶液的红色也能褪去
(3)①氢氧化钠溶液的浓度越大,酚酞试液变红后褪色越快 氢氧化钠溶液的浓度越小,起始时色度值越大 ②F
8.实验1:滴有酚酞的NaOH溶液由红色变为无色
实验2:(1)证明反应物中没有水
(2)防止空气中的水蒸气进入试管干扰实验
(3)试管③中硅胶由蓝色变为红色,试管①②中硅胶不变色
实验3:(1)溶液酸性减弱,t1时变为中性
(2)溶液pH变大,t1时pH=7 放热
实验1:根据溶液中颜色的变化确定,盐酸和氢氧化钠发生了中和反应。实验2:(1)①和②的实验目的是证明无水醋酸和氢氧化钠固体中无水,不能使硅胶变色。(2)为了防止空气中的水蒸气进入试管中对实验产生干扰,实验过程中要迅速塞紧橡胶塞。(3)根据试管③中硅胶由蓝色变为红色,试管①②中硅胶不变色,证明反应中有水生成。实验3:(1)0~t1时,溶液的pH逐渐增大,酸性减弱,t1时pH=7为中性。(2)根据溶液pH变大,t1时pH=7,说明酸与碱发生反应,随着反应的进行,溶液温度升高,说明中和反应是放热反应。
9.[收集证据] (1)稀盐酸(合理即可) 猜想Ⅰ
(2)BaCl2+Na2CO3===BaCO3↓+2NaCl >
[定量分析] (1)没有 偏小
(2)解:55.0 mL=0.055 L,反应生成CO2的质量为:1.6 g·L-1×0.055 L=0.088 g。
设参加反应的碳酸钠的质量为x。
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
106 44
x 0.088 g
= x=0.212 g
所以该样品中Na2CO3的质量分数为:
×100%=21.2%。
答:该样品中Na2CO3的质量分数为21.2%。
[实验反思] NaOH、Na2CO3、H2O
[收集证据] (1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以若现象A是有气泡产生,则X溶液为稀盐酸,则猜想Ⅰ不成立。(2)氯化钡和碳酸钠反应会生成碳酸钡沉淀和氯化钠,化学方程式为:BaCl2+Na2CO3===BaCO3↓+2NaCl,猜想Ⅲ中含有碳酸钠、氢氧化钠,所以取反应后的上层清液,测定其pH>7。[定量分析] (1)空气中含有的二氧化碳量很少,不会对结果产生大的影响。二氧化碳易溶于水,且会与水反应,所以饱和NaHCO3溶液如果用水代替,则所测CO2体积偏小。
【培优导学案】浙教版科学九年级全册:8、有关金属的图像问题、金属性质 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:8、有关金属的图像问题、金属性质 学案(含解析),共12页。
【培优导学案】浙教版科学九年级全册:7、酸、碱、盐 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:7、酸、碱、盐 学案(含解析),共12页。
【培优导学案】浙教版科学九年级全册:23、人体健康 学案(含解析): 这是一份【培优导学案】浙教版科学九年级全册:23、人体健康 学案(含解析),共8页。














