



化学苏教版 (2019)第二单元 微粒之间的相互作用学案
展开第2课时 共价键
目标导航
课程标准
课标解读
1.认识构成物质的微粒之间相互作用,结合典型实例认识共价键的形成,建立化学键的概念。
2.准确判断化学键及化合物的类型,电子式的书写及正误判断。
1.能判断简单离子化合物和共价化合物中的化学键类型。(宏观辨识与微观探析)
2.能从化学键视角认识物质的多样性,会分析物质变化中的化学键变化。(变化观念与平衡思想)
3.通过学习短周期常见元素的原子、分子及化合的物的电子式等,建立认知模型,能分析同主族类似物质的电子式及化学键等。(科学探究与创新意识)
知识点01 共价键
1.共价键的形成过程
(1)氯化氢分子的形成过程
①H原子需获得1个电子达到稳定结构,Cl原子需获得1个电子达到稳定结构。
②H原子和Cl原子各提供1个电子组成一对共用电子,使两原子最外电子层都达到稳定结构并产生强烈的相互作用,从而形成了HCl分子。
(2)请用电子式表示HCl的形成过程:。
2.共价键
(1)概念:原子间通过共用电子对形成的强烈的相互作用称为共价键。
(2)成键微粒:原子。
(3)成键元素:一般是同种的或不同种的非金属元素。
(4)成键条件:成键原子成键前最外层电子未达到饱和状态。
【即学即练1】下列关于共价键的说法正确的是( )
A.共价键只存在于非金属原子间
B.两个原子形成共价键时,原子之间只能存在一对共用电子对
C.两个原子形成共价键时,每个原子周围都有8个电子
D.共价键是通过共用电子对形成的一种相互作用
答案:D
解析:A选项,共价键存在于得失电子能力相差不大的原子之间,非金属原子间存在共价键,得失电子能力相差不大的金属原子和非金属原子间也可能存在共价键,错误;B选项,两个原子形成共价键,原子间可能存在一对或多对共用电子对,错误;C选项,H原子与其他原子形成共价键时,H原子周围只有2个电子,错误;D选项,共价键是通过共用电子对形成的一种相互作用,正确。故选D。
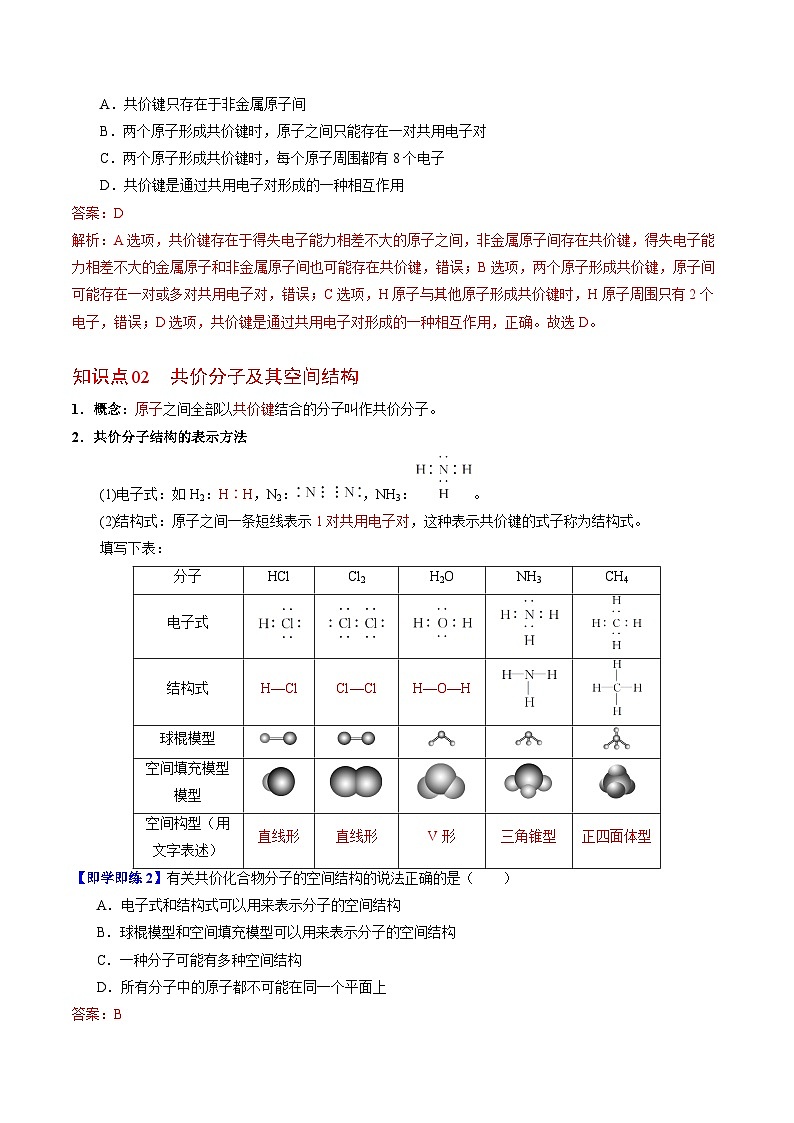
知识点02 共价分子及其空间结构
1.概念:原子之间全部以共价键结合的分子叫作共价分子。
2.共价分子结构的表示方法
(1)电子式:如H2:H∶H,N2:,NH3:。
(2)结构式:原子之间一条短线表示1对共用电子对,这种表示共价键的式子称为结构式。
填写下表:
分子
HCl
Cl2
H2O
NH3
CH4
电子式
结构式
H—Cl
Cl—Cl
H—O—H
球棍模型
空间填充模型模型
空间构型(用文字表述)
直线形
直线形
V形
三角锥型
正四面体型
【即学即练2】有关共价化合物分子的空间结构的说法正确的是( )
A.电子式和结构式可以用来表示分子的空间结构
B.球棍模型和空间填充模型可以用来表示分子的空间结构
C.一种分子可能有多种空间结构
D.所有分子中的原子都不可能在同一个平面上
答案:B
解析:A选项,电子式和结构式都不能表示分子的空间结构,错误;B选项,球棍模型和空间填充模型可以用来表示分子的空间结构,正确;C选项,一种分子只能有一种结构,错误;D选项,分子中的原子与分子的空间结构有关,可能在同一平面上,错误。故选B。
知识点03 共价化合物
1.概念:直接相邻的原子间以共价键结合形成的化合物。
2.常见的共价化合物
(1)非金属氢化物:如H2S、NH3、SiH4等;
(2酸:如HCl、HNO3、H2SO4等;
(3)弱碱:NH3·H2O;
(4)非金属氧化物:如CO2、CO、SO2等;
(5)有机物:如CH4、C2H5OH等。
3.含共价键的原子团和离子化合物的电子式
对一些原子团式的离子和含原子团的化合物也可以用电子式表示。
写出下列离子和离子化合物的电子式:
OH-:、NH:、O:
NaOH:、NH4Cl:、Na2O2:、Ba(OH)2:。
【即学即练3】下列有关共价化合物和离子化合的说法正确的是( )
A.共价化合物中只存在共价键
B.离子化合物中只存在离子键
C.共价化合物分子可能只由一种元素组成
D.全部由非金属元素组成的物质不可能是离子化合物
答案:A
解析:A选项,共价化合物是直接相邻的原子间以共价键结合形成的化合物,故共价化合物中只存在共价键,正确;B选项,离子化合物中可能存在共价键,如NaOH中,H、O原子间为共价键,错误;C选项,只由一种元素组成的物质是单质,不属于化合物,错误;D选项,全部由非金属元素组成的物质可能是离子化合物,如NH4Cl等,错误。故选A。
【即学即练4】有下列物质:①Na2O②Na2O2③Na2CO3④乙烷(C2H6)⑤H2O2
(1)属于离子化合的是________,属于共价化合物的是_______。
(2)只含有离子键的是_______,既含有离子键又含有共价键的是______。
答案:(1)①②③ ④⑤ (2)① ②③
知识点04 碳原子的成键特点
1.碳四价原理
碳原子位于第2周期第ⅣA族,原子的最外层有4个电子。在化学反应中,碳原子既不易失去电子,也不易得到电子,通常与其他原子以共价键结合。
碳原子最外层有4个电子,一个碳原子可以和其他原子形成4对共用电子对。
2.碳原子的成键方式
碳原子之间可以通过一对、两对或三对共用电子对相结合,分别构成碳碳单键(C-C)、碳碳双键(C=C)、碳碳三键(C≡C)。
碳原子之间可以通过共价键彼此结合形成碳链,也可以形成碳环。
【即学即练5】碳原子最外层有4个电子,可以形成4对共用电子对,因此碳原子的成键方式有多种。
(1)请根据碳原子的成键情况,写出对应物质的结构式(只要求能写出一种)
①形成4个单键:_____________ ②形成2个单键和一个双键:_____________
③形成1个单键和1个叁键:___________ ④形成2个双键:__________________
(2)氮原子最外层有5个电子,可以形成_____对共用电子对。请对照碳原子的成键情况,分析氮原子的成键情况,并举例说明。
(3)水分子的组成为什么是H2O而不是H3O?
答案:(1)
(2)3 ①形成3个单键,如;②形成1个叁键,如。
(3)氧原子最外层有6个电子,H原子最外层有1个电子,因此氧原子只能结合2个氢原子,形成稳定结构。
能力拓展
考法01 共价键与离子键
化学键类型
离子键
共价键
概念
阴、阳离子间通过静电作用形成的化学键
原子间通过共用电子对形成的化学键
成键微粒
阴、阳离子
原子
成键本质
阴、阳离子间的静电作用
共用电子对对两原子核产生的电性作用
成键元素
活泼金属与活泼非金属之间化合时,易形成离子键。如第ⅠA族、第ⅡA族的金属元素与第ⅥA族、第ⅦA族的非金属元素之间
一般是非金属元素原子间形成共价键;某些不活泼金属与不活泼非金属原子之间也能形成共价键
形成过程
形成物质
离子化合物:大部分盐、强碱、活泼金属氧化物、其他类物质如Na2O2、NaH等
非金属单质(稀有气体除外);共价化合物及复杂的离子化合物
【典例1】下列叙述不正确的是( )
A.同种元素原子间不可能形成离子键
B.两种不同的非金属元素构成的化合物中都含有共价键
C.只有金属和非金属元素原子化合时才能形成离子键
D.形成离子键的阴、阳离子间存在静电吸引力
答案:C
解析:A选项,同种元素的原子得失电子能力相同,不可能形成离子键,正确;B选项,不同非金属元素之间一定会形成共价键,正确;C选项,得失电子能力相差不大的金属和非金属元素原子化合时,可能形成离子键,错误;D选项,形成离子键的阴、阳离子间同时存在静电吸引力和静电斥力,正确。故选C。
考法02 离子化合物与共价化合物的区别
1.概念
依据化合物中化学键的成键情况,可将化合物分为离子化合物和共价化合物。
离子化合物是由离子键形成的化合物;共价化合物是只由共价键形成的化合物。
2.化学键类型
离子化合物一定存在离子键,可能存在共价键;共价化合物只有共价键,没有离子键。
3.判断离子化合物和共价化合物的方法
(1)由化学键类型判断
只含有共价键的化合物是共价化合物,只含离子键或既含离子键又含共价键的化合物是离子化合物。
(2)由化合物类型判断
①活泼金属的氧化物、强碱和大多数盐(少数盐如AlCl3、BeCl2等除外)属于离子化合物;
②非金属氧化物、非金属氢化物、含氧酸、多数有机物、少数盐(如AlCl3、BeCl2)属于共价化合物。
(3)由组成元素判断
一般含金属元素或NH的化合物是离子化合物(AlCl3、BeCl2等少数除外),如NH4Cl、Ca(OH)2、KClO3等;只由非金属元素构成的化合物(铵盐等除外)属于共价化合物。
4.化学键和化合物的关系
(1) “一定”
①离子化合物中一定含有离子键;
②含有离子键的化合物一定是离子化合物(一定不是共价化合物);
③共价化合物中一定不含离子键(一定含有共价键);
④只含有共价键的化合物一定是共价化合物(一定不是离子化合物)。
(2) “不一定”
①离子化合物中不一定含有共价键;
②金属元素和非金属元素形成的化合物不一定是离子化合物,如AlCl3是共价化合物;
③含有共价键的化合物不一定是共价化合物;
④只含非金属元素的化合物不一定是共价化合物,如铵盐是离子化合物。
【典例2】下列有关化学键的叙述正确的是( )
A.离子化合物中一定有离子键
B.含有共价键的化合物一定是共价化合物
C.非金属元素组成的化合物中只含共价键
D.单质分子中都存在化学键
答案:A
解析:A正确,离子化合物的定义就是含有离子键的化合物;B不正确,只含有共价键的化合物,才是共价化合物;C不正确,非金属元素组成的化合物中也可能既含共价键,又含离子键,如NH4Cl中NH与Cl-之间以离子键结合,N与H之间以共价键结合;D不正确,稀有气体不含有共价键。
考法03 常用的化学用语的表示方法
原子或离子结构示意图
核素符号
中子数为14的镁原子为Mg、中子数为20的氯原子为Cl
电子式
Ba(OH)2:H2O:
球棍模型
甲烷: 乙烯:
空间填充模型
甲烷: 乙烯:
结构式
CO2:O==C==O HClO:H—O —Cl
化学式
臭氧:O3 明矾:KAl(SO4)2·12H2O
电离方程式
NaOH的电离:NaOH===Na++OH-
【典例3】下列表示物质结构的化学用语或模型图正确的是( )
A.H2O2的电子式:
B.CS2的空间填充模型:
C.14C的原子结构示意图:
D.CCl4的结构式:
答案:B
解析:H2O2为共价化合物,电子式中存在共用电子对,不是阴阳离子,A错误;CS2的空间填充模型为,B正确;14C质子数为6,C错误;结构式用一根短线表示一对共用电子,其他电子不表示出来,D错误。
分层提分
题组A 基础过关练
1.下列叙述正确的是( )
A.离子键只存在于金属阳离子与酸根阴离子之间
B.两种非金属元素形成AB型化合物,它一定含共价键
C.物质中化学键破坏了,一定发生化学变化
D.化学键类型由元素类别决定
答案:B
解析:氧化钠、氯化铵等都含有离子键,A项错误;非金属原子之间形成的化学键一定是共价键,注意氯化铵之间的离子键属于铵根离子与氯离子之间的作用力,不属于原子之间作用力,B项正确;物质中有旧化学键断裂,同时有新化学键形成的变化才是化学变化,而像氯化钠熔化、氢氧化钠溶于水等都不是化学变化,C项错误;离子化合物不一定含金属元素,如铵盐,含金属元素的化合物不一定是离子化合物,如氯化铝,D项错误。
2.下列分子的电子式书写正确的是( )
A.氨气 B.四氯化碳
C.氮气 D.二氧化碳
答案:C
3.下列分子的电子式书写正确的是( )
A.氨气: B.四氯化碳:
C.氮气: D.二氧化碳:
答案:C
解析:选项A中漏写氮原子未参与成键的电子对;B项中氯原子的最外层电子没有全部标出;D项中C、O共用电子对数目标错,碳原子不满足8电子稳定结构,正确写法为。
4.下列化学用语正确的是( )
A.氮分子的电子式: B.氯原子的结构示意图:
C.溴化钠的电子式: D.氨分子的结构式:
答案:D
5.下列物质中,属于共价化合物的是( )
A.氧化钙 B.氮气 C.硫化钠 D.硫化氢
答案:D
解析:B选项,氮气为单质,注意选择化合物。
6.下列物质中化学键类型相同的是( )
A.CaCl2和H2O2 B.Na2O2和Na2S
C.NaOH和HF D.H2O和NH3
答案:D
7.下列物质的电子式书写正确的是( )
答案:D
8.下列物质中,既有离子键又有共价键的是( )
A.CaCl2 B.KOH C.H2O D.HF
答案:B
9.下列用电子式表示物质的形成过程,正确的是( )
A.
B.
C.
D.
答案:D
解析:HCl是共价化合物,其电子式为,NaBr是离子化合物,其电子式是,MgF2的电子式为。
10.下列物质中只含有共价键的是( )
A.NaCl、HCl、H2O、NaOH B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2 D.Na2O2、H2O2、H2O、O3
答案:C
11.下列各组物质中化学键的类型相同的是( )
A.HCl MgCl2 NH4Cl B.H2O Na2O CO2
C.NH3 H2O CO2 D.CaCl2 NaOH H2O
答案:C
12.下面是同学们熟悉的物质:
①O2 ②NaBr ③H2SO4 ④Na2O2 ⑤Ne
(1)这些物质中,只含有共价键的是______________(填序号,下同);只含有离子键的是____________;既含有共价键又含有离子键的是________________;不存在化学键的是__________________。
(2)属于共价化合物的是________;属于离子化合物的是________。
答案.(1)①③ ② ④ ⑤ (2)③ ②④
解析:①O2 只含有共价键,为单质;②NaBr 只含有离子键;③H2SO4全部有非金属元素组成,只含有共价键,属于共价化合物;④Na2O2 含有Na+和O22-,为离子化合物,含有离子键和共价键(O22-由共价键结合而成);⑤Ne属于稀有气体,为单原子分子,不存在化学键。
题组B 能力提升练
1.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项
A
B
C
D
物质
MgCl2
CO2
HCl
NaOH
所含化学键类型
离子键、共价键
共价键
离子键
离子键、共价键
所属化合物类型
离子化合物
共价化合物
离子化合物
共价化合物
答案:B
解析:A项,MgCl2仅含离子键;C项,HCl含有共价键,是共价化合物;D项,NaOH含有离子键、共价键,是离子化合物。
2.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
答案:B
3.下列各数值表示有关元素的原子序数,其表示的各原子组中能以共价键相互结合形成稳定的共价化合物的是( )
A.8和11 B.9和9 C.2和19 D.6和8
答案:D
解析:非金属原子之间形成的化学键一定是共价键。能形成共价键的有B,能形成F2,但为单质,D选项,两种元素分别为C、O,能形成CO、CO2等化合物。
4.下列化学用语中,正确的是( )
A.次氯酸的结构式:H—O—Cl
B.氮气的电子式:∶N∶∶∶N∶
C.CO2分子的电子式:O=C=O
D.用电子式表示氯化氢分子的形成过程:
答案:A
解析:Cl只能形成一对共用电子对,次氯酸的结构式为H—O—Cl,故A正确;氮气中存在氮氮三键,氮气的电子式为,故B错误;二氧化碳属于共价化合物,分子中存在两个碳氧双键,二氧化碳的电子式为,故C错误;氯化氢是共价化合物,不存在离子键,氢原子与氯原子之间形成1对共用电子对,氯原子最外层有7个电子,氯化氢分子的形成过程:H·+,故D错误。
题组C 培优拔尖练
1.火山爆发产生的气体中含有1 %的羰基硫(化学式为COS,就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )
A.羰基硫中O为-2价,C、S都是+1价
B.羰基硫分子中共含有3个原子核、16个电子
C.羰基硫的电子式为
D.羰基硫分子中只含有共价键
答案:D
解析:由于S和O位于同一主族,因此COS的电子式和CO2的相同,。其中,S、O为-2价,C为+4价。故A、C错误。B选项,COS的电子数为30个,错误。D选项,羰基硫都是非金属原子结合而成,只含有共价键,正确。
2.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
A.K3C60中只有离子键 B.K3C60中不含共价键
C.该晶体在熔融状态下能导电 D.K3C60中只含共价键
答案:C
解析:K3C60中K+和C之间形成离子键,C中C原子和C原子之间形成共价键,A、B项错误;根据题给信息,该物质属于离子化合物,则该晶体在熔融状态下能导电,C项正确;K3C60中既有离子键又有共价键,D项错误。
3.原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW型共价化合物;Y与氧元素可组成Y2O和Y2O2型离子化合物。
(1)写出Y2O2的电子式:_____________,其中含有的化学键是__________________。
(2)用电子式表示Y2O的形成过程:____________________________________。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,酸性最强的是_________(填化学式)。
(4)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物的化学式为____________。
答案:(1) 离子键、共价键
(2)
(3)HClO4 (4)NCl3
解析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,Y与氧元素可组成Y2O和Y2O2型离子化合物,则Y为钠元素,X、Z、W与氢元素可组成XH3、H2Z和HW型共价化合物,X的原子序数小于钠,所以X为氮元素,Z、W的原子序数大于钠,则Z为硫元素,W为氯元素。(1)Y2O2为Na2O2,Na2O2为离子化合物,其电子式为,过氧化钠中含有的化学键为离子键、共价键(非极性键)。(2)Na2O为离子化合物,用电子式表示Na2O的形成过程为。(3)元素非金属性越强,最高价氧化物对应的水化物的酸性越强,在氮、硫、氯中氯元素的非金属性最强,所以酸性最强的是HClO4。(4)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,则该化合物为NCl3。
4.某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为______________。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为__________(已知该反应为置换反应)。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为________,K的原子结构示意图为__________。
答案:(1) (2)Fe (3)离子键和共价键
解析:(1)N2分子内含有三键,氮原子间形成三对共用电子对,其电子式为。(2)Na与Fe2O3发生置换反应,故生成的还原产物为Fe。(3)KClO4是离子化合物,含有离子键、共价键;K属于19号元素,原子结构示意图为。
苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用学案: 这是一份苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用学案,文件包含521离子键教师版-高一化学同步讲义苏教必修第一册docx、521离子键学生版-高一化学同步讲义苏教必修第一册docx等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第二单元 金属钠及钠的化合物学案: 这是一份高中化学苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第二单元 金属钠及钠的化合物学案,文件包含324离子反应教师版-高一化学同步讲义苏教必修第一册docx、324离子反应学生版-高一化学同步讲义苏教必修第一册docx等2份学案配套教学资源,其中学案共23页, 欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物学案及答案: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物学案及答案,文件包含321钠的性质与制备教师版-高一化学同步讲义苏教必修第一册docx、321钠的性质与制备学生版-高一化学同步讲义苏教必修第一册docx等2份学案配套教学资源,其中学案共23页, 欢迎下载使用。