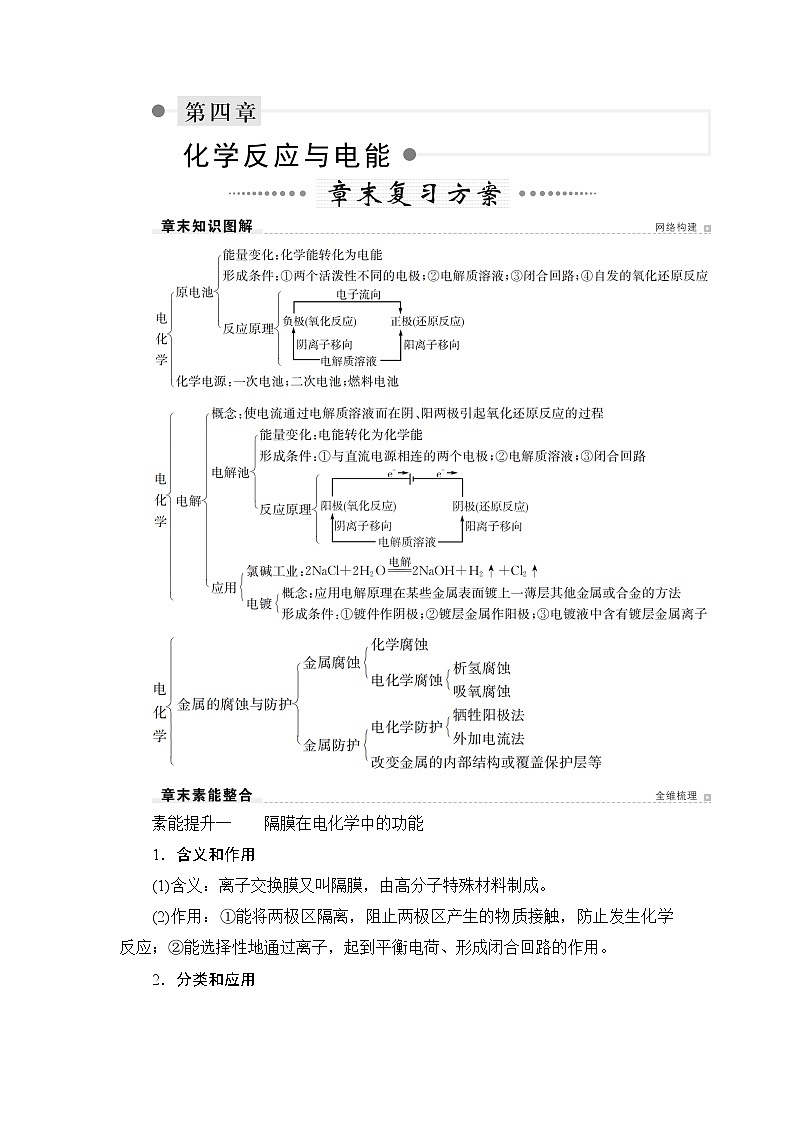

人教版 (2019) 选择性必修1 第四章 章末复习方案学案
展开素能提升一 隔膜在电化学中的功能
1.含义和作用
(1)含义:离子交换膜又叫隔膜,由高分子特殊材料制成。
(2)作用:①能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应;②能选择性地通过离子,起到平衡电荷、形成闭合回路的作用。
2.分类和应用
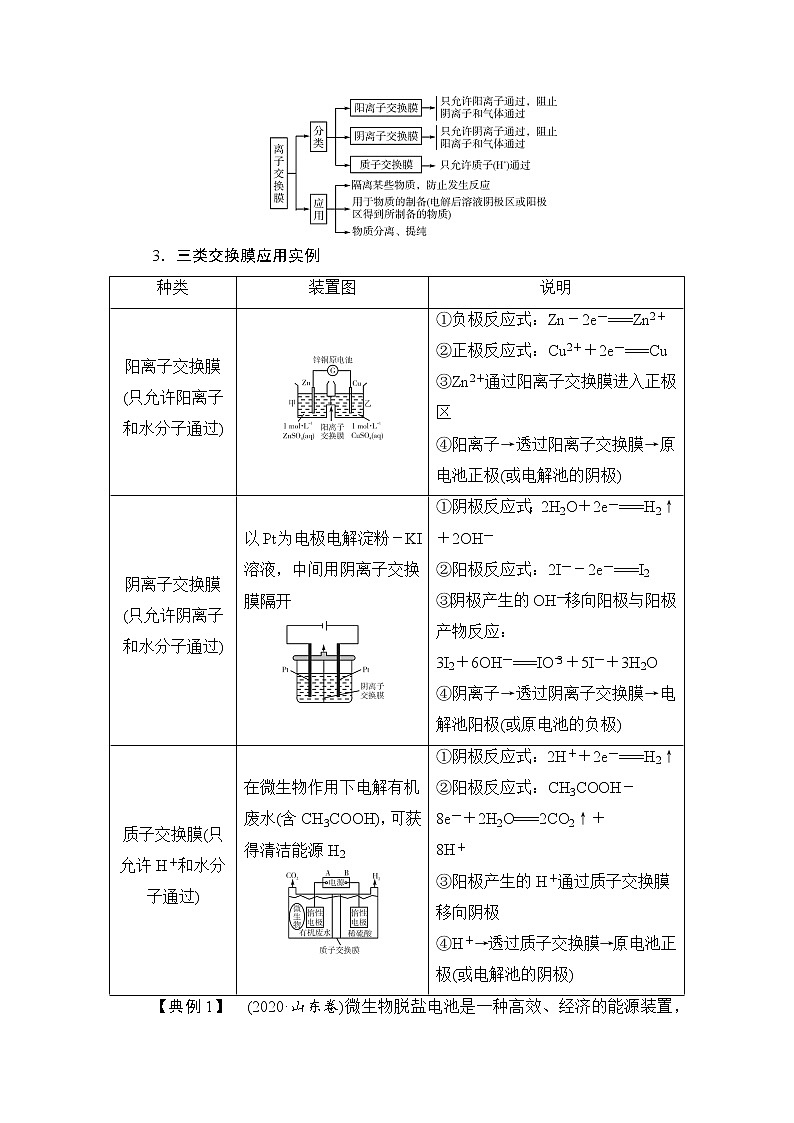
3.三类交换膜应用实例
种类 | 装置图 | 说明 |
阳离子交换膜(只允许阳离子和水分子通过) | ①负极反应式:Zn-2e-===Zn2+ ②正极反应式:Cu2++2e-===Cu ③Zn2+通过阳离子交换膜进入正极区 ④阳离子→透过阳离子交换膜→原电池正极(或电解池的阴极) | |
阴离子交换膜(只允许阴离子和水分子通过) | 以Pt为电极电解淀粉-KI溶液,中间用阴离子交换膜隔开 | ①阴极反应式:2H2O+2e-===H2↑+2OH- ②阳极反应式:2I--2e-===I2 ③阴极产生的OH-移向阳极与阳极产物反应: 3I2+6OH-===IO+5I-+3H2O ④阴离子→透过阴离子交换膜→电解池阳极(或原电池的负极) |
质子交换膜(只允许H+和水分子通过) | 在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2 | ①阴极反应式:2H++2e-===H2↑ ②阳极反应式:CH3COOH- 8e-+2H2O===2CO2↑+ 8H+ ③阳极产生的H+通过质子交换膜移向阴极 ④H+→透过质子交换膜→原电池正极(或电解池的阴极) |
【典例1】 (2020·山东卷)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含 CH3COO-的溶液为例)。下列说法错误的是( )
A.负极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
答案 B
解析 据图可知a极上CH3COO-转化为CO2和H+,C元素被氧化,所以a极为该原电池的负极,b极为正极。负极CH3COO-失电子被氧化成CO2和H+,结合电荷守恒可得电极反应式为 CH3COO-+2H2O-8e-===2CO2↑+7H+,A项正确;为了实现海水的淡化,模拟海水中的氯离子需要移向负极,即a极,则隔膜1为阴离子交换膜,钠离子需要移向正极,即b极,则隔膜2为阳离子交换膜,B项错误;当电路中转移 1 mol 电子时,根据电荷守恒可知,海水中会有 1 mol Cl-移向负极,同时有 1 mol Na+移向正极,即除去 1 mol NaCl,质量为 58.5 g,C项正确;b极为正极,水溶液为酸性,所以氢离子得电子产生氢气,电极反应式为2H++2e-===H2↑,则当转移 8 mol 电子时,正极产生4 mol气体,根据负极反应式可知负极产生 2 mol 气体,物质的量之比为4∶2=2∶1,D项正确。
【变式1】 利用电解法制取Na2FeO4的装置图如图所示,下列说法正确的是(电解过程中温度保持不变,溶液体积变化忽略不计)( )
A.Y是外接电源的正极,Fe电极上发生还原反应
B.Ni电极上发生的电极反应为2H2O-4e-===O2↑+4H+
C.若隔膜为阴离子交换膜,则电解过程中OH-由B室进入A室
D.电解后,撤去隔膜,充分混合,电解液的pH比原来小
答案 D
解析 铁电极为阳极,Y接电源的正极,铁电极上发生失电子的氧化反应Fe+8OH--6e-===FeO+4H2O↑,A项错误;镍电极为阴极,X接电源的负极,镍电极上发生的反应为2H2O+2e-===H2↑+2OH-,B项错误;在电解池装置中,阴离子向阳极移动,OH-由A室进入B室,C项错误;总反应为2Fe+2OH-+2H2O===FeO+3H2↑,由于反应消耗OH-,电解的OH-浓度降低,pH比原来小,D项正确。
素能提升二 多池串联的两大模型及原理分析
1.有外接电源电池类型的判断方法
有外接电源的各电池均为电解池,若电池阳极材料与电解质溶液中的阳离子相同,则该电池为电镀池。如:
则甲为电镀池,乙、丙均为电解池。
2.无外接电源电池类型的判断方法
(1)直接判断
非常直观明显的装置,如燃料电池、铅酸蓄电池等在电路中,则其他装置为电解池。如图所示:A为原电池,B为电解池;甲池为原电池,其余为电解池。
(2)根据电池中的电极材料和电解质溶液判断
原电池一般是两种不同的金属电极或一个金属电极一个碳棒电极;而电解池则一般两个都是惰性电极,如两个铂电极或两个碳棒电极。原电池中的电极材料和电解质溶液之间能发生自发的氧化还原反应,电解池的电极材料一般不能和电解质溶液自发反应。如图所示:B为原电池,A为电解池。
(3)根据电极反应现象判断
在某些装置中根据电极反应或反应现象可判断电极,并由此判断电池类型。如图所示:若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可知乙是原电池,D是正极,C是负极;甲是电解池,A是阳极,B是阴极。B、D极发生还原反应,A、C极发生氧化反应。
3.“串联”类装置的解题流程
【典例2】 假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )
A.当K闭合时,甲装置在电路中作电源
B.当K断开时,乙装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为③→②、①→⑧、⑦→⑥、⑤→④
D.当K闭合后,甲、乙装置中pH变大,丙、丁装置中pH基本不变
答案 A
解析 当K闭合时,乙装置构成原电池,在电路中作电源,整个电路中电子的流动方向为③→②、①→⑧、⑦→⑥、⑤→④,A项错误,C项正确;当K断开时,乙装置中锌片与稀硫酸发生置换反应,产生氢气,B项正确;当K闭合后,乙装置中消耗H+,pH变大,甲装置中电解饱和食盐水,pH变大,丙装置中相当于在银上镀铜,pH基本不变,丁装置中相当于铜的电解精炼,pH基本不变,D项正确。
【变式2】 某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则下列说法正确的是( )
A.电流方向:电极Ⅳ→→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
答案 A
解析 当多个池串联时,根据电池中的电极材料和电解质溶液能否自发反应可知,图示中左边和中间两池组成原电池,右边为电解池。电子移动方向为电极Ⅰ→→电极Ⅳ,电流方向与电子移动方向相反,A项正确;电极Ⅰ为原电池的负极,失去电子,被氧化,发生氧化反应,B项错误;电极Ⅱ为原电池的正极,铜离子在电极Ⅱ上得电子,生成铜单质,该电极质量逐渐增大,C项错误;电极Ⅱ为正极,所以电极Ⅲ为电解池的阳极,其电极反应式为Cu-2e-===Cu2+,D项错误。









