






高中人教版 (2019)第四章 化学反应与电能本单元综合与测试获奖课件ppt
展开燃料电池电极反应式的书写典例1(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,正极反应式是 ;负极反应式是 。
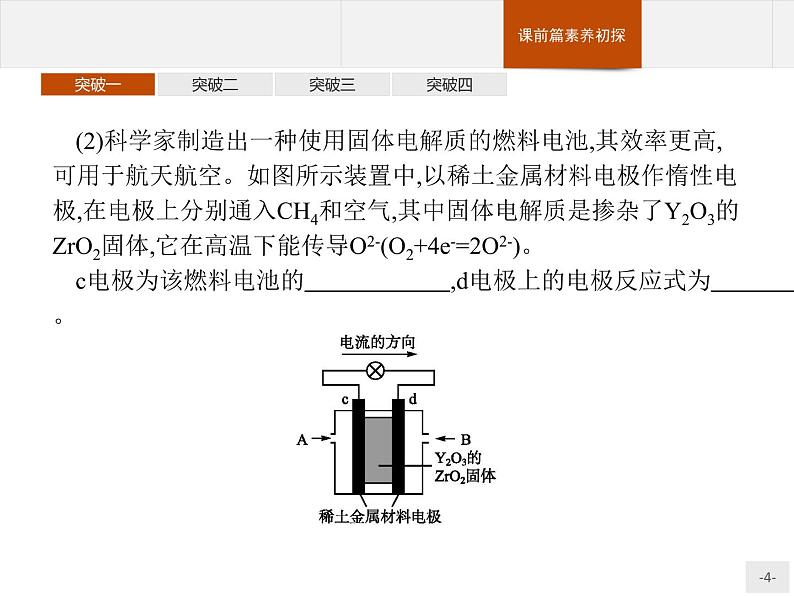
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图所示装置中,以稀土金属材料电极作惰性电极,在电极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-=2O2-)。c电极为该燃料电池的 ,d电极上的电极反应式为 。
答案:(1)O2+4e-+2H2O==4OH- N2H4+4OH--4e-==N2↑+4H2O(2)正极 CH4+4O2--8e-==CO2+2H2O 解析:(1)对于肼—空气燃料电池,正极的电极反应式为O2+4e-+2H2O==4OH-,用总反应减去正极反应式即为负极的电极反应式。(2)原电池中电流的方向是从正极流向负极,故c电极为正极;d电极为负极,通入的气体为甲烷,d电极反应式为CH4+4O2--8e-==CO2+2H2O。
1.燃料电池的组成(1)电极:惰性电极。(2)燃料:包括H2、烃(如CH4)、醇(如C2H5OH)、肼(N2H4)等。(3)电解质:酸性电解质溶液,如H2SO4溶液;碱性电解质溶液,如NaOH溶液;熔融氧化物,如Y2O3;熔融碳酸盐,如K2CO3等。2.书写燃料电池电极反应式的基本步骤(1)第一步:写出电池总反应式。燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加和后的反应。如氢氧燃料电池的总反应为2H2+O2=2H2O;甲烷燃料电池(电解质溶液为NaOH溶液)的反应:CH4+2O2=CO2+2H2O①CO2+2NaOH=Na2CO3+H2O②①+②式得燃料电池总反应为CH4+ 2O2+2NaOH=Na2CO3+3H2O。
(2)第二步:写出电池的正极反应式。根据燃料电池的特点,一般在正极上发生还原反应的物质都是O2,随着电解质溶液的不同,其电极反应有所不同,一般为以下四种情况: ①酸性电解质溶液环境下电极反应式:O2+4H++4e-=2H2O。②碱性电解质溶液环境下电极反应式:O2+2H2O+4e-=4OH-。③固体电解质(高温下能传导O2-)环境下电极反应式:O2+4e-=2O2-。 ④熔融碳酸盐(如熔融K2CO3)环境下电极反应式:O2+2CO2+4e-
(3)第三步:根据电池总反应式和正极反应式写出电池的负极反应式。电池的总反应和正、负极反应之间有如下关系:电池的总反应式=电池正极反应式+电池负极反应式(消去电子)。故根据第一、二步写出的反应:电池的总反应式-电池正极反应式=电池负极反应式,注意在将两个反应式相减时,要约去正极的反应物O2。
3.实例以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法:(1)酸性条件
对点训练1-1用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时发生的反应为CH4+2KOH+2O2=K2CO3+3H2O,下列说法错误的是( )A.通甲烷的一极为负极,通氧气的一极为正极B.放电时,通入O2一极附近溶液的pH升高C.放电一段时间后,KOH的物质的量不发生变化
解析:原电池的负极发生氧化反应,正极发生还原反应,由总反应式知,此燃料电池的电极反应式是:正极2O2+4H2O+8e-==8OH-;
对点训练1-2某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2=2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极B.b极上的电极反应式为O2+2H2O+4e-=4OH-C.每转移0.1 ml电子,消耗1.12 L的H2D.H+由a极通过固体酸电解质传递到b极
答案:D 解析:此装置为燃料电池,充入还原剂H2的一极为负极,电子从负极(a极)流向正极(b极),A项错。电解质为酸性电解质,不可能有大量OH-存在,负极反应为H2-2e-==2H+,正极(b极)反应为O2+4e-+4H+==2H2O,B项错。C项,气体的体积没有指明标准状况,故C错。由反应式知,负极(a极)产生H+,由固体酸电解质传到正极(b极),D项正确。
氯碱工业生产法——离子交换膜法典例2氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空。(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为 , 与电源负极相连的电极附近,溶液的pH (填“不变”“升高”或“下降”)。
a.先加NaOH,后加Na2CO3,再加钡试剂b.先加NaOH,后加钡试剂,再加Na2CO3c.先加钡试剂,后加NaOH,再加Na2CO3(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 (填操作名称,下同)、冷却、 、 除去NaCl。 (5)用隔膜法电解食盐水,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应。采用无隔膜法电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
1.阳离子交换膜的作用电解饱和食盐水是氯碱工业的基础,能制得氯气、氢气、氢氧化钠等重要的化工原料。电解过程中,在电场的作用下,阳离子向阴极移动,而阴离子向阳极移动。由于在阳极氯离子失去电子生成氯气,若不采取措施,氢氧根离子会向阳极移动,从而与氯气发生反应,既减少了氯气的产量,又会使得到的氢氧化钠不纯。因此,必须阻止氢氧根离子向阳极移动。目前,常用的隔膜有石棉隔膜和阳离子交换膜。石棉隔膜能阻止气体通过,但允许水分子及离子通过。由于氢氧根离子能透过该隔膜,因此氯气会与氢氧根发生反应,导致制得的氢氧化钠不纯。阳离子交换膜只允许阳离子通过,而不允许阴离子及气体通过,也就是说,只允许钠离子、氢离子通过,氯离子、氢氧根离子和氢气、氯气均不能通过。这样既可以防止阴极产生的氢气与阳极产生的氯气相混合,在一定条件下引起爆炸,又能避免氯气与氢氧化钠作用生成次氯酸钠而影响烧碱的质量。
杂质,不符合电解要求,因此必须经过精制。(2)杂质的危害:Ca2+、Mg2+、Fe3+等金属离子在碱性环境中会产生沉淀,损坏离子交换膜,此外,杂质的存在会使得到的产品不纯。(3)除杂质的过程:
①除杂质时所加试剂的顺序要求是:a.Na2CO3必须在BaCl2之后;b.盐酸在过滤之后加入。②试剂加入顺序有多种选择,如:a.BaCl2、NaOH、Na2CO3、过滤、HCl;b.BaCl2、Na2CO3、NaOH、过滤、HCl;c.NaOH、BaCl2、Na2CO3、过滤、HCl。
对点训练2用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是( )
A.电池工作时,正极反应式为O2+2H2O+4e-=4OH-B.电解时,a电极周围首先生成Cl2C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极D.忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.02 g H2
答案:D 解析:由于磷酸为电解质,电池的正极反应为O2+4H++4e-==2H2O,选项A不正确;a电极与原电池正极相连,为电解池的阳极,由于Br-还原性强于Cl-,因此Br-先放电生成Br2,选项B不正确;电解时,电子流动路径是:负极→阴极,阳极→正极,电子不能从溶液中通过,选项C不正确;根据电子守恒规律,当电池中消耗0.02 g H2时,b极周围会产生0.02 g H2,选项D正确。
“三池”的比较和联系典例3将Fe片和Zn片放入盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图所示。最先观察到变为红色的区域为 ( )
A.Ⅰ和ⅢB.Ⅰ和ⅣC.Ⅱ和ⅢD.Ⅱ和Ⅳ
答案:B 解析:本题考查原电池和电解池的判断以及各自的工作原理。甲图是原电池,负极(Zn):Zn-2e-==Zn2+;正极(Fe):2H++2e-==H2↑,在Ⅰ区域H2O电离出的OH-浓度较Ⅱ高,能使无色酚酞溶液变成红色。乙图是电解池,阳极(Fe):Fe-2e-==Fe2+;阴极(Zn):2H++2e-==H2↑,在Ⅳ区域H2O电离出的OH-浓度相对Ⅲ较高,能使无色酚酞溶液变红色,综上所述选项B正确。
“三池”的比较与联系
区分原电池、电解池、电镀池方法:首先看有无外接电源:①若无则可能是原电池,然后按照原电池形成条件分析判定(看电极材料、电解质溶液,是否形成闭合回路等)。②若有外接电源,两极插入电解质溶液中,当电解质溶液中含阳极金属离子时则为电镀池,否则为电解池。“两池”中电极的判断易混淆,现总结口诀如下:原电池,正负极;电解池,阴阳极;失去电子负(原电池)阳(电解池)极;发生氧化定无疑。我们还可以根据上述原理总结出一些规律,如:质量增加的电极一般为原电池的正极、电解池的阴极;质量减轻的电极一般为原电池的负极、电解池的阳极。
对点训练3-1下列图示中关于铜电极的连接错误的是( )
答案:C 解析:电镀铜时,Cu作阳极,镀件作阴极,故C错。
对点训练3-2下列四种装置中,溶液的体积均为250 mL,开始时电解质溶液的浓度均为0.10 ml·L-1,工作一段时间后,测得导线上均通过0.02 ml电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
A.工作一段时间后溶液的浓度:①=②=③=④B.工作一段时间后溶液的pH:④>③>①>②C.产生气体的总体积:④>③>①>②D.电极上析出固体的质量:①>②>③>④
答案:B 解析:装置①是用惰性电极电解CuSO4溶液,电解时的总反应式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,当测得导线上通过0.02 ml电子时,共消耗0.01 ml CuSO4,生成0.01 ml Cu、0.005 ml O2和0.01 ml H2SO4。装置②为锌铜原电池装置,原电池的总反应式为Zn+H2SO4==ZnSO4+H2↑,当测得导线上通过0.02 ml电子时,共消耗0.01 ml H2SO4,还余0.015 ml H2SO4,生成0.005 ml H2,无固体析出。装置③为电镀锌装置,阴极铁棒上的电极反应式为Zn2++2e-==Zn,随着电解的进行,电解液的浓度不发生变化,导线中通过0.02 ml电子时,阴极上析出0.01 ml锌。装置④相当于用惰性电极电解NaCl溶液,电解时的总反应式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,当测得导线上通过0.02 ml电子时,共消耗0.02 ml NaCl,生成0.02 ml气体和0.02 ml NaOH,无固体析出。
电化学组合装置的分析典例4(2020重庆巴蜀中学月考)储氢材料是当前新能源领域研究的一类热门材料。在一定条件下,以Cu-Zn原电池作电源,利用下图所示装置可实现有机物的储氢,下列有关说法正确的是( )
A.在Cu-Zn原电池装置工作时,盐桥内的Cl-向铜电极一端移动B.电极C为阳极,在电极D上发生还原反应C.气体X的主要成分是H2D.H+透过高分子膜从右室进入左室,在电极C上发生还原反应
答案:D 解析:在Cu-Zn原电池装置工作时,锌为负极,铜为正极,阴离子向负极移动,因此盐桥内的Cl-向锌电极一端移动,A错误;锌为负极,铜为正极,因此电极C为阴极,电极D为阳极,阳极上发生氧化反应,B错误;电极D为阳极,阳极上发生氧化反应,溶液中的氢氧根离子放电生成氧气,C错误;电解池工作时,阳离子从阳极室移向阴极室,H+透过高分子膜从右室进入左室,在电极C上发生还原反应,D正确。
判断“多池组合”中装置的种类(1)直接判断非常直观明显的装置,如燃料电池、铅酸蓄电池等在电路中为原电池,则其他装置为电解池。如下图,A为原电池,B为电解池。
(2)根据电池中的电极材料判断原电池一般是两种不同的金属电极或一种金属电极、一种导电的非金属电极;而电解池则一般是两个惰性电极,如两个铂电极或两个石墨棒。(3)根据电池中的电解质溶液判断原电池中的负极材料和电解质溶液之间一般能发生自发的氧化还原反应,电解池的电极材料一般不能和电解质溶液自发反应。如下图,B为原电池,A为电解池。
(4)根据电极反应现象判断在某些装置中,根据电极反应或反应现象可判断电极类型,并由此判断装置类型。如下图,若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可知乙是原电池,D是正极,C是负极;甲是电解池,A是阳极,B是阴极。B、D极发生还原反应,A、C极发生氧化反应。
对点训练4空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能本单元综合与测试评优课习题课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能本单元综合与测试评优课习题课件ppt,文件包含4本章整合课件新教材人教版2019高中化学选择性必修一共39张PPTpptx、第四章测评课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共39页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡本单元综合与测试优质习题课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡本单元综合与测试优质习题课件ppt,文件包含3本章整合课件新教材人教版2019高中化学选择性必修一共23张PPTpptx、第三章测评课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡本单元综合与测试优秀习题ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡本单元综合与测试优秀习题ppt课件,文件包含2本章整合课件新教材人教版2019高中化学选择性必修一共27张PPTpptx、第二章测评课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













