


- 新教材2023高中化学第二章化学反应速率与化学平衡第二节化学平衡课时2化学平衡常数同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡第二节化学平衡课时3影响化学平衡的因素同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第二章化学反应速率与化学平衡素养提升课化学反应速率化学平衡图像同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学章末质量评估第三章水溶液中的离子反应与平衡新人教版选择性必修1 试卷 试卷 0 次下载
- 新教材2023高中化学第三章水溶液中的离子反应与平衡章末整合提升新人教版选择性必修1 试卷 试卷 0 次下载
高中化学人教版 (2019)选择性必修1第四节 化学反应的调控课堂检测
展开第四节 化学反应的调控
【基础巩固】
1.在合成氨工业中,为了提高NH3的日产量,实施下列措施的变化过程中与平衡移动无关的是 ( )
A.不断将氨分离出来
B.使用催化剂
C.采用700 K左右的高温而不是900 K的高温
D.采用10 MPa~30 MPa的压强
解析:把氨分离出来可以减小生成物浓度,有利于平衡右移;合成氨反应是放热反应,相对较低温度(700 K)利于反应向右进行,同时该反应是气体物质的量减小的反应,尽可能采取高压利于正反应的进行,A、C、D三项都符合平衡移动原理;使用催化剂仅能改变反应速率,与平衡移动无关。
答案:B
2.(2022·广东梅州高二期末)化学反应的调控对于工业生产具有积极意义,下列关于调控措施的说法错误的是 ( )
A.硫酸工业中,为提高SO2的转化率,通入的空气越多越好
B.工业合成氨,从生产实际条件考虑,不盲目增大反应压强
C.工业合成氨,考虑催化剂的活性选择400~500 ℃的反应温度
D.炼铁高炉的进风口设置在下端有利于燃料充分利用
解析:在实际生产中为了增大SO2的转化率通入稍过量的空气,若空气通入量过多,不仅会增大能源消耗,还会增大动力消耗,对设备的要求也高,A项错误;工业合成氨,从生产实际条件考虑,不盲目增大反应压强,若压强过大,不仅会增大能源消耗,还会增大动力消耗,对设备的要求也高,B项正确;工业合成氨,400~500 ℃时催化剂的活性最大,有利于提高反应速率,提高氨的产量,故选择400~500 ℃的反应温度,C项正确;炼铁高炉的进风口设置在下端,固体从设备顶部加入,有助于固体和气体充分接触,有利于燃料充分利用,D项正确。
答案:A
3.在N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法中正确的是 ( )
2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法中正确的是 ( )
A.改变条件后速率—时间图像如图:
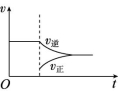
B.此过程中Q>K
C.平衡体系中NH3的含量增大
D.N2的转化率增大
解析:分离出NH3,导致Q<K,v正>v逆,使平衡向正反应方向移动,N2的转化率增大,由于分离出NH3,使体系中NH3的含量减小。
答案:D
4.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,673 K、30 MPa下,n(NH3)和n(H2)随时间的变化关系如图所示。下列说法中正确的是 ( )
2NH3(g) ΔH<0,673 K、30 MPa下,n(NH3)和n(H2)随时间的变化关系如图所示。下列说法中正确的是 ( )
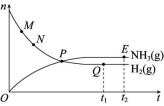
A.P点处反应达到平衡
B.Q点(t1时刻)和E点(t2时刻)处n(N2)不同
C.其他条件不变,773 K下反应至t1时刻,n(H2)比图中的Q点的值要大
D.M点的正反应速率比 N点的正反应速率小
解析:P点是氢气和氨的物质的量相等的点,该点以后,氢气的量还在减少,氨的量还在增加,故P点没有达到平衡,A项错误;t1和t2两个时刻反应均处于平衡状态,体系中各物质的物质的量不再变化,故Q、E两点氮气的物质的量相等,B项错误; 773 K>673 K,工业合成氨为放热反应,升高温度,平衡逆向移动,氢气的物质的量增大,C项正确;反应达到平衡前,M点反应物浓度大于N点反应物浓度,因此M点的正反应速率比N点的正反应速率大,D项错误。
答案:C
5.德国化学家哈伯发明了以低成本制造大量氨的方法。如图所示是哈伯法的流程图,其中为提高原料转化率而采取的措施是 ( )
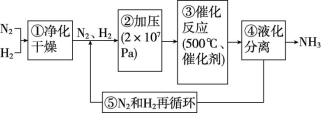
A.①②③ B.②④⑤
C.①③⑤ D.②③④
解析:②④⑤操作均有利于提高原料转化率。
答案:B
6.合成氨工业的原料气中含有少量CO,CO会使催化剂失去催化能力(催化剂中毒),因此,在进入合成塔前必须将其除去。一般用醋酸二氨合铜溶液来吸收原料气中的CO,反应如下:
Cu(NH3)2Ac(aq)+CO(g)+NH3(g)![]() [Cu(NH3)3CO]Ac(aq) ΔH<0
[Cu(NH3)3CO]Ac(aq) ΔH<0
(1)醋酸二氨合铜吸收CO的适宜生产条件是 。
(2)吸收CO后的醋酸铜氨溶液经过处理后可再生,恢复其吸收CO的能力以供循环使用,醋酸铜氨溶液再生的适宜生产条件是 。
解析:(1)醋酸二氨合铜吸收CO的反应为气体体积减小的放热反应,降低温度或增大压强,平衡向吸收CO的方向移动,故应采用低温、高压作为生产条件。(2)放出CO的反应正好和吸收CO的反应相反,应采用高温、低压作为生产条件。
答案:(1)低温、高压 (2)高温、低压
【拓展提高】
7.下列有关合成氨工业的说法中,正确的是 ( )
A.从合成塔出来的混合气体中,其中NH3只占15%,所以合成氨厂的产率都很低
B.由于氨易液化,N2、H2在实际生产中可循环使用,所以总体来说合成氨的产率很高
C.合成氨工业的反应温度控制在700 K左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强越大,产率越高,无须考虑设备、条件
解析:合成氨的反应在适宜的生产条件下达到平衡时,原料的转化率并不高,但生成的NH3分离出后,再将未反应的N2、H2循环利用,这样处理后,可使氨的产率较高,A项错误,B项正确;合成氨工业选择700 K左右的温度,主要从反应速率和催化剂活性两方面考虑,合成氨的反应是放热反应,低温才有利于平衡向正反应方向移动,C项错误;不论从反应速率还是化学平衡考虑,高压更有利于合成氨,但压强太大,对设备、动力的要求更高,因此选择10 MPa~30 MPa,D项错误。
答案:B
8.(2022·江苏泰州高二期末)用ZSM-5分子筛催化1-丁烯裂解制丙烯的反应体系中,主要发生的反应如下。
反应Ⅰ:3C4H8(g)![]() 4C3H6(g) ΔH=+579 kJ/mol
4C3H6(g) ΔH=+579 kJ/mol
反应Ⅱ:C4H8(g)![]() 2C2H4(g) ΔH=+283 kJ/mol
2C2H4(g) ΔH=+283 kJ/mol
已知催化剂ZSM-5分子筛的筛孔径越小,越有利于生成碳原子数少的产物。在0.5 MPa下,上述体系平衡时丁烯、丙烯、乙烯的质量分数与温度的关系如图所示。下列说法正确的是 ( )
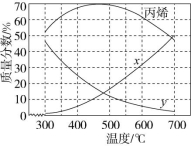
A.图中曲线x表示丁烯的质量分数随温度的变化
B.在0.5 MPa下,该工艺选择的适宜温度为300 ℃
C.C4H8(g)+C2H4(g)![]() 2C3H6(g)的ΔH=+296 kJ/mol
2C3H6(g)的ΔH=+296 kJ/mol
D.高于500 ℃,丙烯质量分数降低可能是因为裂解产生的碳颗粒附着在ZSM-5分子筛的筛孔上所致
解析:由图可知,曲线x表示生成物乙烯的质量分数与温度的关系,曲线y为丁烯的质量分数与温度的关系,300 ℃时,乙烯的质量分数最小,丙烯的质量分数最大,当温度高于500 ℃时,催化剂的活性降低导致丙烯质量分数降低。由分析可知,曲线x表示生成物乙烯的质量分数与温度的关系,故A项错误;由分析可知,在0.5 MPa下,500 ℃时,丙烯的质量分数最大,则生成丙烯的适宜温度为500 ℃,故B项错误;由盖斯定律可知,![]() 得反应C4H8(g)+C2H4(g)
得反应C4H8(g)+C2H4(g)![]() 2C3H6(g),则ΔH=
2C3H6(g),则ΔH=
![]() =+148 kJ/mol,故C项错误;因为催化剂 ZSM-5 分子筛的筛孔径越小,越有利于生成碳原子数少的产物。当温度高于500 ℃时,丙烯质量分数降低可能是因为裂解产生的碳颗粒附着在 ZSM-5 分子筛的筛孔上所致,故D项正确。
=+148 kJ/mol,故C项错误;因为催化剂 ZSM-5 分子筛的筛孔径越小,越有利于生成碳原子数少的产物。当温度高于500 ℃时,丙烯质量分数降低可能是因为裂解产生的碳颗粒附着在 ZSM-5 分子筛的筛孔上所致,故D项正确。
答案:D
9.下图表示298.15 K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答下列问题。
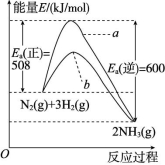
(1)若反应中生成2 mol氨,则反应 (填“吸热”或“放热”) kJ。
(2)图中曲线 (填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能增大反应速率的原理是 。
(3)合成氨反应中平衡混合物中氨的体积分数与压强、温度的关系如图所示。若曲线c对应的温度为500 ℃,则曲线d对应的温度可能是 (填字母)。
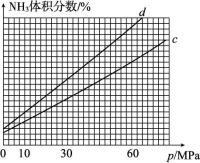
A.600 ℃ B.550 ℃
C.500 ℃ D.450 ℃
(4)合成氨所需的氢气可由甲烷与水反应制备。发生的反应为CH4(g)+H2O (g) ![]() CO(g)+3H2(g) ΔH>0。一定温度下,在1 L 密闭容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO(g)+3H2(g) ΔH>0。一定温度下,在1 L 密闭容器中发生上述反应,各物质的物质的量浓度变化如下表:
|
|
|
|
|
0 | 0.2 | 0.3 | 0 | 0 |
2 | n1 | n2 | n3 | 0.3 |
3 | n1 | n2 | n3 | 0.3 |
4 | 0.09 | 0.19 | x | 0.33 |
①表中x= ;前2 min内CH4的反应速率为 。
②反应在3~4 min时,氢气的物质的量增多的原因可能是 (填字母)。
A.充入水蒸气 B.升高温度 C.使用催化剂 D.充入氢气
解析:(1)由图中能量状态可知,N2与3H2具有的总能量高于2NH3所具有的能量,故该反应为放热反应,并且反应N2(g)+3H2(g) ![]() 2NH3(g),每生成2 mol NH3放出(600-508) kJ=92 kJ热量。(2)合成氨反应中,加入铁触媒后,由于改变了反应历程,使反应的活化能降低,从而增大了反应速率,故曲线b代表加催化剂后的能量变化曲线。(3)对于合成氨反应,当其他条件不变时,升高温度,平衡向逆反应方向移动,平衡混合物中NH3的体积分数降低。图像中,当压强不变时,曲线d对应的温度下平衡混合物中NH3的体积分数大于曲线c对应的NH3的体积分数,所以曲线d对应的温度低于曲线c对应的温度。(4)①前2 min内CH4的反应速率为v(CH4)=
2NH3(g),每生成2 mol NH3放出(600-508) kJ=92 kJ热量。(2)合成氨反应中,加入铁触媒后,由于改变了反应历程,使反应的活化能降低,从而增大了反应速率,故曲线b代表加催化剂后的能量变化曲线。(3)对于合成氨反应,当其他条件不变时,升高温度,平衡向逆反应方向移动,平衡混合物中NH3的体积分数降低。图像中,当压强不变时,曲线d对应的温度下平衡混合物中NH3的体积分数大于曲线c对应的NH3的体积分数,所以曲线d对应的温度低于曲线c对应的温度。(4)①前2 min内CH4的反应速率为v(CH4)=![]() v(H2)=
v(H2)=![]() ×
×![]() =0.05 mol/(L·min)。由表分析2~3 min时,反应达到平衡状态,此时生成H2的浓度为0.3 mol/L。
=0.05 mol/(L·min)。由表分析2~3 min时,反应达到平衡状态,此时生成H2的浓度为0.3 mol/L。
CH4(g)+H2O (g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
![]() 0.2 0.3 0 0
0.2 0.3 0 0
![]() 0.1 0.2 0.1 0.3
0.1 0.2 0.1 0.3
![]() 0.1 0.2 0.1 0.3
0.1 0.2 0.1 0.3
![]() 0.09 0.19 0.11 0.33
0.09 0.19 0.11 0.33
所以x=0.11。
②3 min时,若充入水蒸气,平衡向右移动,4 min时,水蒸气浓度应大于0.2 mol/L;若升高温度,平衡向右移动,反应物浓度均减小,生成物浓度均增加,而且变化量正好等于化学计量数之比,该条件符合要求;使用催化剂,平衡不移动;充入H2,平衡向左移动,CH4、H2O的浓度均大于
3 min 时的浓度。
答案:(1)放热 92 (2)b 催化剂改变了反应的历程,降低了合成氨反应的活化能 (3)D (4)①0.11 0.05 mol/(L· min) ②B
【挑战创新】
10.科学家一直致力于研究常温、常压下“人工固氮”的新方法。在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
T/K | 303 | 313 | 323 | 353 |
NH3生成量/×10-6mol | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式为N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) ΔH=+765.2 kJ/mol
O2(g) ΔH=+765.2 kJ/mol
回答下列问题。
(1)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率较小。请提出可增大其反应速率且增大NH3生成量的建议: 。
(2)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为
2NH3(g)。设在容积为
2.0 L的密闭容器中充入0.60 mol N2(g)与1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为![]() 。则:
。则:
①该条件下N2的平衡转化率为 。
②该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数为 。
N2(g)+3H2(g)的平衡常数为 。
③根据合成氨反应的特点分析,当前比较有前途的研究发展方向是
(填字母)。
A.研制耐高压的合成塔
B.采用超大规模的工业生产
C.研制耐低温复合催化剂
D.探索不用H2与N2合成氨的新途径
解析:(2)①设反应过程中消耗x mol N2(g)。
N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g)
起始量/mol 0.60 1.60 0
变化量/mol x 3x 2x
平衡量/mol 0.60-x 1.60-3x 2x
平衡时反应体系总物质的量=[(0.60-x)+(1.60-3x)+2x] mol=(2.20-
2x) mol,NH3(g)的物质的量分数为![]() =
=![]() ,解得x=0.40,N2的平衡转化率为
,解得x=0.40,N2的平衡转化率为![]() ×100%≈66.7%。②设此时反应2NH3(g)
×100%≈66.7%。②设此时反应2NH3(g)![]() N2(g)+
N2(g)+
3H2(g)的平衡常数为K。平衡时,c(NH3)=![]() mol/L=0.40 mol/L,
mol/L=0.40 mol/L,
c(N2)=![]() mol/L=0.10 mol/L,c(H2)=
mol/L=0.10 mol/L,c(H2)=![]() mol/L=0.20 mol/L,因此,K=
mol/L=0.20 mol/L,因此,K=![]() =5.0×10-3。
=5.0×10-3。
答案:(1)升温、增大N2浓度 (2)①66.7% ②5.0×10-3 ③C
高中化学人教版 (2019)选择性必修1第四节 化学反应的调控精练: 这是一份高中化学人教版 (2019)选择性必修1第四节 化学反应的调控精练,共9页。试卷主要包含了4化学反应的调控同步练习题,9ml·L-1B.α=60%,3%,0kJ·ml-1等内容,欢迎下载使用。
化学第四节 化学反应的调控课时训练: 这是一份化学第四节 化学反应的调控课时训练,共9页。试卷主要包含了 由丙烯合成正丁醛的反应等内容,欢迎下载使用。
高中化学第二章 化学反应速率与化学平衡第四节 化学反应的调控练习: 这是一份高中化学第二章 化学反应速率与化学平衡第四节 化学反应的调控练习,共9页。试卷主要包含了下面是合成氨的简易流程示意图等内容,欢迎下载使用。













