

还剩3页未读,
继续阅读
所属成套资源:人教版化学初三上学期教案全套
成套系列资料,整套一键下载
人教版九年级化学上册 课题1 金刚石、石墨和C60 第2课时 教案
展开
这是一份人教版九年级化学上册 课题1 金刚石、石墨和C60 第2课时 教案,共6页。
课题1 金刚石、石墨和C60
第2课时
一、教学目标
1.通过对生活中一些常见碳单质的使用情况,了解碳单质在常温下的稳定性和可燃性。
2.掌握碳的化学性质,重点掌握碳还原氧化铜实验的装置、现象和结论。
3.根据碳的化学性质,了解碳的用途。
二、教学重难点
重点:单质碳的化学性质。
难点:木炭与氧化铜的反应。
三、教学准备
教学PPT及相关视频、烘干的木炭粉、氧化铁粉末、大试管、铁丝网罩、酒精灯、升降台、铁架台、单孔塞、导管、澄清石灰水、小试管等。
四、教学过程
教学环节
教师活动
学生活动
设计意图
环节一
创设情境
引入新课
【讲述】说一说金刚石、石墨和C60的物理性质及用途,以及三者物理性质差异很大的原因。
【讨论与交流】我们知道碳单质的种类是非常多的,其物理性质差异很大的主要原因是碳原子的排列方式多种多样。那它们的化学性质会怎样呢?也会差异很大吗?
倾听
思考
回顾已学知识,形成对比,导入新课。
环节二
新课讲解
【总结与交流】这些单质都由有碳元素组成的,元素的化学性质与原子结构的最外层电子数的关系最密切,因此这些物质的化学性质在很大程度上是相似的。
【提问】下面的事例说明了碳单质的什么性质?
①“钻石恒久远,一颗永相传”;
②古代书画家用墨绘画、字迹历经千年而不褪色。
【总结】碳单质在常温下化学性质稳定,这与碳原子的核外电子排布有关。碳原子的最外层有4个电子,在常温下,既不易失去也不易得到电子,所以化学性质比较稳定。
【提问】如果提升温度,碳的化学性质又如何呢?同学们回想一下:在学习氧气的化学性质的时候,我们做过“木炭在氧气中燃烧的实验”,你还能说出该实验的实验现象吗?
【现象】木炭剧烈燃烧,发出白光,放出大量的热。
【结论】碳具有可燃性,即C+O2CO2(氧气充足,碳充分燃烧)
【交流讨论】冬天,北方农村地区常在房间里燃煤、烧炭取暖,常发生中毒现象,你知道是什么原因吗?
【总结】碳与氧气不充分燃烧:2C+O2 2CO。
由此可见:化学反应的条件不同,会决定反应的进行程度或产物的不同。
【总结与交流】
氧气充足,燃烧充分时,碳燃烧生成二氧化碳,即C+O2CO2 。
氧气不充足,燃烧不充分时,碳燃烧生成一氧化碳,即2C+O22CO
【注意】描述物质的化学性质时,要注意条件哦。如碳在常温下化学性质稳定;碳充分燃烧生成二氧化碳;不充分燃烧时则生成一氧化碳等。
【过渡】碳不仅能和单质的氧发生化学反应,在高温的条件下还能和某些化合物中的氧发生反应。
【讲述】木炭与氧化铜的反应
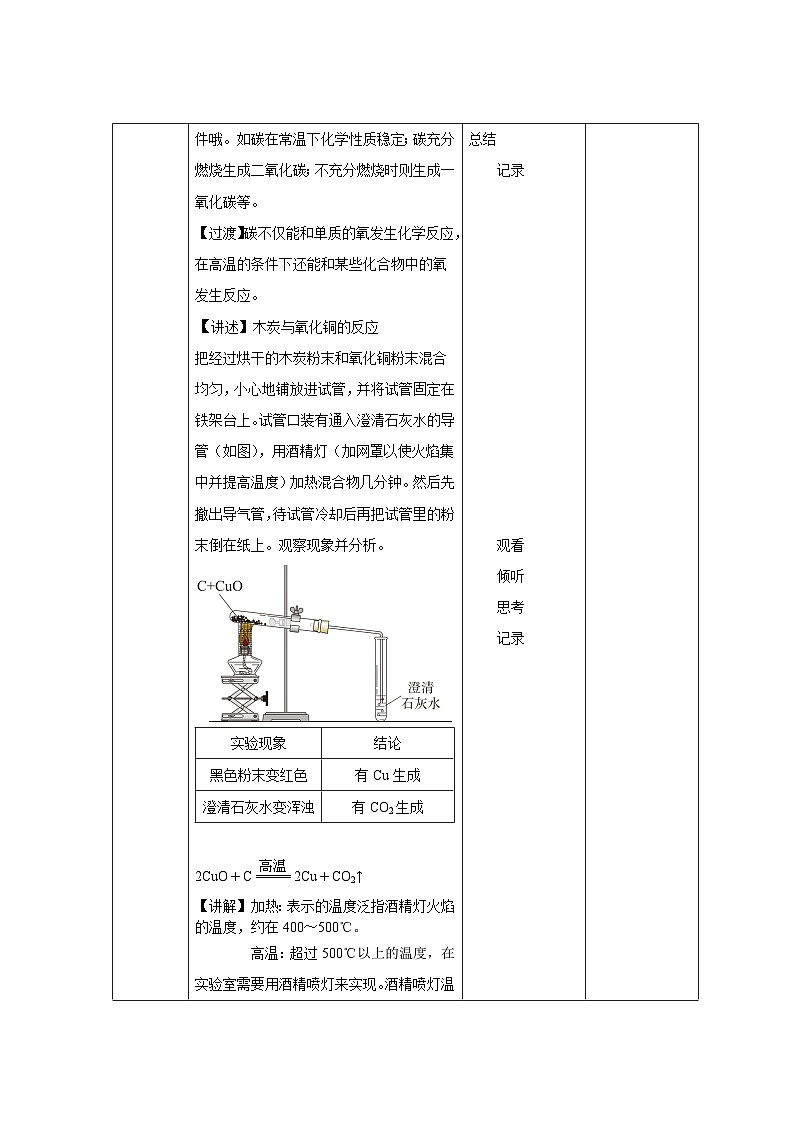
把经过烘干的木炭粉末和氧化铜粉末混合均匀,小心地铺放进试管,并将试管固定在铁架台上。试管口装有通入澄清石灰水的导管(如图),用酒精灯(加网罩以使火焰集中并提高温度)加热混合物几分钟。然后先撤出导气管,待试管冷却后再把试管里的粉末倒在纸上。观察现象并分析。
实验现象
结论
黑色粉末变红色
有Cu生成
澄清石灰水变浑浊
有CO2生成
2CuO+C2Cu+CO2↑
【讲解】加热:表示的温度泛指酒精灯火焰的温度,约在400~500℃。
高温:超过500℃以上的温度,在实验室需要用酒精喷灯来实现。酒精喷灯温度可达700-1000℃。
【注意问题】该实验中有几个地方需引起大家的注意:
①酒精灯加网罩可使火焰集中并提高温度;
②试管口要略向下倾斜;
③装置的气密性要好;
④实验结束时,先撤出导气管,然后再熄灭酒精灯(防止澄清石灰水倒流入热的试管致使试管破裂)。
⑤待试管冷却后再把试管内的粉末倒在纸上(防止生成的铜再被氧化成氧化铜)。
【讲述】在该实验中,氧化铜失去氧而变成了单质铜。
这种含氧化合物里的氧被夺去的反应,就叫做还原反应。
在该反应中,木炭是使氧化铜还原为铜的物质,因此说碳具有还原性。
【讲解】碳的还原性还表现在其他反应中。
1.冶金工业:焦炭在工业上可用来炼铁:2Fe2O3+3C4Fe+3CO2↑
2.在高温条件下,碳还能使二氧化碳转变成一氧化碳。
C+CO22CO(吸收热量)
【讲解】物质的组成、结构决定性质,性质决定用途。因此碳可以作燃料、冶炼金属等。
倾听
思考
讨论
回答
倾听
思考
交流
总结
记录
互相讨论、交流,归纳总 结出分子的性质并举例说明
阅读
交流
总结
记录
观看
倾听
思考
记录
观看
倾听
思考
记录
通过举例说明,让学生进一步理解碳单质的化学性质。
用木炭还原氧化铜的实验加深学生对碳单质还原性的认识。
环节三拓展延伸
【观看视频】生成炭黑的实验
阅读 思考
通过观看视频,使学生加深对碳单质化学性质的认识。
随堂作业
PPT展示
做题
通过习题巩固本课时所学知识
环节四
课堂小结
通过本节课的学习,我们知道了碳的化学性质:
1.常温下,碳的化学性质不活泼(古代墨字墨画)
2.可燃性
C+O2CO2(充分燃烧)
2C+O22CO(不充分燃烧)
3.还原性
2CuO+C2Cu+CO2↑
2Fe2O3+3C4Fe+3CO2↑
C+CO22CO
倾听并理解。
帮助学生梳理本节知识,便于学生记忆。
五、板书设计
课题1金刚石、石墨和C60
第2课时
一、单质碳的化学性质
1.常温下,碳的化学性质不活泼。
2.高温下,碳能跟多种物质反应。
(1)碳与氧气的反应:
C+O2CO2(充分燃烧)
2C+O22CO(不充分燃烧)
(2)碳与某些氧化物的反应
2CuO+C2Cu+CO2↑
2Fe2O3+3C4Fe+3CO2↑
C+CO22CO
课题1 金刚石、石墨和C60
第2课时
一、教学目标
1.通过对生活中一些常见碳单质的使用情况,了解碳单质在常温下的稳定性和可燃性。
2.掌握碳的化学性质,重点掌握碳还原氧化铜实验的装置、现象和结论。
3.根据碳的化学性质,了解碳的用途。
二、教学重难点
重点:单质碳的化学性质。
难点:木炭与氧化铜的反应。
三、教学准备
教学PPT及相关视频、烘干的木炭粉、氧化铁粉末、大试管、铁丝网罩、酒精灯、升降台、铁架台、单孔塞、导管、澄清石灰水、小试管等。
四、教学过程
教学环节
教师活动
学生活动
设计意图
环节一
创设情境
引入新课
【讲述】说一说金刚石、石墨和C60的物理性质及用途,以及三者物理性质差异很大的原因。
【讨论与交流】我们知道碳单质的种类是非常多的,其物理性质差异很大的主要原因是碳原子的排列方式多种多样。那它们的化学性质会怎样呢?也会差异很大吗?
倾听
思考
回顾已学知识,形成对比,导入新课。
环节二
新课讲解
【总结与交流】这些单质都由有碳元素组成的,元素的化学性质与原子结构的最外层电子数的关系最密切,因此这些物质的化学性质在很大程度上是相似的。
【提问】下面的事例说明了碳单质的什么性质?
①“钻石恒久远,一颗永相传”;
②古代书画家用墨绘画、字迹历经千年而不褪色。
【总结】碳单质在常温下化学性质稳定,这与碳原子的核外电子排布有关。碳原子的最外层有4个电子,在常温下,既不易失去也不易得到电子,所以化学性质比较稳定。
【提问】如果提升温度,碳的化学性质又如何呢?同学们回想一下:在学习氧气的化学性质的时候,我们做过“木炭在氧气中燃烧的实验”,你还能说出该实验的实验现象吗?
【现象】木炭剧烈燃烧,发出白光,放出大量的热。
【结论】碳具有可燃性,即C+O2CO2(氧气充足,碳充分燃烧)
【交流讨论】冬天,北方农村地区常在房间里燃煤、烧炭取暖,常发生中毒现象,你知道是什么原因吗?
【总结】碳与氧气不充分燃烧:2C+O2 2CO。
由此可见:化学反应的条件不同,会决定反应的进行程度或产物的不同。
【总结与交流】
氧气充足,燃烧充分时,碳燃烧生成二氧化碳,即C+O2CO2 。
氧气不充足,燃烧不充分时,碳燃烧生成一氧化碳,即2C+O22CO
【注意】描述物质的化学性质时,要注意条件哦。如碳在常温下化学性质稳定;碳充分燃烧生成二氧化碳;不充分燃烧时则生成一氧化碳等。
【过渡】碳不仅能和单质的氧发生化学反应,在高温的条件下还能和某些化合物中的氧发生反应。
【讲述】木炭与氧化铜的反应
把经过烘干的木炭粉末和氧化铜粉末混合均匀,小心地铺放进试管,并将试管固定在铁架台上。试管口装有通入澄清石灰水的导管(如图),用酒精灯(加网罩以使火焰集中并提高温度)加热混合物几分钟。然后先撤出导气管,待试管冷却后再把试管里的粉末倒在纸上。观察现象并分析。
实验现象
结论
黑色粉末变红色
有Cu生成
澄清石灰水变浑浊
有CO2生成
2CuO+C2Cu+CO2↑
【讲解】加热:表示的温度泛指酒精灯火焰的温度,约在400~500℃。
高温:超过500℃以上的温度,在实验室需要用酒精喷灯来实现。酒精喷灯温度可达700-1000℃。
【注意问题】该实验中有几个地方需引起大家的注意:
①酒精灯加网罩可使火焰集中并提高温度;
②试管口要略向下倾斜;
③装置的气密性要好;
④实验结束时,先撤出导气管,然后再熄灭酒精灯(防止澄清石灰水倒流入热的试管致使试管破裂)。
⑤待试管冷却后再把试管内的粉末倒在纸上(防止生成的铜再被氧化成氧化铜)。
【讲述】在该实验中,氧化铜失去氧而变成了单质铜。
这种含氧化合物里的氧被夺去的反应,就叫做还原反应。
在该反应中,木炭是使氧化铜还原为铜的物质,因此说碳具有还原性。
【讲解】碳的还原性还表现在其他反应中。
1.冶金工业:焦炭在工业上可用来炼铁:2Fe2O3+3C4Fe+3CO2↑
2.在高温条件下,碳还能使二氧化碳转变成一氧化碳。
C+CO22CO(吸收热量)
【讲解】物质的组成、结构决定性质,性质决定用途。因此碳可以作燃料、冶炼金属等。
倾听
思考
讨论
回答
倾听
思考
交流
总结
记录
互相讨论、交流,归纳总 结出分子的性质并举例说明
阅读
交流
总结
记录
观看
倾听
思考
记录
观看
倾听
思考
记录
通过举例说明,让学生进一步理解碳单质的化学性质。
用木炭还原氧化铜的实验加深学生对碳单质还原性的认识。
环节三拓展延伸
【观看视频】生成炭黑的实验
阅读 思考
通过观看视频,使学生加深对碳单质化学性质的认识。
随堂作业
PPT展示
做题
通过习题巩固本课时所学知识
环节四
课堂小结
通过本节课的学习,我们知道了碳的化学性质:
1.常温下,碳的化学性质不活泼(古代墨字墨画)
2.可燃性
C+O2CO2(充分燃烧)
2C+O22CO(不充分燃烧)
3.还原性
2CuO+C2Cu+CO2↑
2Fe2O3+3C4Fe+3CO2↑
C+CO22CO
倾听并理解。
帮助学生梳理本节知识,便于学生记忆。
五、板书设计
课题1金刚石、石墨和C60
第2课时
一、单质碳的化学性质
1.常温下,碳的化学性质不活泼。
2.高温下,碳能跟多种物质反应。
(1)碳与氧气的反应:
C+O2CO2(充分燃烧)
2C+O22CO(不充分燃烧)
(2)碳与某些氧化物的反应
2CuO+C2Cu+CO2↑
2Fe2O3+3C4Fe+3CO2↑
C+CO22CO
相关资料
更多









