人教版 (2019)必修 第一册第二节 金属材料导学案
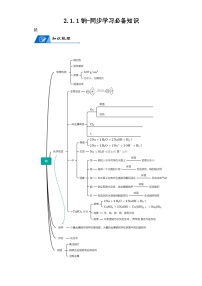
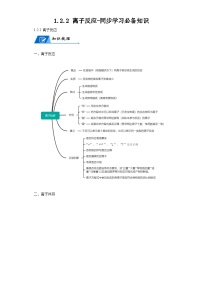
展开3.2.1金属材料-同步学习必备知识
金属材料
例题1
1.纯铁的熔点为1535℃,而高炉中炼铁时,生铁(含碳量较高的铁合金)在1200℃左右就熔化了,这是因为
A.铁的纯度越高,熔点越低
B.合金的熔点比各成分金属的熔点高
C.形成了铁碳合金,所以熔点降低
D.在高炉中熔化的过程发生了化学反应
例题2
2.下列说法不正确的是
①钠着火用干沙土扑灭②明矾可用于水的净化和消毒
③打磨过的铝片加热熔化时会滴落,未打磨的铝片则不会滴落
④可用铁制容器盛放和运输浓硫酸⑤青铜、不锈钢、硬铝都是合金
⑥铝制器皿不宜盛放酸性或碱性食物
⑦钠、镁、铝在空气中都易被氧化,所以需要密封保存
⑧氧化铝常用来制造耐火材料⑨Na2O2用作呼吸面具的供氧剂
⑩灼烧某待测液,焰色反应为黄色,则待测液中一定不含钾离子
A.②③⑦⑩ B.①④⑤⑨ C.⑤⑥⑦⑧ D.③④⑥⑧
随练1
3.合金是一类用途广泛的金属材料。下列物质属于合金的是( )。
A.铜 B.钢 C.金刚石 D.四氧化三铁
随练2
4.化学知识在生产和生活中有着重要的应用。下列说法中正确的是
①钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
②K、Na合金可作原子反应堆的导热剂
③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦秆、羽毛等
⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂
⑥明矾常作为消毒剂
A.①②③④ B.①②③④⑤ C.①②③④⑥ D.①②③④⑤⑥
例题1
5.在调节好平衡的托盘天平的两个托盘上,各放一个等质量的烧杯,再加入等质量、等质量分数的盐酸,然后二边各放a克锌和铝,反应结束后,烧杯中剩余的铝比剩余的锌多,则此时天平
A.仍平衡 B.放锌的一边重 C.放铝的一边重 D.无法判断
例题2
6.常温下,下列物质既能与NaOH溶液又能与稀硫酸反应,并有气体放出的是
A.镁 B.铝 C.铁 D.铅
例题3
7.如图所示的实验中,投入铝片后
A.①中产生气泡,②中不产生气泡
B.①和②中都不产生气泡
C.①和②中都产生气泡,①中是H2,②中是O2
D.①和②中都产生气泡,且都是H2
随练1
8.将一小段铝片放入盛有 2 mol/L的NaOH溶液中。ⅰ.开始时,没有明显现象;ⅱ.过一会儿,有大量气泡产生;ⅲ.把点燃的木条放在试管口,有爆鸣声。下列说法不正确的是
A.现象ⅰ、ⅱ说明NaOH溶液能溶解Al2O3
B.现象ⅱ、ⅲ是因为发生了反应:2Al + 2OH- + 2H2O=2AlO+ 3H2↑
C.现象ⅰ、ⅱ,可推测家用铝制餐具不宜长时间盛放碱性食物
D.上述实验说明活泼金属都具有类似的性质
随练2
9.某无色溶液放入铝片后有氢气产生,则在该溶液中下列离子一定可以大量存在的是( )
A.Na+ B.Mg2+
C.H+ D.CO
随练3
10.铝具有较强的抗腐蚀能力,主要原因是
A.铝的化学性质稳定
B.铝与氧气在常温下不反应
C.铝在任何条件下均不与氧气反应
D.铝与氧气化合形成一层致密的氧化膜
例题1
11.把5.1g镁铝合金的粉末放入过量的300mL2mol/L盐酸中,得到5.6LH2(标准状况下)。试计算:该合金中铝和镁的物质的量之比___________。
例题2
12.为测定某镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入l00mL 0.3mol·L-1稀硫酸,合金完全溶解,产生的气体在标况下为560mL;再加入0.2mol·L-1NaOH溶液至沉淀质量不再变化,用去350mLNaOH溶液。则所取样品中铝的物质的量为
A.0.005mol B.0.01mol C.0.025mol D.0.03mol
例题3
13.易拉罐的主要成分为铝合金,其中以铝铁合金和铝镁合金最为常见。为确定铝合金中金属的成分,现取几小块易拉罐碎片进行下列实验,其中实验方案、现象与结论均正确的是
选项
实验方案
现象与结论
A
加入盐酸
产生无色气体,含铝、铁、镁三种金属
B
加入NaOH溶液
有无色气体产生,含有镁、铝两种金属
C
加入盐酸后,向所得溶液中再加入少量NaOH溶液
产生白色沉淀,一定只含有镁
D
用盐酸溶解并放置一会儿后,加入KSCN溶液
溶液呈血红色,含有铁
A.A B.B C.C D.D
随练1
14.将一块镁铝合金完全溶于盐酸后,再加入过量NaOH溶液,所得的溶液中主要存在的离子有
A.AlO、OH-、Na+、Cl- B.Na+、OH-、Al3+、Cl-
C.AlO、OH-、Mg2+、Cl- D.Na+、Mg2+、Al3+、Cl-
随练2
15.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表所示:
物质
Al
Al2O3
Fe
Fe2O3
熔点/℃
660
2054
1535
1462
沸点/℃
2467
2980
2750
——
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:___________(填“合理”或“不合理”)。
(2)将铝与Fe2O3混合后放入漏斗中,然后引发铝热反应的实验操作是___________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________,反应的离子方程式为___________。
(4)实验室溶解该熔融物,下列试剂中最好的是___________(填序号)。
A.浓硫酸
B.稀硫酸
C.稀硝酸
D.氢氧化钠溶液
例题1
16.新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气.下列说法正确的是
A.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B.合金在吸氢过程中被H2还原
C.一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D.等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)顺序为:V(铝)> V(合金)>V(镁)
例题2
17.氢能是最理想的能源,科学家们研制出一种能方便地储存、释放氢气的储氢材料,这种储氢材料是
A.合金 B.无机非金属 C.合成材料 D.复合材料
随练1
18.新型镁铝合金(Mg17Al12)(合金中金属化合价均为0)有储氢性能,下列说法正确的是( )
A.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B.1mol Mg17Al12与盐酸完全反应放出H2为35mol
C.一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D.等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)>V(合金)>V(Al)
随练2
19.I.氢化钠(NaH) 是一种离子化合物,遇水后放出氢气并生成一种碱,主要应用在有机合成和储氢材料方面。根据信息完成下列各空:
(1)氢化钠的电子式为_____________________________。
(2)氢化钠与水反应的化学方程式为_____________________,反应的氧化剂为___________。该反应过程中,被破坏的化学键有_____________(填序号,下同),形成的化学键有______________。
①离子键 ②极性共价键 ③非极性共价键
II.现有短周期元素X 形成的单质A与NaOH溶液反应,有如下转化关系:, (若产物中有水生成则省略未表示出来)。
(1)常温常压下,若A 为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为________________________________________________;
(2)若A 为金属单质,C 为气体,则A 与NaOH 溶液反应的离子方程式为_____________________________;A 最高价氧化物的水化物与NaOH 溶液反应的离子方程式为______________________________。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体导学案及答案: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体导学案及答案,文件包含思维导图人教版高中化学选修二《321分子晶体》同步学习思维导图+学练解析版docx、思维导图人教版高中化学选修二《321分子晶体》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。
人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第三节 无机非金属材料导学案: 这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第三节 无机非金属材料导学案,文件包含思维导图人教版高中化学必修二《53无机非金属材料》同步学习思维导图+学练解析版docx、思维导图人教版高中化学必修二《53无机非金属材料》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
化学第三节 化学键导学案: 这是一份化学第三节 化学键导学案,文件包含思维导图人教版高中化学必修一《43化学键》同步学习思维导图+学练解析版docx、思维导图人教版高中化学必修一《43化学键》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共44页, 欢迎下载使用。