

所属成套资源:2024届高三新高考化学大一轮专题练习(40份)
2024届高三新高考化学大一轮专题练习-离子反应
展开
这是一份2024届高三新高考化学大一轮专题练习-离子反应,共18页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习-离子反应
一、单选题
1.(2023春·北京西城·高三北师大实验中学校考期中)下列物质的性质实验对应的反应方程式书写正确的是
A.过量铁粉与稀硝酸反应,产生无色气体:
B.硫酸铝溶液与过量氨水的反应:
C.向酸性溶液中通入:
D.酸化的溶液长时间存放变黄:
2.(2023·全国·高三假期作业)Cl2可用于制备盐酸、漂白粉[有效成分为Ca(ClO)2]和“84”消毒液(有效成分为NaClO)等;“84”消毒液与洁厕剂(含有盐酸)混用会发生反应生成有毒的Cl2。工业上常用电解饱和食盐水的方法制取Cl2、NaOH等。下列化学反应表示正确的是
A.H2与Cl2在点燃条件下化合生成HCl:H2 + Cl2 = 2HCl
B.“84”消毒液与洁厕剂混用:Cl- + ClO-+ H2O = 2OH- + Cl2↑
C.漂白粉溶于水后与CO2反应:CO2 + 2ClO-+ H2O = CO + 2HClO
D.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2OH2↑+Cl2↑+2OH-
3.(2023春·江西抚州·高三校联考期中)下列离子方程式书写正确的是
A.足量通入少量石灰水中:
B.溶液与溶液共热:
C.与稀硝酸反应:
D.硫酸氢钠溶液与少量反应:
4.(2023春·四川成都·高三成都外国语学校校考期中)下列离子方程式或化学方程式正确的是
A.Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H+++Ba2++2OH-=BaSO4↓+2H2O
B.氯化铵浓溶液跟浓NaOH溶液混合后加热:+OH-NH3·H2O
C.硫酸铝溶液与过量氨水的反应:Al3++4NH3·H2O=AlO+4NH
D.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++=3Fe3++NO↑+2H2O
5.(2023春·湖北·高三校联考期中)下列过程涉及的离子方程式正确的是
A.向溶液中通入气体:
B.磁性氧化铁溶于稀硝酸溶液:
C.向溶液中滴入少量稀溶液:
D.用试剂检验:
6.(2023春·湖北·高三校联考期中)为了除去粗盐中的、、以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂均过量):称取粗盐滤液精盐。下列叙述正确的是
A.③中的试剂可以是溶液也可以是溶液
B.上述操作中①⑤⑥⑦需要用到玻璃棒
C.步骤②和④顺序可以颠倒
D.第④发生的反应只有
7.(2023春·四川绵阳·高三四川省绵阳南山中学校考期中)下列离子方程式书写错误的是
A.用铜作电极电解AgNO3溶液:4Ag++2H2O4Ag+O2↑+4H+
B.小苏打溶液呈碱性:+H2O⇌H2CO3+OH-
C.向AgCl悬浊液中加入Na2S固体:2AgCl(s)+S2-(aq)⇌Ag2S(s)+2Cl-(aq)
D.用K3[Fe(CN)6]检验Fe2+:2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓
8.(2023春·重庆沙坪坝·高三重庆南开中学校考期中)常温下,下列各组微粒能在指定溶液中大量共存的是
A.苯酚溶液中:
B.通至饱和的溶液中:
C.氨水溶液中:
D.水电离的的溶液中:
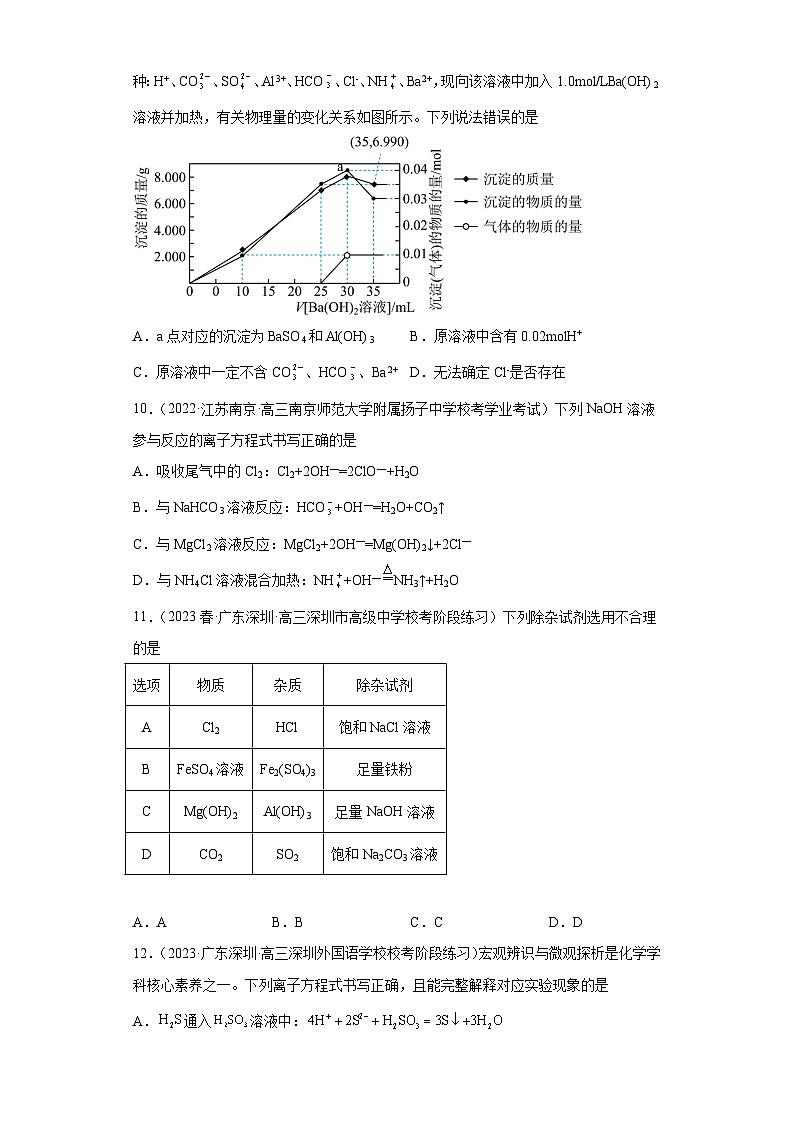
9.(2023春·山西太原·高三山西实验中学校考期中)某溶液中可能存在以下离子中的几种:H+、CO、SO、Al3+、HCO、Cl-、NH、Ba2+,现向该溶液中加入1.0mol/LBa(OH)2溶液并加热,有关物理量的变化关系如图所示。下列说法错误的是
A.a点对应的沉淀为BaSO4和Al(OH)3 B.原溶液中含有0.02molH+
C.原溶液中一定不含CO、HCO、Ba2+ D.无法确定Cl-是否存在
10.(2022·江苏南京·高三南京师范大学附属扬子中学校考学业考试)下列NaOH溶液参与反应的离子方程式书写正确的是
A.吸收尾气中的Cl2:Cl2+2OH—=2ClO—+H2O
B.与NaHCO3溶液反应:HCO+OH—=H2O+CO2↑
C.与MgCl2溶液反应:MgCl2+2OH—=Mg(OH)2↓+2Cl—
D.与NH4Cl溶液混合加热:NH+OH—NH3↑+H2O
11.(2023春·广东深圳·高三深圳市高级中学校考阶段练习)下列除杂试剂选用不合理的是
选项
物质
杂质
除杂试剂
A
Cl2
HCl
饱和NaCl溶液
B
FeSO4溶液
Fe2(SO4)3
足量铁粉
C
Mg(OH)2
Al(OH)3
足量NaOH溶液
D
CO2
SO2
饱和Na2CO3溶液
A.A B.B C.C D.D
12.(2023·广东深圳·高三深圳外国语学校校考阶段练习)宏观辨识与微观探析是化学学科核心素养之一。下列离子方程式书写正确,且能完整解释对应实验现象的是
A.通入溶液中:
B.用铁电极作阳极,电解饱和食盐水:
C.向溶液中滴加稀硫酸,产生淡黄色沉淀和有刺激性气味的气体:
D.铝溶于氢氧化钠溶液,有无色气体产生:
13.(2023春·浙江·高三期中)下列各组离子在指定的溶液中一定能大量共存的是
A.含有大量Ba2+的溶液中:Cl-、K+、SO、CO
B.使石蕊变红的溶液中:Mg2+、Na+、HCO、SO
C.使酚酞变红的溶液中:Na+、Fe2+、NO、SO
D.含有大量Cu2+的溶液中:H+、K+、SO、NO
14.(2023·全国·高三假期作业)某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的下列说法中,不正确的是
A.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
C.BC段溶液的导电能力不断增大,主要是由于过量的H2SO4电离出的离子导电
D.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和
二、非选择题
15.(2023秋·上海浦东新·高三校考期末)导电性实验可以作为研究电解质电离本质及反应机理的有效方法。
(1)在如下图所示的装置里,若灯泡亮,广口瓶内的物质A 可以是_______(填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥ 氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)写出一水合氨的电离方程式_______。
(3)在电解质溶液的导电性装置(如下图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是_______(填字母),并写出发生反应的离子方程式_______。
A.盐酸中逐滴加入食盐溶液 B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸 D.硫酸中逐滴加入氢氧化钡溶液
(4)已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且 Ca(HCO3)2易溶于水。若在(3)题图中,电解质溶液为 Ca(OH)2溶液,向溶液中逐渐通入 CO2。则:下列四个图中,_______(填字母)能比较准确地反映出溶液的导电能力和通入CO2 气体量的关系(x 轴表示 CO2通入的量,y 轴表示导电能力)。
A. B. C. D.
16.(2023秋·江苏南通·高三统考期末)利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择最合适的完成指定转化(试剂可以重复选择)。
试剂:溶液、氨水、溶液、溶液、溶液、稀盐酸、溶液
①溶液溶液的化学方程式:_______。
②的离子方程式:_______。
③碱性条件下,溶液的离子方程式:_______。
(2)生物浸出法可有效回收含硫矿石中的有色金属,酸性条件下,某生物浸出法主要物质转化如图。
①步骤Ⅰ发生反应的离子方程式为_______。
②步骤Ⅱ发生反应的离子方程式为_______。
17.(2023秋·重庆九龙坡·高三重庆市育才中学校考期末)Ⅰ.现有下列6种物质:①Al ② ③HCl ④ ⑤ ⑥NaOH
(1)含有共价键的离子化合物是_______(填序号)
(2)干冰(固态)受热变成气体需克服_______。
A.极性共价键 B.非极性共价键 C.范德华力 D.氢键
(3)检验⑤中阳离子的方法是_______。(答操作和现象)
(4)将少量②通入⑥的溶液中发生反应的离子方程式为_______。
Ⅱ.某溶液仅由、、、、、、中的若干种离子组成,且各离子浓度相等,取适量溶液进行如下实验:
①加过量盐酸无现象,得到无色溶液;
②取操作①后的溶液,加入过量的NaOH溶液,产生白色沉淀1;
③取操作②后的滤液,加入过量的和溶液,产生白色沉淀2;
④取操作③后的滤液进行焰色试验,火焰呈黄色
根据以上实验,回答问题:
(5)根据①的现象判断溶液中无_______。(填离子符号,下同)
(6)根据已知条件判断溶液中一定含有_______。
(7)综合整个实验可以判断溶液中一定不存在的离子还有_______。
18.(2022秋·河北石家庄·高三石家庄精英中学校考阶段练习)结合铝及其化合物的性质完成下列问题:
(1)铝制易拉罐中充满CO2,然后往易拉罐中充入足量的浓NaOH溶液,立即用胶布封严罐口,一会儿听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又恢复原样,请根据现象填空。
①易拉罐变瘪是因为_______;
②易拉罐恢复原样原因是_______(用化学方程式解释);
(2)在NaAlO2溶液中逐滴滴加稀盐酸溶液至过量,现象为_______。向NaAlO2溶液中通入过量CO2可制备Al(OH)3,写出反应的离子方程式:_______。
(3)用AlCl3溶液制备Al(OH)3时使用试剂_______(填“NaOH溶液或氨水”)更好。
(4)相同物质的量的稀盐酸和氢氧化钠溶液分别与足量铝的反应,产生氢气的物质的量之比为_______
(5)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/LNaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示。B点到C点的离子反应方程式_______。合金中镁和铝的物质的量之比为_______。
参考答案:
1.C
【详解】A.过量铁粉与稀硝酸反应,生成亚铁离子,离子方程式为:,A错误;
B.硫酸铝溶液与过量氨水的反应生成氢氧化铝沉淀,氨水为弱碱不能溶解氢氧化铝:,B错误;
C.向酸性溶液中通入:,C正确;
D.二价铁离子具有强的还原性,能够被空气中的氧气氧化,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,所以酸化的硫酸亚铁溶液长时间存放,溶液变黄,D错误;
故选C。
2.D
【详解】A.与在点燃条件下化合生成: ,A错误;
B.“84”消毒液与洁厕剂混用:,B错误;
C.漂白粉溶于水后与反应:,C错误;
D.氯碱工业是电解饱和食盐水获取烧碱和氯气,D正确;
故选D。
3.B
【详解】A.过量与反应生成,A项错误;
B.溶液与溶液共热离子方程式为:,B正确
C.被氧化,不能生成,生成铁离子,C项错误;
D.与反应生成,D项错误;
故选B。
4.D
【详解】A.Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀,则氢离子完全生成水、氢氧根离子过量,反应为:H+++Ba2++OH-=BaSO4↓+H2O,A错误;
B.氯化铵浓溶液跟浓NaOH溶液混合后加热生成氨气和水:+OH-NH3↑+H2O,B错误;
C.硫酸铝溶液与过量氨水的反应生成氢氧化铝沉淀,氨水为弱碱不能溶解氢氧化铝:,C错误;
D.向Fe(NO3)2稀溶液中加入盐酸,酸性条件下硝酸根离子将亚铁离子氧化为铁离子,反应为:3Fe2++4H++=3Fe3++NO↑+2H2O,D正确;
故选D。
5.C
【详解】A.弱酸无法制强酸,氯化钡与二氧化硫两者不反应,A错误;
B.硝酸具有强氧化性,Fe3O4与HNO3反应产物中没有亚铁离子,正确的离子方程式为3Fe3O4++28H+=9Fe3++14H2O+NO↑,B错误;
C.向硫酸铵溶液中滴加少量稀NaOH,离子方程式为,C正确;
D.用KSCN试剂检验Fe3+,离子方程式为,D错误;
故答案选C。
6.B
【分析】粗盐溶解先加入氯化钡溶液,硫酸根离子与钡离子反应生成硫酸钡沉淀,③步骤加入NaOH,除去溶液中的镁离子同时不引入其他杂质离子,再加入Na2CO3除去钙离子和过量的钡离子,过滤后滤液中加入盐酸除去多余的碳酸根离子和氢氧根离子,最后蒸发、结晶、烘干得到精盐。
【详解】A.③若加入KOH虽然除去了镁离子但是引入了杂质离子K+,A错误;
B.①为溶解,⑤为过滤,⑥盐酸和碳酸钠反应需要搅拌,⑦加热蒸发结晶过程中也需要搅拌,故操作①⑤⑥⑦都需要用到玻璃棒,B正确;
C.若步骤②和④颠倒,则最后加入的过量钡离子无法除去,C错误;
D.步骤④中除了氯化钙与碳酸钠反应外,还有氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,D错误;
故答案选B。
7.A
【详解】A.用铜作电极电解AgNO3溶液则阳极上Cu失电子转化为Cu2+,阴极上是Ag+得到电子转化为Ag,故该电解方程式为:Cu+2Ag+2Ag+Cu2+,A错误;
B.小苏打溶液呈碱性由于碳酸氢根离子水解生成碳酸和氢氧根离子即+H2O⇌H2CO3+OH-,B正确;
C.向AgCl悬浊液中加入Na2S固体发生沉淀的转化,该转化方程式为:2AgCl(s)+S2-(aq)⇌Ag2S(s)+2Cl-(aq),C正确;
D.用K3[Fe(CN)6]检验Fe2+产生蓝色沉淀即Fe3[Fe(CN)6]2↓,故该离子方程式为2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓,D正确;
故答案为:A。
8.B
【详解】A.苯酚溶液中,铁离子与苯酚溶液发生显色反应,不能大量共存,故A错误;
B.碳酸的酸性小于盐酸,则三种离子在通二氧化碳至饱和的溶液中不发生任何反应,能大量共存,故B错误;
C.氨水溶液中,铜离子、银离子能与氨水反应生成四氨合铜离子和银氨络离子,不能大量共存,故C错误;
D.溶液中铝离子与硫离子、亚硫酸根离子发生双水解反应,不能大量共存,故D错误;
故选B。
9.D
【分析】根据加入Ba(OH)2溶液的体积为30mL和35mL时,沉淀部分溶解,溶解的沉淀为Al(OH)3,,则原溶液中存在Al3+,CO、HCO与Al3+不共存,在原溶液一定不含CO、HCO,则原溶液中存在SO,不存在Ba2+,剩余的沉淀为硫酸钡,最终沉淀的质量为6.990g,物质的量为0.03mol,则原溶液中,加入Ba(OH)2溶液为25mL时产生氨气,且,则原溶液中含有NH,物质的量为0.01mol,原溶液中不含HCO,则有0.05molOH-先与原溶液中的H+、Al3+反应,则原溶液中。
【详解】A.由上述分析可知,a点的沉淀为BaSO4和Al(OH)3,故A正确;
B.由上述分析可知,原溶液中,故B正确;
C.由上述分析可知,原溶液中存在Al3+,CO、HCO与Al3+不共存,则原溶液一定不含CO、HCO,故C正确;
D.根据电荷守恒可知,原溶液中不存在Cl-,故D错误;
故答案选D。
10.D
【详解】A.氢氧化钠溶液吸收尾气中氯气的反应为氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH—=ClO—+Cl—+H2O,故A错误;
B.氢氧化钠溶液与碳酸氢钠溶液反应生成碳酸钠和水,反应的离子方程式为HCO+OH—=CO+H2O,故B错误;
C.氢氧化钠溶液与氯化镁溶液反应生成氯化钠和氢氧化镁沉淀,反应的离子方程式为Mg2++2OH—=Mg(OH)2↓,故C错误;
D.氢氧化钠溶液与氯化铵溶液共热反应生成氯化钠、氨气和水,反应的离子方程式为NH+OH—NH3↑+H2O,故D正确;
故选D。
11.D
【详解】A.Cl2在饱和食盐水中的溶解度小,用饱和NaCl溶液除氯气中的氯化氢,故A正确;
B.Fe2(SO4)3和铁反应生成FeSO4,用铁粉除溶Fe2(SO4)3液中的FeSO4,故B正确;
C.Al(OH)3和足量NaOH溶液反应生成偏铝酸钠溶液,用氢氧化钠溶液除Mg(OH)2中的Al(OH)3,故C正确;
D.SO2、CO2都能与Na2CO3溶液反应,不能用饱和Na2CO3溶液除CO2中的SO2,用饱和NaHCO3溶液除CO2中的SO2,故D错误;
选D。
12.C
【详解】A.为弱电解质,不能拆成离子,反应为,故A错误;
B.用铁做电极电解饱和食盐水发生的是铁的吸氧腐蚀,阳极反应为Fe-2e-=Fe2+,阴极反应为2H2O+O2+4e-=4OH-,则总反应为:2Fe+2H2O+O2=2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,故B错误;
C.向硫代硫酸钠溶液中滴加稀硫酸,产生淡黄色沉淀是S,刺激性气味的气体是SO2,离子方程式为:,故C正确;
D.铝溶于氢氧化钠溶液反应的离子方程式为:,故D错误;
故选C。
13.D
【详解】A.溶液中Ba2+与亚硫酸根离子、碳酸根离子反应生成沉淀,不能大量共存,A不符合题意;
B.能使石蕊变红的溶液显酸性,溶液中含有大量H+,H+与碳酸氢根离子反应生成水和二氧化碳,不能大量共存,B不符合题意;
C.能使酚酞变红的溶液显碱性,溶液中含有大量OH-,OH-与Fe2+反应生成Fe(OH)2沉淀,不能大量共存,C不符合题意;
D.该组离子在含有大量Cu2+的溶液中,离子间不发生反应,能大量共存,D符合题意;
故选D。
14.A
【分析】Ba(OH)2与硫酸反应,生成硫酸钡和水,硫酸钡虽是强电解质,但由于溶解度较低,电离出的离子很少,导电能力较低;
【详解】A.向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,生成硫酸钡和水,AB段溶液的导电能力不断减弱,是因为生成BaSO4的溶解度较低,电离出的离子比较少,而BaSO4是电解质,A错误;
B.导电能力越强,离子浓度越大,B处的导电能力为0,说明溶液中几乎没有自由移动的离子,B正确;
C.BC段过量的硫酸电离产生氢离子和硫酸根离子,导致溶液中自由移动离子浓度变大,导电能力增强,C正确;
D.a时刻导电能力最弱,说明两者恰好完全反应,离子浓度最小,所以a时刻Ba(OH)2溶液中与稀硫酸恰好完全中和,D正确;
故选:A。
15.(1)⑤⑥⑦⑧
(2)NH3·H2ONH+OH—
(3) D Ba2++2OH—+SO+2H+=BaSO4↓+2H2O
(4)D
【详解】(1)若灯泡亮说明广口瓶内的物质A含有大量自由移动的离子,氯化钠、氢氧化钠晶体虽由离子构成,但离子不能自由移动,所以不导电,两者溶于水后,在水分子的作用下能电离出自由移动的阴、阳离子,所以二者的水溶液能导电;蔗糖晶体和酒精均是不能电离出自由移动离子的非电解质,不能导电,溶于水所得水溶液也不导电;稀盐酸、硫酸铜溶液中均含有大量自由移动的离子,可以导电,则广口瓶内的物质A可以是⑤⑥⑦⑧可以导电,故答案为:⑤⑥⑦⑧;
(2)一水合氨在溶液中部分电离出铵根离子和氢氧根离子,电离方程式为NH3·H2ONH+OH—,故答案为:NH3·H2ONH+OH—;
(3)A.盐酸中逐滴加入食盐溶液,不发生反应,混合后溶液存在自由移动的离子,可导电,灯泡不会熄灭,故不符合题意;
B.硫酸中逐滴加入氢氧化钠溶液发生的反应为硫酸溶液与氢氧化钠溶液反应生成硫酸钠和水,反应后的溶液存在自由移动的离子,可导电,灯泡不会熄灭,故不符合题意;
C.石灰乳中滴加稀盐酸发生的反应为氢氧化钙与盐酸反应生成氯化钙和水,反应后的溶液中离子浓度增大,导电性增强,灯泡不会熄灭,故不符合题意;
D.硫酸中逐滴加入氢氧化钡溶液的反应为硫酸溶液与氢氧化钡溶液反应生成硫酸钡沉淀和水,溶液中离子浓度减小,溶液的导电性减弱,当硫酸溶液恰好完全反应时灯泡熄灭,继续滴加氢氧化钡溶液,溶液中离子浓度又增大,溶液的导电性增强,灯泡会逐渐变亮,故符合题意;
故选D,D中反应的离子方程式为Ba2++2OH—+SO+2H+=BaSO4↓+2H2O,故答案为:D;Ba2++2OH—+SO+2H+=BaSO4↓+2H2O;
(4)由题意可知,氢氧化钙溶液中通入二氧化碳发生的反应为氢氧化钙溶液与二氧化碳反应生成碳酸钙沉淀和水,溶液中离子浓度逐渐减小,导电性减弱,当氢氧化钙溶液完全反应反应后,再通入的二氧化碳与溶液中的碳酸钙反应生成碳酸氢钙,溶液中离子浓度又增大,溶液的导电性又增强,则符合题意的图示为D,故答案为:D。
16.(1) 或
(2)
【详解】(1)①溶液和KOH反应生成溶液,化学方程式为;溶液和氨水反应生成溶液,化学方程式为。
②氨气和盐酸反应生成氯化铵,离子方程式为。
③亚硫酸钠被次氯酸钠溶液氧化生成硫酸钠溶液,在碱性条件下的离子方程式为。
(2)①步骤Ⅰ为Fe3+和CuS反应得到Fe2+、Cu2+、,S元素从-2升到+6,Fe元素从+3降到+2,则根据电荷守恒和原子守恒可得到反应的离子方程式为。
②步骤Ⅰ为酸性条件下Fe2+被氧气氧化为Fe3+,则根据电荷守恒和原子守恒可得到反应的离子方程式为。
17.(1)④⑥
(2)C
(3)取少量FeCl2于试管中,加水溶解,滴加KSCN溶液,无明显现象,再加入氯水或氯气或过氧化氢,溶液变为(血)红色,则可说明含有Fe2+,或者取少量FeCl2于试管中,加水溶解,滴入K3[Fe(CN)6]溶液,出现蓝色沉淀,则说明含有Fe2+
(4)CO2+2OH-=CO+H2O
(5)Cu2+、HCO
(6)Mg2+、SO
(7)Ba2+
【详解】(1)Al为金属单质,CO2、HCl为共价化合物,Na2O2、FeCl2、NaOH 为离子化合物,Na2O2、NaOH含有离子键和共价键,FeCl2只含有离子键,因此含有共价键的离子化合物是④⑥;故答案为④⑥;
(2)干冰为共价化合物,分子间存在范德华力,干冰受热变成二氧化碳气体,破坏的是范德华力,没有破坏极性共价键,选项C正确;故答案为C;
(3)FeCl2中含有阳离子是Fe2+,检验亚铁离子的操作是取少量FeCl2于试管中,加水溶解,滴加KSCN溶液,无明显现象,再加入氯水或氯气或过氧化氢,溶液变为(血)红色,则可说明含有Fe2+,或者取少量FeCl2于试管中,加水溶解,滴入K3[Fe(CN)6]溶液,出现蓝色沉淀,则说明含有Fe2+;故答案为取少量FeCl2于试管中,加水溶解,滴加KSCN溶液,无明显现象,再加入氯水或氯气或过氧化氢,溶液变为(血)红色,则可说明含有Fe2+,或者取少量FeCl2于试管中,加水溶解,滴入K3[Fe(CN)6]溶液,出现蓝色沉淀,则说明含有Fe2+;
(4)少量二氧化碳与NaOH溶液反应生成碳酸钠,即离子方程式为CO2+2OH-=CO+H2O,故答案为CO2+2OH-=CO+H2O;
(5)①HCO与盐酸反应二氧化碳气体,因此原溶液中加入过量的盐酸无现象,说明原溶液中不含有HCO;因为Cu2+显蓝色,原溶液与盐酸反应后得到无色溶液,说明原溶液中不含Cu2+;
②取操作①后的溶液,加入过量的NaOH溶液,产生白色沉淀,该白色沉淀只能为Mg(OH)2,推出原溶液中含有Mg2+;
③取操作②的滤液,加入过量的硝酸和硝酸银溶液,产生白色沉淀,该白色沉淀只能为AgCl,因为操作①中加入盐酸是过量,因此操作③不能说明原溶液中一定存在Cl-;
④取操作③后的滤液进行焰色试验,火焰呈黄色,推出原溶液中含有Na+,根据溶液呈现电中性,原溶液中含有SO,SO与Ba2+反应生成硫酸钡沉淀,则原溶液中一定不存在Ba2+;
综上所述,根据①的现象判断溶液中无Cu2+、HCO;故答案为Cu2+、HCO;
(6)根据(5)的分析,原溶液中一定存在的是Mg2+、SO;故答案为Mg2+、SO;
(7)根据(5)分析,原溶液中一定不存在的离子是Cu2+、HCO、Ba2+;故答案为Ba2+。
18.(1) 二氧化碳与氢氧化钠溶液反应,使得罐内气体的压强减小 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2) 先产生白色沉淀,后沉淀逐渐溶解 AlO+CO2+2H2O=Al(OH)3¯+HCO
(3)氨水
(4)1:3
(5) Al(OH)3+OH-=AlO+2H2O 1:2
【详解】(1)①二氧化碳气体被消耗,易拉罐内部压强减小,外部大气压大于易拉罐内部的压强,即二氧化碳与氢氧化钠溶液反应,使得罐内气体的压强减小;②由于氢氧化钠过量,后铝和氢氧化钠发生反应产生氢气,易拉罐内压强增大,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)①偏铝酸钠先和盐酸反应生成氢氧化铝沉淀,后氢氧化铝沉淀又被盐酸溶解,即先产生白色沉淀,后沉淀逐渐溶解;②过量二氧化碳生成氢氧化铝沉淀和碳酸氢盐,即AlO+CO2+2H2O=Al(OH)3¯+HCO
(3)由于氢氧化铝是两性氢氧化物,能溶于强碱氢氧化钠,所以使用氨水更好;
(4)反应2Al+6HCl=2AlCl3+3H2↑消耗6mol HCl生成3molH2,又反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑消耗2mol NaOH生成3molH2知物质的量相同的盐酸和氢氧化钠和足量的铝反应生成氢气物质的量之比为1:3;
(5)①由于盐酸过量,当加入10mL氢氧化钠时发生酸碱中和反应;加入10mL~50mL氢氧化钠时,发生Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3;加入50mL~60mL氢氧化钠时,氢氧化铝又溶解,即B点到C点的离子反应方程式;②令镁的物质的量为x mol,铝的物质的量为y mol,则由物料守恒结合反应Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3得2x+3y=0.04,又由反应得y=0.01,所以x=0.005,即合金中镁、铝物质的量之比为1:2。
相关试卷
这是一份2024届高三新高考化学大一轮专题练习--离子反应,共15页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习--离子反应,共17页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
这是一份2024届高三新高考化学大一轮专题练习—离子反应,共25页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。









