

2022北京石景山初三一模化学(教师版)
展开2022北京石景山初三一模
化 学
学校名称_______________________ 姓名_____________ 准考证号_____________
考生须知 | 1.本试卷共8页,共39道小题,满分70分。考试时间70分钟。 2.请在试卷和答题卡上准确填写学校名称、姓名和准考证号。 3.试题答案一律填涂或书写在答题卡上,选择题用2B铅笔作答,其他试题用黑色字迹签字笔作答,在试卷上作答无效。 4.考试结束,请将本试卷和答题卡一并交回。 |
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Ca 40
第一部分
本部分共25题,每题1分,共25分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.下列变化属于化学变化的是
A.矿石粉碎 | B.石蜡熔化 | C.酒精挥发 | D.食物腐败 |
2.空气成分中,体积分数约为21%的是
A.N2 | B.O2 | C.CO2 | D.稀有气体 |
3.为了防止骨质疏松,人体必须摄入的元素是
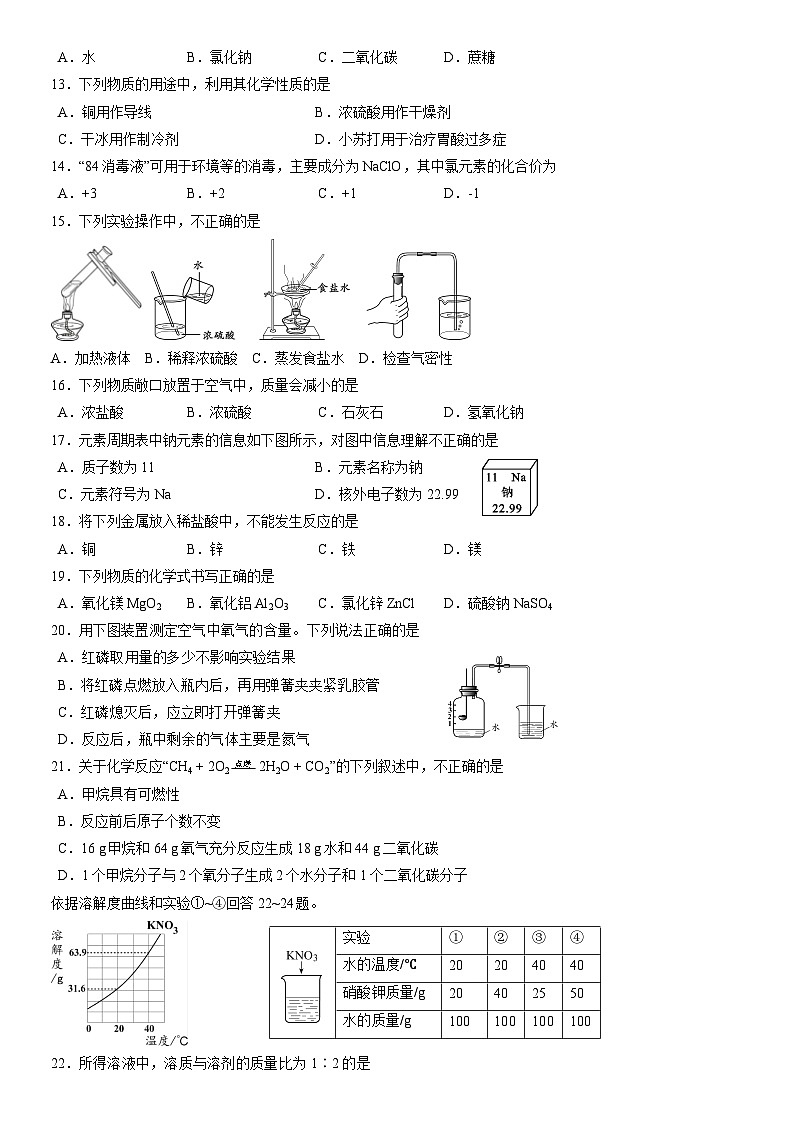
A.铁 | B.钙 | C.碘 | D.锌 |
4.下列生活垃圾属于可回收物的是
A.菜叶 | B.废旧电池 | C.废旧报纸 | D.一次性餐具 |
5.下列元素属于非金属元素的是
A.硅 | B.汞 | C.金 | D.钛 |
6.下列物质在O2中燃烧时,不会产生CO2的是
A.木炭 | B.氢气 | C.一氧化碳 | D.蜡烛 |
7.某些食品的近似pH如下,其中酸性最强的是
食品 | A.柠檬汁 | B.番茄汁 | C.牛奶 | D.玉米粥 |
pH | 2.4 | 4.4 | 6.5 | 7.8 |
8.下列净化水的操作中,净化程度最高的是
A.过滤 | B.沉淀 | C.吸附 | D.蒸馏 |
9.下列物质由氧分子构成的是
A.H2O | B.O2 | C.CO2 | D.H2O2 |
10.小苏打在加热时的反应为2NaHCO3 ==== Na2CO3 + H2O + CO2↑,该反应属于
A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
用水、氯化钠、二氧化碳、蔗糖等物质可以自制“盐汽水”。回答11~12题。
11.自制的“盐汽水”属于
A.纯净物 | B.化合物 | C.混合物 | D.盐 |
12.自制“盐汽水”的原料中属于有机化合物的是
A.水 | B.氯化钠 | C.二氧化碳 | D.蔗糖 |
13.下列物质的用途中,利用其化学性质的是
A.铜用作导线 | B.浓硫酸用作干燥剂 |
C.干冰用作制冷剂 | D.小苏打用于治疗胃酸过多症 |
14.“84消毒液”可用于环境等的消毒,主要成分为NaClO,其中氯元素的化合价为
A.+3 | B.+2 | C.+1 | D.-1 |
15.下列实验操作中,不正确的是
A.加热液体 B.稀释浓硫酸 C.蒸发食盐水 D.检查气密性
16.下列物质敞口放置于空气中,质量会减小的是
A.浓盐酸 | B.浓硫酸 | C.石灰石 | D.氢氧化钠 |
17.元素周期表中钠元素的信息如下图所示,对图中信息理解不正确的是
A.质子数为11 | B.元素名称为钠 |
C.元素符号为Na | D.核外电子数为22.99 |
18.将下列金属放入稀盐酸中,不能发生反应的是
A.铜 | B.锌 | C.铁 | D.镁 |
19.下列物质的化学式书写正确的是
A.氧化镁 MgO2 | B.氧化铝 Al2O3 | C.氯化锌ZnCl | D.硫酸钠 NaSO4 |
20.用下图装置测定空气中氧气的含量。下列说法正确的是
A.红磷取用量的多少不影响实验结果 |
B.将红磷点燃放入瓶内后,再用弹簧夹夹紧乳胶管 |
C.红磷熄灭后,应立即打开弹簧夹 |
D.反应后,瓶中剩余的气体主要是氮气 |
21.关于化学反应“CH4 + 2O2 点燃 2H2O + CO2”的下列叙述中,不正确的是
A.甲烷具有可燃性 |
B.反应前后原子个数不变 |
C.16 g甲烷和64 g氧气充分反应生成18 g水和44 g二氧化碳 |
D.1个甲烷分子与2个氧分子生成2个水分子和1个二氧化碳分子 |
依据溶解度曲线和实验①~④回答22~24题。
| 实验 | ① | ② | ③ | ④ |
水的温度/℃ | 20 | 20 | 40 | 40 | |
硝酸钾质量/g | 20 | 40 | 25 | 50 | |
水的质量/g | 100 | 100 | 100 | 100 |
22.所得溶液中,溶质与溶剂的质量比为1∶2的是
A.① | B.② | C.③ | D.④ |
23.所得溶液属于饱和溶液的是
A.① | B.② | C.③ | D.④ |
24.所得溶液的溶质质量分数为20%的是
A.① | B.② | C.③ | D.④ |
25.用下图装置探究可燃物燃烧的条件,图1铜片上白磷和图2水中白磷发生燃烧。下列结论不正确的是
图1 图2
A.烧杯中热水的作用之一是使白磷达到燃烧所需的温度 |
B.对比铜片上的白磷、红磷发生的现象,说明可燃物燃烧温度要达到着火点 |
C.对比铜片上红磷、水中白磷发生的现象,说明可燃物燃烧要与氧气接触 |
D.对比水中白磷通氧气前后发生的现象,说明可燃物燃烧要与氧气接触 |
第二部分
本部分共14题,共45分。
〖生活现象解释〗
26.(1分)从26-A或26-B两题中任选一个作答,若两题均作答,按26-A计分。
26-A NaOH的俗称之一是_____。 | 26-B Ca(OH)2的俗称之一是_____。 |
27.(3分)醋是日常生活中常用的调味品,主要通过大米或高粱等谷物经过发酵制成。
(1)谷物中富含的营养素是 (填序号)。
A.糖类 B.油脂 C.蛋白质
(2)醋酸(CH3COOH)中质量分数最大的元素是 。
(3)葡萄糖和酒精两种物质的共同点是______。
28.(3分)CO2是人类实现可持续发展必须善加利用的资源。下图是通过清洁能源电解水制取氢气,再将CO2转化为燃料或其他化学品的示意。
(1)下列发电方式利用清洁能源的是______(填序号)。
A.风力发电 B.太阳能光伏发电 C.燃煤发电
(2)电解水制取氢气反应的化学方程式为______。
(3)CO2加氢制甲醇微观示意图如下。参与反应的A与B的分子个数比为______。
〖科普阅读理解〗
29.(5分)阅读下面科普短文。
贝壳主要由95%左右的CaCO3与5%左右的贝壳素构成,是一种天然的生物资源,拥有非常高的利用价值。
贝壳经过高温煅烧等加工处理后,可用来制作建筑材料、动物和人体所需的钙补充剂。
贝壳具有多级层状结构,拥有良好的吸附性,可用作污水、土壤中重金属的吸附剂。研究人员用贝壳粉和CaCO3粉末分别对某土壤样品(被铅蓄电池污染)中Pb吸附效果进行实验,结果如图1。
贝壳经加工可用于涂料,贝壳涂料具有隔热保温功能。研究人员对贝壳涂料的隔热保温功能进行了实验:制作4个相同的纸箱模拟封闭建筑。甲作为对照不涂刷涂料,乙在内壁涂刷涂料,丙在外壁涂刷涂料,丁在内壁和外壁涂刷涂料。干燥后,将68℃500 mL的水同时放入四个纸箱中,
自然冷却45 min,测量水温,结果如下表。
| 甲 | 乙 | 丙 | 丁 |
温度/℃ | 50.7 | 52 | 52.5 | 52.5 |
贝壳具有广泛应用前景,若能有效利用,必会产生巨大经济和环保生态效益。
(原文作者崔童、赵镇东等,有删改)
依据文章内容回答下列问题。
(1)贝壳中CaCO3所占比例约为______。
(2)在保温领域,贝壳涂料涂刷在 (填“内壁”或“外壁”)效果更好。
(3)判断下列说法是否正确(填“对”或“错”)。
① 贝壳可以用作吸附剂,是因为它具有多级层状结构。______
② 贝壳是制作动物和人体所需的钙补充剂的一种原料。______
(4)根据图1实验,得出的结论是______。
〖生产实际分析〗
30.(3分)工业上炼铁的主要原料是铁矿石、焦炭、石灰石、空气,生产过程示意如右图。
(1)石灰石的主要作用是将铁矿石中的杂质转化
为炉渣。石灰石的主要成分是______。
(2)生成还原性气体CO的原料有______。
(3)CO与赤铁矿中Fe2O3反应的化学方程式为______。
31.(3分)二氧化钛溶胶常用于无机胶黏剂、陶瓷等,其主要工艺流程如下图。
已知:反应釜中发生的反应为:TiCl4 + 4NaOH === TiO2 + 2H2O + 4NaCl。
(1)反应釜中,反应前后的物质属于氧化物的有______。
(2)过滤器中,除去的物质是______。
(3)分散釜中,加入x的目的是调节pH为1~2,得到二氧化钛溶胶。x为______(填“盐酸”或“NaOH溶液”)。
〖基本实验及其原理分析〗
32.(3分)根据下图回答问题。
A B C D E
(1)实验室用高锰酸钾制取氧气的化学方程式为 。
(2)实验室制取二氧化碳时,选用的发生及收集装置分别是 ;检验二氧化碳已经收集满的方法是 。
33.(2分)如下图进行实验,点燃酒精灯至木炭红热,将过氧化氢溶液加入平底烧瓶中。
A B C
(1)A中发生反应的化学方程式为 。
(2)B和C中观察到的现象是 。
34.(3分)用下图实验(夹持仪器已略去)研究铁的性质。
实验1 实验2 实验3
(1)实验1,点燃酒精灯,一段时间后蜡片熔化,说明铁具有的性质是______。
(2)实验2,铁丝在氧气中燃烧反应的化学方程式为______。
(3)实验3,观察到的现象是______。
35.(3分)用下图所示仪器配制50 g溶质质量分数为6%的NaCl溶液。
(1)实验中需要称量NaCl固体的质量为 g。
(2)量取水的体积时,用到的仪器有胶头滴管和 。
(3)实验中的下列操作,需要用到玻璃棒的是 (填序号)。
A.称量 B.溶解 C.装瓶贴标签
36.(3分)在两个小烧杯中进行氢氧化钠性质的实验。
实验1 实验2
(1)实验1中,氢氧化钠发生潮解,说明氢氧化钠具有的性质是______;久置后氢氧化钠发生变质,用化学方程式表示其原因:______。
(2)实验2中,证明氢氧化钠能与盐酸发生反应的现象是______。
37.(3分)取3支试管,各放入一个生锈的铁钉,再分别加入5 mL不同浓度的硫酸溶液,进行实验,记录如下表。
硫酸溶液 | 实验条件 | 实验现象 |
10% | 不加热 | 30 s铁锈脱落,50 s出现较明显小气泡,90 s溶液发红 |
10% | 酒精灯上加热 | 10 s出现明显气泡,20 s铁锈脱落,65 s铁锈消失,溶液变黄 |
20% | 酒精灯上加热 | 5 s出现明显气泡,10 s铁锈脱落,45 s铁锈消失,溶液变黄 |
(1)溶液变黄是因为生成了______。
(2)用化学方程式表示溶液中出现气泡的原因:______。
(3)该实验可以得出的结论是______。
〖科学探究〗
38.(7分)实验小组的同学探究不同的配制方法对紫色石蕊溶液显色的影响。
【查阅资料】石蕊能溶于水或乙醇中。
【进行实验1】分别用某品牌的石蕊1 g进行4种方法的石蕊溶液配制。
方法 | 蒸馏水体积/mL | 操作 | 石蕊溶液 | 溶液颜色 |
① | 100 | 搅拌,静置1 h,过滤 | 滤液 | 紫色 |
② | 100 | 煮沸后过滤 | 滤液 | 紫色 |
③ | 100 | 搅拌,静置24 h,过滤 | 滤液 | 紫色 |
④ | 50 | 搅拌,静置24 h,过滤 | 滤液加30 mL乙醇,再加蒸馏水稀释至100 mL | 紫色 |
【解释与结论】
(1)方法①配制的石蕊溶液中,溶质是______。
(2)方法④中,加蒸馏水稀释至100 mL时,加入的蒸馏水体积大于20 mL。说明分子具有的性质是______。
【进行实验2】用4种方法配制的石蕊溶液进行显色实验:向被试溶液中滴加石蕊溶液。
被试溶液 | 方法① | 方法② | 方法③ | 方法④ |
10%盐酸 | 红 | 红 | 红 | 浅红 |
饱和二氧化碳溶液 | 浅红 | 浅红 | 浅红 | 不明显 |
饱和碳酸钠溶液 | 蓝 | 蓝 | 蓝 | 浅蓝 |
澄清石灰水 | 蓝 | 蓝 | 蓝 | 浅蓝 |
【解释与结论】
(3)通过实验可得出饱和碳酸钠溶液呈______(填“酸性”或“碱性”)。
(4)向饱和二氧化碳溶液中滴加石蕊溶液呈浅红色,用化学方程式解释其原因:______。
(5)进行实验2时,需要控制的相同条件是:取用被试溶液的体积相同、______。
【反思与评价】
(6)经实验证明,配制方法④的滤渣中还有较多未溶解的石蕊。实验方案是:向滤渣中加入50 mL蒸馏水,______。
(7)用方法④配制的石蕊溶液进行显色实验时现象不明显,原因可能是______。
〖实际应用定量分析〗
39.(3分)硫酸厂的污水中含有硫酸等物质,可以用氢氧化钙(假设其他物质不与氢氧化钙反应)进行中和处理。请计算:74 kg氢氧化钙可以处理硫酸的质量。
参考答案
第一部分
(每小题1分,共25分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
答案 | D | B | B | C | A | B | A | D | B | B | C | D | D |
题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
答案 | C | B | A | D | A | B | D | C | D | B | C | C |
|
第二部分
(26 ~ 38题每空1分,39题3分,共45分)
26-A 火碱(或烧碱、苛性钠) 26-B 熟石灰(或消石灰)
27.(1)A (2)氧(或O)
(3)都是由碳、氢、氧三种元素组成(或构成分子的原子种类相同)
28.(1)A B (2) 2H2O == 2H2↑+ O2↑
(3)1∶3
29.(1)95% (2)外壁
(3)① 对 ② 对
(4)在0-10%的添加量范围内,相同添加量时,贝壳粉对Pb的吸附效果好于碳酸
钙粉末
30.(1)碳酸钙(CaCO3) (2)焦炭、空气
(3)Fe2O3 + 3CO == 2Fe + 3CO2
31.(1)TiO2、H2O (2)NaCl溶液
(3)盐酸
32.(1)2KMnO4 == K2MnO4 + MnO2 + O2↑
(2)B C 将燃着的木条放在集气瓶口,火焰熄灭,证明CO2已收集满
33.(1)2H2O2 == 2H2O + O2↑
(2)B中木炭剧烈燃烧、发出白光,C中澄清石灰水变浑浊
34.(1)导热性 (2)3Fe + 2O2 == Fe3O4
(3)铁丝表面有紫红色固体生成,溶液由蓝色变为浅绿色(或溶液颜色变浅)
35.(1)3 (2)量筒
(3)B
36.(1)吸水性 2NaOH + CO2 = Na2CO3 + H2O
(2)溶液由红色变为无色
37.(1)Fe2(SO4)3
(2)Fe + H2SO4 = FeSO4 + H2↑
(3)相同条件下,升高温度、增大硫酸浓度均能加快铁锈与硫酸的反应
38.(1)石蕊
(2)分子间有间隔
(3)碱性
(4)CO2 + H2O = H2CO3
(5)滴加石蕊溶液的滴数相同
(6)搅拌,静置1h,过滤,得到紫色溶液(答案合理即可)
(7)石蕊溶液的浓度低
39.【解】设:74 kg氢氧化钙可以处理硫酸的质量为x。
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
74 98
74 kg x
x = 98 kg
答:74 kg氢氧化钙可以处理硫酸的质量为98 kg。
2022北京石景山初三一模化学试卷: 这是一份2022北京石景山初三一模化学试卷,共8页。
2022北京通州初三一模化学(教师版): 这是一份2022北京通州初三一模化学(教师版),共28页。
2022北京顺义初三一模化学(教师版): 这是一份2022北京顺义初三一模化学(教师版),共29页。试卷主要包含了 下列属于纯净物的是, 下列食物富含蛋白质的是, 下列物质由离子构成的是等内容,欢迎下载使用。












