



人教版 (2019)必修 第二册第一节 化学反应与能量变化课堂教学ppt课件
展开本课件内嵌有高清视频供老师参考使用视频:原电池实验本页可自行删除
通过实验探究,认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。通过对原电池的学习,体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。通过原电池的学习,能举出化学能转化为电能的实例,能辨识简单原电池的构成要素,并能分析简单原电池的工作原理。
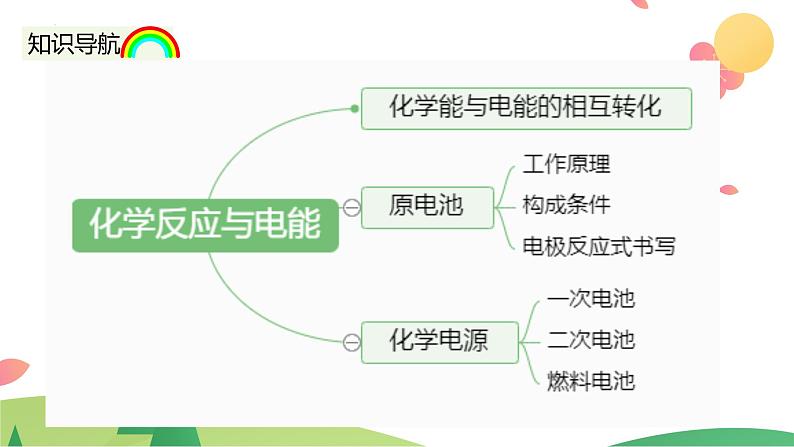
一.化学能与电能的相互转化
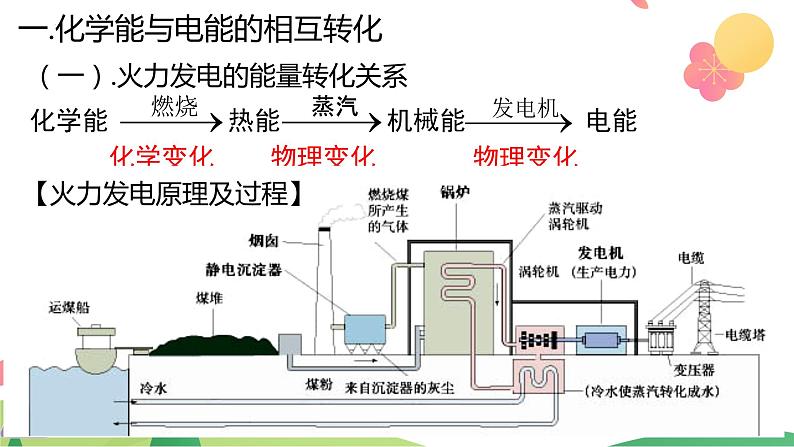
(一).火力发电的能量转化关系
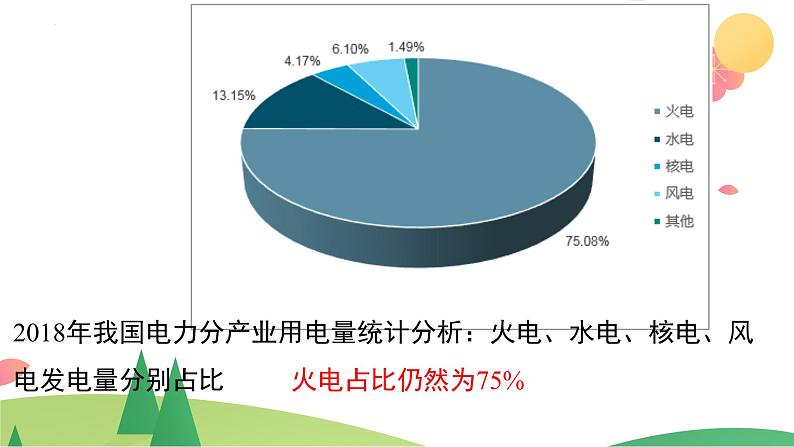
2018年我国电力分产业用电量统计分析:火电、水电、核电、风电发电量分别占比 火电占比仍然为75%
要想使氧化还原反应释放的能量直接转变为电能,就要设计一种装置,使 反应和 反应分别在两个不同的区域进行,并使其间的 转移,在一定条件下形成 。为了使用方便,还需要把可产生的 以 的形式储存起来。 就是这样的一种装置。这种装置可以将 体系的能量储存起来,类似于水库的蓄存水能。
【实验探究】实验2-4
【实验探究】参照实验2-4填写以下表格
Zn+2H+=Zn2++H2↑
电子从 片( 极)通过导线流向 片( 极),形成电流;电解质溶液中, 离子向铜片(正极)移动, 离子向锌片(负极)移动。原电池反应本质是 反应。原电池是一种 的装置。
负极:发生氧化反应,电子流出(流向正极)的一极 正极:发生还原反应,电子流入(来自负极)的一极
2.原电池的工作原理及导电粒子流向
电子流向(外电路):负极→导线→正极(电流方向与电子流向相反)。离子流向(内电路):阴离子向负极移动,阳离子向正极移动。
请根据铜锌原电池(稀硫酸),完成表格:
Zn-2e-===Zn2+
2H++2e-===H2↑
由Zn片沿导线流向Cu片
总反应:Zn+2H+=Zn2++H2↑
① 自发进行的氧化还原反应 ② 两个电极(一般活泼性不同) ③ 闭合回路 ④ 电解质溶液(熔融电解质)
4.原电池正、负极的判断
①比较金属活动性强弱。一般作负极的金属比作正极的金属活泼。②金属的防护。使被保护的金属制品作原电池正极而得到保护。③设计制作化学电源。化学能转化为电能。④加快化学反应速率。自发进行的氧化还原反应,形成原电池时会使反应速率加快。
普通锌锰干电池、碱性锌锰干电池、锌银电池(钮扣电池)等。
1.一次电池——锌锰干电池
锌锰电池的负极是锌筒,正极是碳棒,电解质溶液是MnO2和NH4Cl糊状物(酸性,锌筒易腐蚀)。
体积小、性能好的碱性锌-锰干电池应运而生。这类电池的重要特征是电解液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。
(1)常见类型:铅酸蓄电池、镍氢电池、锂离子电池等;(2)特点:放电:化学能转化为电能;充电:电能转化为化学能。放电时发生的氧化还原反应,在充电时逆向进行,使电池恢复到放电前的状态。
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。特点:清洁、安全、高效;能量转化率可以达到80%以上;反应物不是储存在电池内部,而是从外部提供,供电量易于调节。
电解质:H2SO4溶液
总反应:2H2 + O2 = 2H2O
负极:2H2 - 4e- = 2H+
正极:O2 + 4H+ +4e- = 2H2O
2H2 - 4e- == 4H+
O2 + 4H+ + 4e-== 2H2O
O2 + 2H2O + 4e-== 4OH-
2H2 +4OH-- 4e- == 4H2O
三.原电池电极反应式的书写
1.一般电极反应式的书写,以离子方程式形式表示
A.列物质,标得失:按照负极氧化反应,正极还原反应,判断电极反应物、生成物,标出电子得失。B.看环境,配守恒:电极产物在电解质溶液的环境中应能稳定存在,如酸性介质中,OH-不能存在,应生成水;碱性介质中,H+不能存在,应生成水;电极反应式同样要遵循电荷守恒、原子守恒、得失电子守恒。C.两式加,验总式:正负极反应式相加,与总反应离子方程式验证。
2.利用总反应式书写电极反应式
①根据总反应式找出 氧化剂、还原剂、氧化产物和还原产物②确定介质的酸碱性或者其它特性。③书写电极反应式。 负极反应:还原剂-ne-=氧化产物 正极反应:氧化剂+ne-=还原产物④书写技巧:若某电极反应式较难写出时,可先写出较易写的电极反应式,然后根据得失电子守恒,用总反应式减去较易写的电极反应式,即可得出较难写的电极反应式。
1.电池中含有大量的重金属、酸、碱等物质。
2.一粒小小的钮扣电池可污染600立方米水,相当于一个人一生的饮水量;一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害。
3.电池的回收废旧电池中的有色金属是宝贵的自然资源,如果能回收再利用这些废旧电池,不仅可以减少对我们生存环境的破坏,而且也是对资源的节约。
防止重金属离子污染环境如Hg2+,Cd2+回收利用有色金属节约资源
1.(2021·湖北·襄阳市襄州区第一高级中学高一期末)关于原电池的下列说法中,正确的是A.在正极上发生还原反应B.化学性质较活泼的金属为正极C.在外电路,电子流出正极D.是由电能转化为化学能的装置【答案】A
2.(2021·云南·罗平县第二中学高一阶段练习)理论上放热的氧化还原反应都可以设计成原电池,关于该反应Fe+2H+=Fe2++H2↑设计成原电池的说法中正确的是A.硝酸可能为电解质溶液B.工作时溶液H+向负极移动C.负极反应为2H++2e-=H2D.碳棒可能为原电池正极【答案】D
3.(2021·广西南宁·高一期末)氢氧燃料电池的构造如图所示。下列说法正确的是A.a是电池正极B.b电极的电极反应为O2+4e-+4H+=2H2OC.电池工作时,电池内部中的H+向a电极迁移D.电子由a沿导线流向b,再由b通过电解质溶液流回a【答案】B
4.(2021·云南·昆明八中高一期中)有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活泼性由强到弱的顺序是A.D>A>B>CB.B>A>D>CC.D>B>A>CD.D>A>C>B【答案】A
5.(2021·江苏·东海县教育局教研室高一期中)将纯锌片和纯铜片按图示方式插入同浓度稀硫酸中一段时间,以下叙述正确的是A.产生气泡的速率甲比乙慢B.两烧杯中溶液的酸性均减弱C.甲中铜片作正极,乙中铜片作负极D.两烧杯中铜片表面均无气泡产生【答案】B
高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸图文ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸图文ppt课件,共23页。PPT课件主要包含了考纲要求,乙酸乙酯的制备,实验装置,反应物混合方法,酯化反应机理等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第七章 有机化合物第四节 基本营养物质说课课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第七章 有机化合物第四节 基本营养物质说课课件ppt,共32页。PPT课件主要包含了考纲要求,基本营养物质,葡萄糖,2探究流程,稀硫酸,催化作用,NaOH溶液等内容,欢迎下载使用。
人教版 (2019)必修 第二册第三节 乙醇与乙酸教案配套ppt课件: 这是一份人教版 (2019)必修 第二册第三节 乙醇与乙酸教案配套ppt课件,共29页。PPT课件主要包含了考纲要求,一乙醇的物理性质,无色透明,特殊香味,沸点78℃易挥发,分子式C2H6O,结构式,结构简式,CH3CH2OH,或C2H5OH等内容,欢迎下载使用。













