

山东省烟台市2022-2023学年高一化学下学期4月期中试题(Word版附答案)
展开2022-2023学年度第二学期期中学业水平诊断
高一化学(等级考)
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学与科技、生产、生活密切相关,下列说法正确的是
A.“熬胆矾铁釜,久之亦化为铜”,说明铁能置换出铜,铁釜能减缓锈蚀
B.金属Na的冶炼和氯碱工业都用到了NaCl,电解时阳极都是放电
C.冬奥场馆建筑应用了新材料碲化镉发电玻璃,碲和镉均属于过渡元素
D.“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能
2.下列化学用语正确的是
A.和互为同素异形体 B.中子数为12的钠离子:
C.HClO的电子式为 D.表示的Ti原子质量数为46
3.下列说法错误的是
A.非金属单质中一定不含离子键,一定只含共价键
B.化学键是相邻原子之间的强相互作用
C.酸雨后钢铁易发生析氢腐蚀,日常铁锅存留盐液时易发生吸氧腐蚀
D.电热水器有镁棒防止内胆腐蚀是牺牲阳极保护法
4.下列说法错误的是
A.化学反应一定伴随能量变化,有能量变化的过程未必是化学反应
B.已知,则石墨比金刚石更稳定
C.中和热测定实验中,应当缓慢分次倒入NaOH溶液并搅拌
D.,则
5.某同学进行海带提碘实验,部分实验操作如下:将灼烧后的海带灰放入烧杯中,加入蒸馏水充分浸泡后放置在铁三脚上的石棉网上加热,煮沸2~3分钟,冷却后过滤。将适量稀硫酸与双氧水滴入滤液,充分反应后转移至分液漏斗。打开盛有的试剂瓶,将橡胶塞倒放,取少量加入分液漏斗中,塞紧瓶塞。将分液漏斗多次振荡放气后静置分液,层从上口倒出。实验中存在错误的有几处
A.1 B.2 C.3 D.4
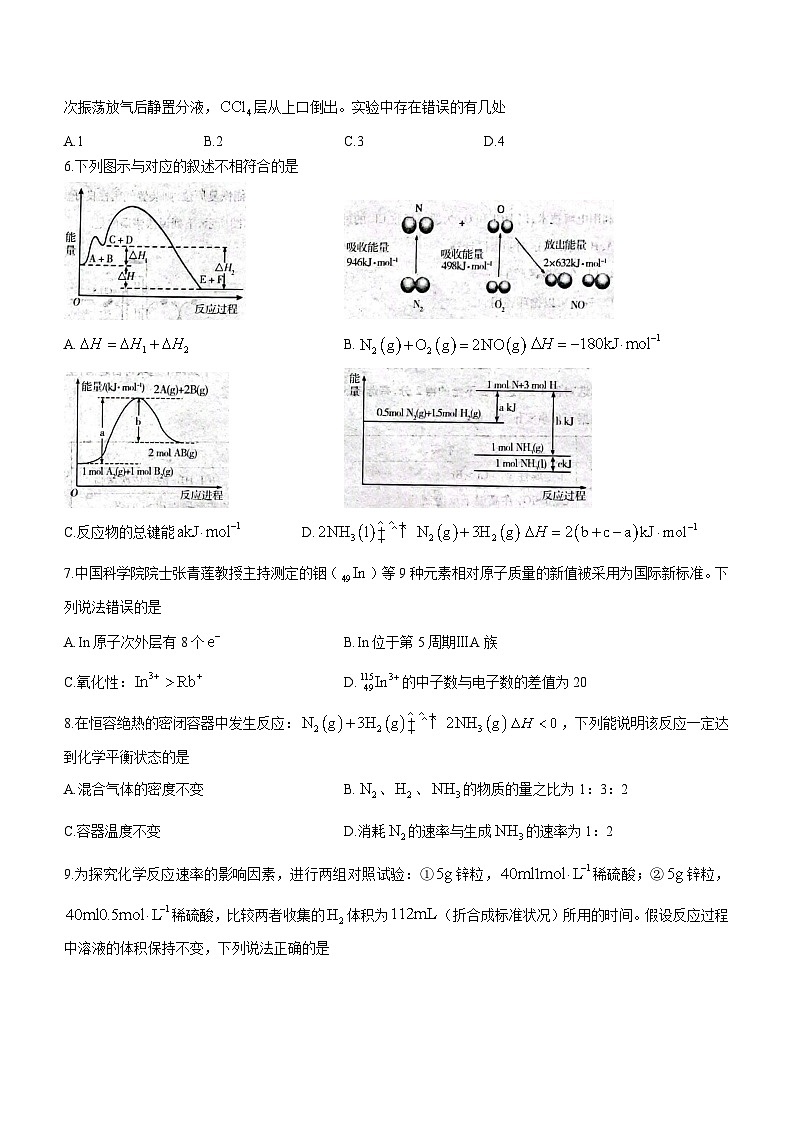
6.下列图示与对应的叙述不相符合的是
A. B.
C.反应物的总键能 D.
7.中国科学院院士张青莲教授主持测定的铟()等9种元素相对原子质量的新值被采用为国际新标准。下列说法错误的是
A.In原子次外层有8个 B.In位于第5周期ⅢA族
C.氧化性: D.的中子数与电子数的差值为20
8.在恒容绝热的密闭容器中发生反应:,下列能说明该反应一定达到化学平衡状态的是
A.混合气体的密度不变 B.、、的物质的量之比为1:3:2
C.容器温度不变 D.消耗的速率与生成的速率为1:2
9.为探究化学反应速率的影响因素,进行两组对照试验:①锌粒,稀硫酸;②锌粒,稀硫酸,比较两者收集的体积为(折合成标准状况)所用的时间。假设反应过程中溶液的体积保持不变,下列说法正确的是
A.实验①中用和表示的反应速率的关系为
B.若实验①用了,则用来表示的速率为
C.该实验所需要的主要仪器除以上装置中的仪器,不需要其它仪器
D.组装好仪器后,将注射器活塞拉出一段距离,若活塞能恢复原位,则装置气密性良好
10.利用电解技术,以HCl和为原料回收的过程如图所示,下列说法错误的是
A.由阳极区向阴极区迁移 B.在阳极区产生
C.可以循环利用 D.电路中转移电子需要消耗标准状况下
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.根据下列事实推测出的结论合理的是
| 事实 | 推测 |
A | 非金属性: | HF、HCl、HBr酸性依次增强 |
B | C和在高温下反应制Si | C的非金属性比Si的强 |
C | Si是半导体材料,同族Ge也是半导体材料 | ⅣA族的元素都是半导体材料 |
D | Na与Cl形成离子键,Al与Cl形成共价键 | Si与Cl形成共价键 |
12.X、Y、Z、W、M为原子序数依次增大的前20号主族元素,其中仅有一种金属元素,且只有两种元素处于同一周期。自然界中Z的单质主要存在于火山口附近,X和Y最外层电子数之和是M最外层电子数的3倍。下列说法一定正确的是
A.X与Y、Z、W均可形成18电子微粒
B.简单离子半径:
C.稳定性:
D.氧化物对应水化物的酸性:
13.在一定温度下向体积为的恒容密闭容器中,充入一定量的气体A和气体B,反应生成气体C和固体D,各物质的含量随时间的变化情况如图所示,下列说法错误的是
A.该反应的化学方程式为
B.内用D表示的化学反应速率:
C.反应体系内气体的密度不再发生变化说明反应达到平衡
D.该反应在时改变的条件不可能是加入催化剂
14.在实验室中从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质)中回收钴、锂的操作流程如图:
已知:拆解废旧电池获取正极材料前,先将其浸入NaCl溶液中,使电池短路而放电,此时溶液温度升高。下列说法错误的是
A.拆解废旧电池获取正极材过程中能量的主要转化方式为化学能→热能→电能
B.“滤液”主要成分是
C.“酸浸”时消耗、、物质的量之比为6:1:3
D.若用盐酸替代硫酸、溶液可同样达到“酸浸”的目的,但产生污染环境
15.为实现“双碳”目标,我国科学家研发了一种水系可逆电池,电池工作时,复合膜(由a、b膜复合而成)层间的解离成和,在外加电场作用下可透过相应的离子膜定向移动。当闭合时,电池工作原理如图所示。下列说法正确的是
A.闭合时,Zn发生还原反应生成
B.闭合时,通过a膜向Pd电极方向移动
C.闭合时,Pd电极上与直流电源负极相连
D.闭合时,若析出,则Pd电极上生成
三、非选择题:本题共5小题,共60分。
16.(12分)M、X、Y、Z、W元素的原子序数依次增大,M与Y同主族,X、Z的最外层电子数之和等于Z的内层电子数,最外层电子数Y是X的2倍,X、W的单质是生产、生活中应用最广的两种金属。
回答下列问题:
(1)M、X、Z的简单离子半径由大到小的顺序为__________(用离子符号表示);实验室检验常用的试剂是__________。
(2)Z离子结构示意图为__________;W在元素周期表中的位置是__________。
(3)X最高价氧化物对应水化物与强碱溶液反应的离子方程式为__________;W的单质与水蒸气在高温下反应,此反应中还原剂与还原产物的物质的量之比为__________;写出一个能体现X、W金属性强弱的离子方程式:____________________。
(4)M、Y、Z元素非金属性由强到弱的顺序是__________(用元素符号表示);能比较Y和Z的非金属性强弱的依据是__________(填标号)。
A.氢化物酸性Z强于Y
B.Z的单质能与Y的氢化物反应得到Y的单质
C.气态氢化物的稳定性Z强于Y
D.最高价氧化物对应水化物的酸性Z强于Y
17.(12分)在一定条件下与反应生成,回答下列问题:
(1)已知拆开键,键,键分别需要的能量是、、,则生成的热化学方程式为__________。
(2)关于的催化氧化反应,先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达700℃以上。下列图示中,能够正确表示该反应过程中能量变化的是__________(填标号),说明断键吸收的能量__________(填“大于”“小于”或“等于”)成键放出的能量。
(3)向的密闭容器中充入和,在催化剂条件下生成的反应达到最大限度。
①反应达到最大限度时,正反应速率__________逆反应速率(填“>”“<”或“=”)。
②该过程中断裂的吸收的热__________(填“>”、“<”或“=”),原因是__________。
③测得的物质的量为,则该过程中放出的热量为__________kJ,的体积分数__________。
18.(12分)一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
(1)a极的电极反应式为__________;Fe电极为__________极,其电极反应式为__________。
(2)甲装置每消耗,溶液中通过质子交换膜的为__________mol,如果粗铜中含有锌、银等杂质,丙装置中__________(填“增大”“减小”或“不变”)。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(电极未标出)。
装置A发生反应的化学方程式为__________;图中X的化学式为__________;NaOH溶液的质量分数为a%、b%、c%,由大到小的顺序为__________。
19.(10分)已知,回答下列问题:
(1)在100℃时,将气体充入的密闭容器中,隔一段时间对容器内的物质进行分析得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
0.100 | 0.050 | a | b | |||
0.000 | 0.060 | 0.120 | 0.120 | 0.120 |
①表中__________(填“>”“<”或“=”,下同);a__________b。
②时的浓度__________,在内的平均反应速率为__________。
(2)一定温度下,体积为的恒容密闭容器中,各物质的物质的量随时间变化的关系如图所示。
①若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中,乙中,则__________中反应更快。
②。该反应达最大限度时Y的转化率为__________;若初始压强为,则平衡时__________(用含的表达式表示)。
③下列描述能表示该反应达平衡状态的是__________(填标号)。
A.容器内气体的密度不再发生变化 B.混合气体总的物质的量不再发生变化
C.容器内气体的颜色不再改变 D.容器中X与Y的物质的量相等
E. F.容器内气体的平均相对分子质量不再改变
20.(14分)将转化为有价值的甲酸是实现“碳中和”的途径之一。回答下列问题:
(1)转化为工业原料甲酸(HCOOH)。已知:
Ⅰ.
Ⅱ.
Ⅲ.
则反应Ⅱ的__________。
(2)利用电化学方法可以将有效地转化为,后续经酸化转化为HCOOH,原理示意图如图所示:
①电解池的阴极电极反应式为__________;阴极除有生成外,还可能生成副产物__________。
②电解一段时间后,阳极区的溶液浓度降低__________(填“升高”、“不变”或“降低”)。
③若以铅蓄电池为直流电源,则铅蓄电池中a极的电极反应式为__________。
(3)若以HCOOH燃料电池(工作原理如图所示)为直流电源,该离子交换膜为__________(填“阳”或“阴”)离子交换膜;电池负极反应式为__________;虚线框内发生的离子方程式为__________;需补充物质X的化学式为__________。
2022~2023学年度第二学期期中学业水平诊断
高一化学(等级考)参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.B 2.D 3.A 4.C 5.B 6.B 7.A 8.C 9.D 10.D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.D 12.AC 13.BD 14.AC 15.BD
三、非选择题
16.(12分)
(1)(1分) 品红溶液(1分)
(2)(1分) 第4周期Ⅷ族(1分)
(3)(2分) 3:4(1分) (2分)
(4)(1分) BCD(2分)
17.(12分)
(1)(2分)
(2)A(1分) 小于(1分)
(3)①=(1分)②<(1分)合成氨反应是可逆反应,氮气不能完全反应,断裂的吸收的热是小于(2分)。 ③36.32(2分) 18.75%(2分)
18.(12分)
(1)(2分) 阴(1分) (2分)
(2)1(1分) 减小(1分)
(3)(2分) (1分) (2分)
19.(10分)
(1)①>(1分) =(1分) ②0.070(1分) 0.0015(2分)
(2)①甲(1分) ②60%(1分) (1分) ③BCF(2分)
20.(14分)
(1)(2分)
(2)①(2分) 、CO(答案合理即可)(1分)
②降低(1分)
③(2分)
(3)阳(1分) (2分)
(2分) (1分)
山东省东营市2022-2023学年高一化学下学期期末考试试题(Word版附答案): 这是一份山东省东营市2022-2023学年高一化学下学期期末考试试题(Word版附答案),共11页。试卷主要包含了 考试结束后,将答题卡交回, 下列说法正确的是,5mlL · !等内容,欢迎下载使用。
山东省济宁市兖州区2022-2023学年高一化学下学期期中考试试题(Word版附答案): 这是一份山东省济宁市兖州区2022-2023学年高一化学下学期期中考试试题(Word版附答案),共10页。试卷主要包含了04等内容,欢迎下载使用。
山东省枣庄市滕州市2022-2023学年高一化学下学期期中质量检测试题(Word版附答案): 这是一份山东省枣庄市滕州市2022-2023学年高一化学下学期期中质量检测试题(Word版附答案),共10页。试卷主要包含了04,化学电源应用广泛,90,对于反应,下列化学用语中书写正确的是等内容,欢迎下载使用。












