

新疆乌鲁木齐市名校2022-2023学年高二下学期期中考试化学试题(Word版含答案)
展开乌鲁木齐市名校2022-2023学年高二下学期期中考试
化学问卷
考试时间:100分钟 卷面分值:100分
(命题范围:选择性必修二全部、选择性必修三第一章、第二章第一节)
一、选择题(本题共21小题,每小题2分,共42分;每小题只有一个选项符合题意)
1.氰气在催化剂作用下水解生成尿素.设为阿伏加德罗常数的值.下列叙述错误的是( )
A.是直线形分子
B.中含键的总数为
C.中所有元素都位于元素周期表的p区
D.中N、O、C的第一电离能依次减小
2.在系统命名法中下列碳原子主链名称是丁烷的是( )
A. B.
C. D.
3.下列说法正确的是( )
A.中的夹角与中的夹角都为
B.、都是由极性键构成的非极性分子
C.基态溴原子核外电子排布式为
D.F、Cl、Br、I的单质的晶体类型不同
4.下列说法正确的是( )
A.2p和3p的轨道形状、能量均相同 B.有规则几何外形的固体一定是晶体
C.中所有的原子都在同一个平面上 D.含极性键的分子一定是极性分子
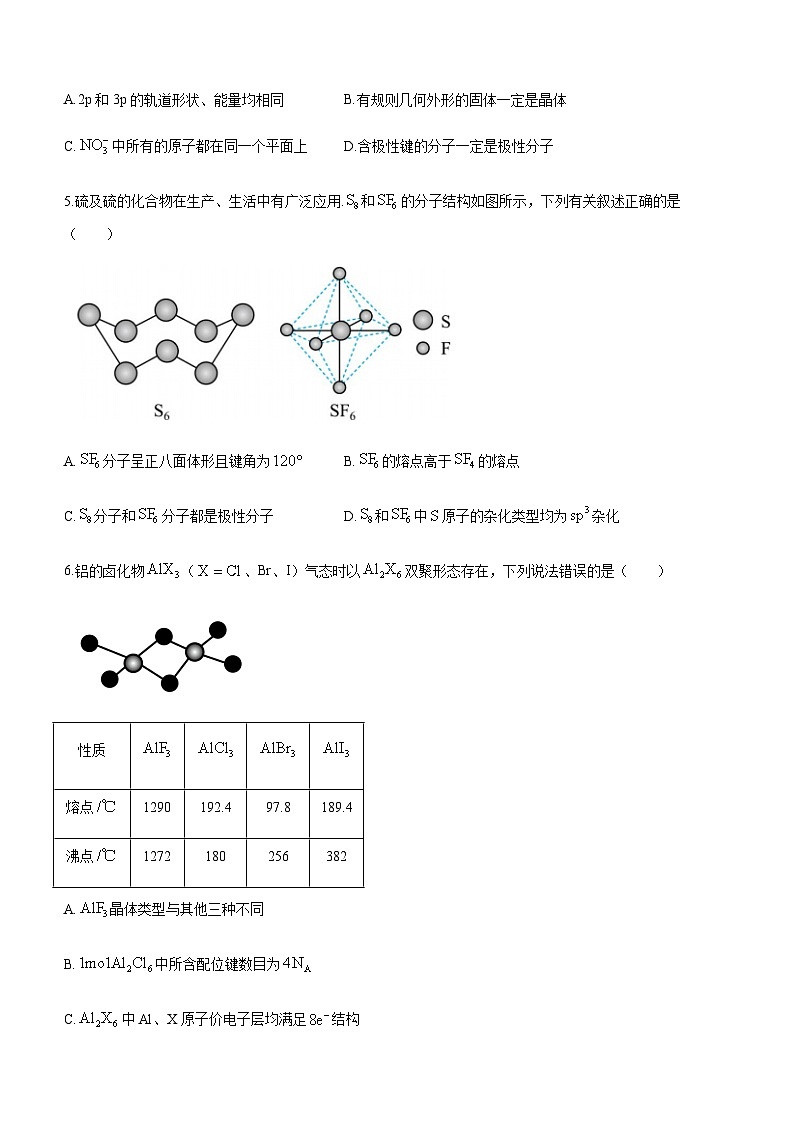
5.硫及硫的化合物在生产、生活中有广泛应用.和的分子结构如图所示,下列有关叙述正确的是( )
A.分子呈正八面体形且键角为 B.的熔点高于的熔点
C.分子和分子都是极性分子 D.和中原子的杂化类型均为杂化
6.铝的卤化物(、Br、I)气态时以双聚形态存在,下列说法错误的是( )
性质 | ||||
熔点 | 1290 | 192.4 | 97.8 | 189.4 |
沸点 | 1272 | 180 | 256 | 382 |
A.晶体类型与其他三种不同
B.中所含配位键数目为
C.中Al、X原子价电子层均满足结构
D.熔点高于原因是的电负性大于,具有一定离子晶体特征
7.反应可用于海水提取溴.下列有关说法正确的是( )
A.是直线形分子 B.基态O原子的轨道表示式为
C.HBr的电子式为 D.分子中含有6个键
8.下列化学事实可以说明“苯分子结构中不存在碳碳单键和碳碳双键交替结构”的是( )
①苯不能使溴水或高锰酸钾酸性溶液褪色②邻二甲苯只有一种结构③苯在一定条件下既能发生取代反应,又能发生加成反应④苯环上碳原子之间的键都相同
A.①④ B.①②④ C.①③④ D.①②③④
9.某元素的基态原子最外层电子排布式是,该元素或其化合物不可能具有的性质是( )
A.该元素单质是导体
B.该元素单质在一定条件下能与盐酸反应
C.该元素最高价氧化物对应的水化物显碱性
D.该元素的最高化合价为+5
10.下列关于共价晶体、分子晶体的叙述中,正确的是( )
A.在晶体中,1个硅原子和2个氧原子形成2个共价键
B.分子晶体中一定存在共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.金刚石为共价键三维骨架结构,晶体中的最小环上有6个碳原子
11.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,其晶胞结构如图所示.下列有关说法正确的是( )
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键具有方向性和饱和性,也是键的一种
D.冰变成水,氢键部分被破坏
12.短周期主族元素R、X、Y、Z、W的原子序数依次增大,由这五种元素组成的一种化合物M常用作食品的增味剂,M的结构式如图所示.下列说法正确的是( )
A.原子半径:
熔点:
C.由R、Y、Z三种元素形成的化合物均为共价化合物
D.工业上采用电解熔融的制备W单质
13.下列说法错误的是( )
A.基态铬原子的电子排布式为
B.晶体中存在配位键
C.所有元素中,氟的第一电离能最大
D.光气分子中,所有原子均满足8电子稳定结构
14.下列有机物的系统命名中正确的是( )
A.3-甲基-4-乙基戊烷 B.3,3,4-三甲基己烷
C.3,4,4-三甲基己烷 D.3,5-二甲基己烷
15.下列关于键和键的说法中,错误的是( )
A.键的电子云图形是轴对称的,键的电子云图形是镜面对称的
B.键是原子轨道“头碰头”式重叠,键是原子轨道“肩并肩”式重叠
C.两个p轨道不能形成键,只能形成键
D.H只能形成键,O可以形成键和键
16.2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子.X、Y、Z、M均为短周期元素,且均不在同一族.下列说法不正确的是( )
A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.中不含有非极性共价键
C.Y氢化物的稳定性一定比Z的强
D.在该盐中,存在极性共价键和非极性共价键
17.我国中医古籍《玉楸药解》中记载:“胆矾味酸,性寒,入手太阴肺经.降逆止嗽,消肿化积.”胆矾可写为,其结构示意图为:
下列有关说法正确的是( )
A.基态的价层电子排布式为
B.硫原子采取杂化,其价层电子对数为3
C.胆矾中微粒间作用力包括离子键、极性键、配位键和氢键
D.电负性:
18.下列关于聚集状态的叙述中,错误的是( )
A.物质只有气、液、固三种聚集状态
B.气态是高度无序的体系存在状态
C.固态中的原子或者分子结合的较紧凑,相对运动较弱
D.液态物质的微粒间距离和作用力的强弱介于固、气两态之间,表现出明显的流动性
19.下列关于晶体的说法中,不正确的是( )
A.晶体中原子呈周期性有序排列,有自范性
B.含有金属阳离子的晶体一定是离子晶体
C.干冰是分子晶体,在熔化时,破坏的只是分子间作用力
D.金属晶体的导电率随温度升高而降低
20.下列说法中正确的是( )
①晶体中分子间作用力越大分子越稳定②共价晶体中共价键越强,熔点越高③干冰是分子通过氢键和分子间作用力有规则排列成的分子晶体④在和晶体中,阴、阳离子数之比相等⑤正四面体形的分子,其晶体类型可能是共价晶体或分子晶体⑥分子晶体中都含有化学键⑦含4.8g碳元素的金刚石晶体中共价键的物质的量为0.8mol
A.①②③④⑤ B.②④⑦ C.②④⑥⑦ D.③④⑤⑥⑦
21.如图所示是硼和镁形成的化合物的晶体结构单元,镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为( )
A. B. C. D.
二、非选择题(本题包括4小题,共58分)
22.(18分)A、B、C、D、E是五种原子序数依次增大的前四周期元素.A、B、C是位于p区的同一周期的元素,C的价层电子排布式为,A与C原子核外的未成对电子数相等;与互为等电子体;E为过渡元素,其原子核外没有未成对电子.请回答下列问题:
(1)E在周期表中的位置为__________,E元素的价层电子排布图为_________,与E同区、同周期元素原子的价层电子排布式是___________.ED晶胞类似金刚石,其晶胞中最小环中有___________个原子共面.
(2)A、B、C均可与氢元素形成氢化物,它们的简单氢化物稳定性由强到弱的顺序为___________(用分子式表示).
(3)A、B、C的简单氢化物中,键角由大到小的顺序为_____________(用分子式表示),其中B的简单氢化物的VSEPR模型为__________,C的简单氢化物的空间结构为__________.
(4)A、C两种元素能形成化合物,该分子的结构式为___________,中心原子的杂化轨道类型为_____________,根据电子云重叠方式的不同,分子中共价键的类型有____________.
(5)用电子式表示C的简单氢化物的形成过程_______________________;按要求写出分子的等电子体(分子、离子各写一种)_______________.分子中与键之比为___________.
23.(13分)(Ⅰ)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上.
(1)_________; (2)___________;
(3)_________; (4)_________;
(5)_________; (6)_________;
(7)_________; (8)_________;
(9)_________; (10)_________.
(Ⅱ)同位素、同素异形体、同分异构体和同系物是不同的概念,观察下面列出的几种物质的化学式或者结构式,然后回答问题
①②③④⑤⑥⑦
⑧⑨
其中,(1)互为同分异构体的是_________(填序号,下同);(2)互为同系物的是___________;(3)实际上是同种物质的是________________.
24.(15分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;离子核外有3层电子且M层3d轨道电子全充满.请回答下列问题:
(1)E元素基态原子的电子排布式为_____________.
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因是_____________________________________________________.
(3)D元素与氟元素相比,电负性:D_________(填“>”“=”或“<”)F,下列表述中能证明这一事实的是_____________(填选项序号).
A.常温下氟气的颜色比D单质的颜色深 B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态 D.比较两元素的单质与氢气化合时得电子的数目
(4)由A、C两元素可形成化合物含有的化学键类型为_____________.
(5)是重要的石油化工原料,的结构式为__________.通过聚合反应可以生成一种有机高分子化合物,反应方程式为__________________________.
(6)分子的电子式为__________,在酸性溶液中与反应的离子方程式为______________.
25.(12分)近日,比亚迪宣布推出基于磷酸铁锂技术的“刀片电池”,刀片电池能量密度大,安全性高.电池的正极活性材料是.
(1)铁元素位于周期表___________;基态的电子排布式为____________.
(2)正极材料的阴离子的空间构型为___________,磷原子采取的杂化方式为_________.
(3)Fe 原子或离子外围有较多能量相近的空轨道,能与、、等形成配合物.的结构简式如下图所示,其结构中键和键的个数比为__________,中含有的化学键类型是____________.(填字母).
a.极性共价键 b.离子键 c.配位键 d.金属键
(4)硼酸是一种片层状结构的白色晶体,层内的分子间通过氢键相连(如上图).
①硼酸分子中B最外层有___________个电子,的晶体中有___________mol氢键.②硼酸溶于水生成弱电解质一水合硼酸,它电离生成少量和,则硼酸为___________元酸,含有的化学键类型为_____________.
(5)的、、分别为、、,硝酸完全电离,而亚硝酸,请根据结构与性质的关系解释:①的远大于的原因___________________;②硝酸比亚硝酸酸性强的原因_______________________________________.
乌鲁木齐市名校2022-2023学年高二下学期期中考试
化学答案
(命题范围:选择性必修二全部、选择性必修三第一章、第二章第一节)
一、选择题(本题共21小题,每小题2分,共42分;每小题只有一个选项符合题意)
1.C 2.D 3.B 4.C 5.B 6.B 7.D 8.B 9.D 10.D
11.D 12.A 13.C 14.B 15.C 16.C 17.C 18.A 19.B 20.B 21.B
二、非选择题(本题包括4小题,共58分)
22.(18分)(1)第四周期第ⅡB族;略;;4.(2);(3);
四面体形;形;(4);;键、键
(5);、(正确即给分);.
23.(13分)
(Ⅰ)(1)醇;(2)炔;
(3)烃或芳香烃;(4)酯;
(5)卤代烃;(6)烯;
(7)羧酸或芳香酸;(8)醛.
(9)酚;(10)醚.
(Ⅱ)①②;(2)③④;(3)⑧⑨.
24.(1)或;(2);同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但氮元素的外层电子达到半充满的稳定构型,其第一电离能大于氧元素;
(3)<;BC;(4)离子键、共价键或;(5);
(6)
25.(12分)(1)第四周期Ⅷ族;(2)正四面体形;(3)3:2;ac
(4)①6;3;②一;共价键、配位键(或极性共价键、配位键);
(5)第一步电离出的氢离子抑制第二步的电离;硝酸中N呈正5价,中O的电子更向N偏移,更容易电离出氢离子
新疆乌鲁木齐市六校联考2022-2023学年高二下学期期末化学试题含答案: 这是一份新疆乌鲁木齐市六校联考2022-2023学年高二下学期期末化学试题含答案,共25页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
新疆乌鲁木齐市名校2023-2024学年高二上学期第一次月考化学试题(含答案): 这是一份新疆乌鲁木齐市名校2023-2024学年高二上学期第一次月考化学试题(含答案),共10页。试卷主要包含了单项选择题,填空题等内容,欢迎下载使用。
新疆乌鲁木齐市第六十一中学2022-2023学年高二下学期期中考试化学试题: 这是一份新疆乌鲁木齐市第六十一中学2022-2023学年高二下学期期中考试化学试题,共4页。












