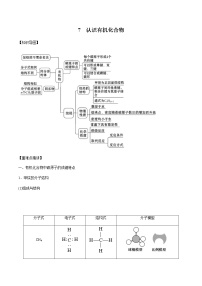
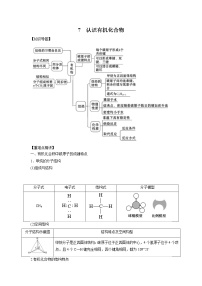
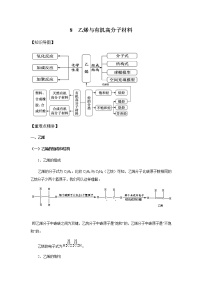
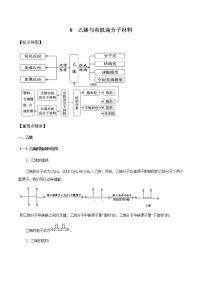
高中化学人教版 (2019)必修 第二册第二节 乙烯与有机高分子材料精品测试题
展开【重难点精讲】
一、乙烯
(一)乙烯的组成和结构
1、乙烯的组成
乙烯的分子式为C2H4。比较C2H4与C2H6(乙烷)可知,乙烯分子比碳原子数相同的乙烷分子少两个氢原子,我们可以这样理解:
即乙烯分子中碳碳之间为双键,乙烷分子中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
乙烯的电子式为。
2、乙烯的结构
注:其分子中的2个碳原子和4个氢原子都处在同一平面上,它们彼此之间的键角为120°,空间结构为。
(二)乙烯的性质
1、乙烯的物理性质
乙烯是无色、稍有气味的气体,标准状况下的密度为1.25g·L-1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、乙烯的化学性质
与只含碳碳单键的烷烃相比,乙烯分子中因碳碳双键的存在而表现出较活泼的化学性质。
实验探究:
装置:
实验步骤与现象:
注:a.碎瓷片起催化作用。b.高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。c.酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。d.酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应
①乙烯被酸性高锰酸钾溶液氧化
乙烯使酸性高锰酸钾溶液褪色的实质是乙烯被酸性高锰酸钾溶液氧化。
注:利用乙烯被酸性高锰酸钾氧化的反应可用于鉴别甲烷和乙烯,但不能除去甲烷中的乙烯,原因是发生反应的化学方程式为:5CH2=CH2+12KMnO4+18H2SO410CO2↑+6K2SO4+12MnSO4+28H2O,氧化后产物中有CO2,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧
乙烯在空气中燃烧,火焰明亮并伴有黑烟,生成二氧化碳和水,同时放出大量的热。
C2H4 + 3O2 2CO2 +2H2O
注:a.产生黑烟是由于乙烯分子中含碳量比较高,燃烧时有一部分碳并没有完全被氧化,碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态以黑烟的形式冒出。
b.乙烯属于易燃易爆的气体(爆炸极限为2.7%~36%),在点燃乙烯之前一定要先检验乙烯的纯度。
(2)加成反应
①定义
加成反应:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫加成反应。
注:加成反应和取代反应是最重要的两大有机反应类型,二者有本质的区别。取代反应的特点是有进有出,类似置换;加成反应的特点是有进无出,类似化合。取代反应是烷烃的特征反应,断裂的是C-H键;加成反应是不饱和烃的特征反应,是不饱和键中的不稳定键断裂。
②乙烯能发生加成反应
乙烯能使溴的CCl4溶液的红棕色很快褪去,也能使溴水的橙色很快褪去,生成无色的1,2—二溴乙烷。反应的方程式如下:
该反应的原理是乙烯分子中碳碳双键中的一个键易于断裂,断开之后每个碳原子就有一个未成对的电子,而Br2分子中Br-Br键断开后形成两个带一个未成对电子的溴原子,两个溴原子分别与两个碳原子结合形成共价键。此反应的过程可表示为:
乙烯还能跟氢气、卤化氢、水以及氯气等在适宜条件下起加成反应。
注:1.乙烯加成反应小结:
2.有关乙烯的注意事项:
a.乙烯分子中的单键可以转动,碳碳双键不能转动,所以碳碳双键上的原子始终在一个平面上。
b.当乙烯与Br2反应时,一般用溴水或溴的四氯化碳溶液(甲烷需要在光照条件下与溴蒸气反应)。
c.利用乙烯能使溴水褪色而甲烷(或烷烃)不能使溴水褪色,既可以区别乙烯和甲烷(或烷烃),也可以除去甲烷(或烷烃)中混有的少量乙烯以提纯甲烷(或烷烃)。
d.为制得纯净的氯乙烷,应用乙烯与HCl的加成反应而不宜用乙烷与Cl2的取代反应。因为乙烯与HCl的加成产物只有一种,而乙烷与Cl2的取代产物是多种氯代烷的混合物。
e.通常条件下,烯烃一般不和水反应(可用排水法收集乙烯),但在一定条件下烯烃可以和水反应生成醇(工业上采用水化法制乙醇的原理)。
f.乙烯(或烯烃)发生加成反应后,空间结构发生了变化。
g.乙烯之间的相互加成可以得到聚乙烯,反应方程式为。
(三)乙烯的用途
(1)重要的化工原料,用来制聚乙烯塑料、聚乙烯纤维、乙醇等有机溶剂。
(2)在农业生产中用作植物生长调节剂和果实催熟剂。
(3)乙烯的产量可以用来衡量一个国家的石油化工发展水平。
(四)乙烯的实验室制法
1、药品:乙醇、浓硫酸
2、反应原理:CH3CH2OHCH2=CH2↑+H2O
3、装置:液—液加热,如图:
4、收集方法:排水集气法
注意:(1)浓硫酸的作用:催化剂和脱水剂。
(2)温度计的位置:插入反应液中但不能触及烧瓶底部,目的在于控制反应液的温度在170℃,避免发生副反应.
(3)加入碎瓷片是为了防止液体暴沸。
(4)点燃乙烯前要验纯。
(5)反应液变黑是因浓硫酸使乙醇脱水碳化,碳把硫酸还原为SO2 ,故乙烯中混有SO2 。
C + 2H2SO4(浓)== CO2↑+ 2SO2↑+ 2H2O
二、烃
1.烃的概念
仅含碳和氢两种元素的有机化合物称为碳氢化合物,也称为烃。
2.烃的分类
依据:烃分子中碳原子间成键方式的不同及碳骨架的不同
3.常见烃分子结构及性质比较
注意:对烃分类时要抓住烃中碳原子的价键特点和碳骨架的形状,结合各类烃的有关概念即能正确分类。
4、芳香族化合物与苯
(1)芳香族化合物:分子中含有苯环的有机物。
(2)苯的组成与结构
其中,苯环中的碳碳之间的键是一种介于碳碳单键和碳碳双键之间的独特的键,苯分子中6个碳原子和6个氢原子都在同一平面内。
(3)苯的用途:苯是一种重要的有机化工原料和有机溶剂,广泛用于生产医药、农药、香料、染料、洗涤剂和合成高分子材料等。
三、有机高分子材料
1.有机高分子材料的分类
根据来源不同可将有机高分子材料分为天然有机高分子材料和合成有机高分子材料。
(1)天然有机高分子材料:如棉花、羊毛、天然橡胶等。
(2)合成有机高分子材料:如塑料、合成纤维、合成橡胶、黏合剂、涂料等。
2.三大合成高分子材料——塑料、橡胶和纤维
(1)塑料
①成分
②主要性能
塑料具有强度在、密度小、耐腐蚀,易加工等优良的性能。
③常用塑料用途
(2)橡胶
①天然橡胶主要成分是聚异戊二烯,结构简式。
②橡胶的结构
注:硫化橡胶:工业上用硫与橡胶作用进行硫化,使线型的高分子链之间通过硫原子形成化学键,产生交联,形成网状结构,从而提高强度、韧性和化学稳定性。
③常见合成橡胶有丁苯橡胶,顺丁橡胶,氯丁橡胶,还有氟橡胶、硅橡胶等特种橡胶。其中氟橡胶、硅橡胶又称为特种橡胶,氟橡胶耐热和耐酸、碱腐蚀;硅橡胶耐高温和严寒。
④主要用途:制造汽车、飞机轮胎和各种密封材料所必需的原料。特种橡胶在航空、航天和国防等尖端技术领域中发挥着重要作用。
(3)纤维
①分类:纤维可以分为天然纤维和化学纤维
A.天然纤维:棉花、羊毛 、 蚕丝和麻等
B.化学纤维:又可分为再生纤维和合成纤维,再生纤维是将农林产品中的纤维素、蛋白质等加工处理制成的,如黏胶纤维、大豆蛋白纤维;合成纤维是以石油、天然气和煤等为原料制成有机小分子单体,再经聚合反应制成,如“六大纶”:聚丙烯纤维(丙纶)、聚氯乙烯纤维(氯纶)、聚丙烯腈纤维(腈纶)、聚对苯二甲酸乙二酯纤维(涤纶)、聚酰胺纤维(锦纶、芳纶)等。
②合成纤维性能:强度高、弹性好、耐磨、耐化学腐蚀、不易虫蛀等。
③主要用途:制衣料、绳索、渔网、工业用滤布,飞机、船舶的结构材料等,广泛应用于工农业领域。
注意:(1)有机高分子材料中,塑料都是合成的,橡胶与纤维都既有天然的也有人工合成的。
(2)以煤、石油和天然气为原料制成的三大合成材料,可用于生产和生活的各个领域。
(3)高分子材料均为混合物,其聚合度无定值;通过聚合反应可利用小分子物质合成有机高分子材料。
四.合成有机高分子材料的反应
(一)加聚反应
1. 概念:不饱和单体间通过加成反应相互结合生成高分子化合物的反应。
2. 特征:①没有小分子的副产物生成;②所生成的高分子的式量是单体的整数倍;③高分子与单体具有相同的元素质量组成;④通过共价键结合,具有特定的结构,因此化学组成并不复杂。
3. 单体的结构条件:含有双键、三键或环状结构的低分子在一定条件下可发生加聚反应, 单体中常含有“C=C”“C≡C”“”等结构。
4. 加聚产物结构简式的书写:将链节写在方括号内,聚合度n在方括号的右下角。由于加聚产物的端基不确定,通常用“-”表示。
①含一个碳碳双键的单体聚合物的写法:断开双键,键分两端,添上括号,n在后面。
②含“C=C—C=C”的单体聚合物的写法:双变单,单变双,括住两头,n在后面。
③含有一个碳碳双键的两个单体聚合物的写法:双键打开,彼此相连,括住两头,n在后面。
(二)缩聚反应
1. 概念:单体分子间脱去小分子而相互结合生成高分子化合物的反应。
2. 特征:①反应中总是伴有小分子(如H2O、HCl、NH3)副产物的生成;②单体和聚合物的组成不同;③单体不一定含有不饱和键,但必须含有两个或两个以上的反应基团(如:-OH、-COOH、-NH2、-X等)。
3. 缩聚产物结构简式及缩聚反应方程式的书写:
①缩合聚合物(简称缩聚物)结构简式的书写要在括号外侧写出链节余下的端基原子或原子团。如:
②单体的物质的量与缩聚物的结构式中的小角标要一致。
③小分子的物质的量的确定:一般由一种单体进行缩聚时生成小分子的物质的量为(n-1);由两种单体进行缩聚时生成小分子的物质的量为(2n-1)。
五、由聚合物推单体的方法
1.加聚物
【规律方法】(1)①由加聚高聚物推单体是聚合反应的逆过程,方法是:高聚物链节半键还原→双键重现→正推验证。
②在上述过程中,若半键还原无法形成完整双键,可考虑再断裂单键构成完整双键(不是一种单体)或断裂双键构成完整双键(二烯烃)。
例如:①凡链节的主链只有两个碳原子(无其他原子)的高聚物,其合成单体必为一种,将两个半键闭合即可。
如: ,其单体是。
②凡链节主链有四个碳原子(无其他原子),且链节无双键的高聚物,其单体必为两种,在正中央划线断开,然后两个半键闭合即可。
如:的单体为和两种。
③凡链节主键中只有碳原子,并存在结构的高聚物,其规律是:“凡双键,四个碳;无双键,两个碳”划线断开,然后将半键闭合即单双键互换。
如:的单体是:
,的单体是:
和。
(2)缩聚物
【规律方法】由缩聚高聚物的类型找单体
①凡链节为结构的高聚物,其合成单体必为一种。在亚氨基上加氢,在羰基碳上加羟基,即得高聚物单体。如:的单体为:。
②凡链节中间(不在端上)含有肽键的高聚物,从肽键中间断开,两侧为不对称性结构的,其单体必为两种:在亚氨基上加氢,羰基碳上加羟基即得高聚物单体。
如:的单体为:和。
③凡链节中间(不在端上)含有(酯基)结构的高聚物,其合成单体必为两种,从中间断开,羰基端加羟基,氧原子上加氢原子即得高聚物单体。
如:单体为:和。
④高聚物其链节中的来自于甲醛,故合成单体为和。
【技巧点拨】1.对于缩聚物结构简式的写法可有两种,例如聚己二酸己二酯可写为:(在方括号外侧写出链节余下的端基原子或原子团),或者是写为。
2.由一种单体进行缩聚反应时,生成小分子物质的量应为n;由两种单体进行缩聚反应时,生成小分子物质的量应为2n。
例如:
【特别提醒】找单体时,一定要先判断是加聚产物还是缩聚产物,然后运用逆向思维反推单体,找准分离处,聚合时的结合点必为分离处,同时进行单体判断时,不要被书写方式迷惑,要注意单键可以旋转。
随堂练习:
一、选择题
1.①②是两种常见烃的球棍模型,则下列叙述正确的是( )
A.都能在空气中燃烧
B.都能使酸性高锰酸钾溶液褪色
C.都能发生加成反应
D.等质量的①②完全燃烧时,产生CO2的量相同
2.下列各组物质之间可以发生化学反应,其反应产物一定为纯净物的是( )
A.CH3—CH===CH—CH3与Br2反应
B.CH2===CH—CH2—CH3与HCl在催化剂、加热条件下反应
C.CH3—CH===CH2与H2O在催化剂、加热、加压条件下反应
D.CH3CH3与Cl2在光照条件下反应
3.下列分子中的各原子均在同一平面上的是( )
A.C2H3ClB.CH3Cl
C.CH3CH2CH===CH2D.CH3—CH2—CH3
4.下列物质不能使溴水褪色的是( )
A.CH2===CH2B.SO2
C.CH2===CHCH2CH3 D.CH3CH2CH3
5.按碳的骨架分类,下列说法正确的是( )
6.下列各反应中属于加成反应的是( )
①CH2CH2+H2Oeq \(――→,\s\up17(一定条件))CH3CH2OH
②H2+Cl2eq \(=====,\s\up17(光))2HCl
④CH3CH3+2Cl2eq \(――→,\s\up17(光))CH2ClCH2Cl+2HCl
A.①③B.②③
C.①④D.②③
7.下列有关聚乙烯的说法正确的是( )
A.聚乙烯是通过缩聚反应生成的
B.聚乙烯能使溴水褪色
C.聚乙烯可用于制作食品包装袋等薄膜制品
D.聚乙烯不易造成污染
8.下列说法正确的是( )
A.合成纤维和再生纤维统称为化学纤维
B.天然纤维是不能被加工处理的
C.涤纶燃烧时有烧焦羽毛的气味
D.合成纤维一般是通过缩聚反应制得的,如氯纶
加聚反应相关概念辨析
(1)三个相关概念:
(2)链节与单体的组成元素相同,但结构不同;单体是一种物质,而链节不是物质,不能单独存在。
(3)由单体写聚合物时,单体的主链不一定是链节的主链,如聚丙烯不能写成CH3CHCH2,应该是
,原来在主链中的—CH3变成了支链。
10.天然橡胶(也叫聚异戊二烯或聚2甲基1,3丁二烯)的单体为
A.氯丁橡胶中—X为—Cl,其单体为CH2===CHCl和CH2===CH2
B.顺丁橡胶中—X为—H,其单体为
CHCH2CHCH2
C.氯丁橡胶中—X为—Cl,其单体为
D.顺丁橡胶中—X为—H,其单体为
CH3—CH===CH—CH3
加聚产物单体的判断方法
二、非选择题
11.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OHeq \(――→,\s\up17(浓H2SO4),\s\d15(170 ℃))CH2===CH2↑+H2O),生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。
请回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是________。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是________,它与溴水反应的化学方程式是____________,在验证过程中必须全部除去。为此,乙同学设计了如图所示的实验装置:
请回答:Ⅰ、Ⅱ、Ⅲ装置中可盛放的试剂是:
Ⅰ________、Ⅱ________、Ⅲ________(填字母)。
A.品红溶液B.NaOH溶液
C.溴水D.酸性高锰酸钾溶液
(3)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是____________。
课后作业:
1.下列化合物中属于烃类的物质是( )
A.CH3CH2CH3 B.CH3—CH2—Br
C.KSCN D.CH3COOCH3
烃的衍生物
烃分子里的氢原子被其他原子或原子团所取代,这样衍生出的一系列化合物叫做烃的衍生物。如:CH3CH3、等为烃的衍生物。
2.下列一定属于不饱和烃的是( )
A.C2H4B.C4H8 C.C3H8D.C5H12
3.下列说法正确的是( )
4.下列关于乙炔的结构和性质的叙述中,既不同于乙烯,也不同于乙烷的是( )
A.存在不饱和键
B.不易发生取代反应,易发生加成反应
C.分子中的所有原子都处在同一条直线上
D.能使酸性KMnO4溶液褪色
5.下列属于天然有机高分子材料的是( )
①羊毛 ②合成纤维 ③棉花 ④涂料 ⑤塑料
⑥天然橡胶
A.①③⑤B.②④⑥ C.①⑤⑥D.①③⑥
6.航天科学家正在考虑用塑料飞船代替铝制飞船,进入太空探索。其依据是( )
A.塑料是一种高分子化合物,可以通过取代反应大量生产
B.塑料中加入加工助剂可得到性能比铝更优良的新型材料
C.塑料用途广泛,可从自然界中直接得到
D.塑料是有机物,不和强酸、强碱作用
7.橡胶属于重要的工业原料。它是一种有机高分子化合物,具有良好的弹性,但强度较差。为了增加某些橡胶制品的强度,加工时往往需进行硫化处理,即将橡胶原料与硫黄在一定条件下反应。橡胶制品硫化程度越高,强度越大,弹性越差。下列橡胶制品中,加工时硫化程度较高的是( )
A.橡皮筋 B.汽车外胎
C.普通气球D.医用乳胶手套
8.下列物质中属于合成纤维的是( )
A.黏胶纤维B.蚕丝
C.腈纶D.羊毛绒
再生纤维只是将天然纤维加工处理制得,不是合成高分子化合物;合成纤维是以石油、天然气和煤等为原料人工合成的高分子化合物。
9.下列有关聚氯乙烯的说法不正确的是( )
A.聚氯乙烯是合成高分子化合物
B.聚氯乙烯是由氯乙烯通过加聚反应制成的
C.聚氯乙烯塑料宜作食品包装材料
D.燃烧废旧聚氯乙烯塑料会对环境产生污染
10.聚四氟乙烯(CF2—CF2)是不粘锅涂覆物质的主要成分。下列关于聚四氟乙烯的说法,不正确的是( )
A.属于高分子化合物
B.单体是CF2===CF2
C.可由加聚反应得到
D.能使高锰酸钾酸性溶液褪色
11.如图表示4个碳原子相互结合的方式,小球表示碳原子,小棍表示化学键,碳原子剩余价键都与氢原子结合。
(1)图中属于烷烃的是________(填字母)。
(2)图中的有机化合物,碳原子与碳原子之间不仅可以形成碳碳单键,还可以形成________和________;不仅可以形成________,还可以形成碳环。
(3)图中互为同分异构体的是A与________(填字母,下同),B与________,D与________。
分子式
电子式
结构式
结构简式
分子模型
球棍模型
比例模型
C2H4
实验步骤
实验现象
将气体通入酸性高锰酸钾溶液中
溶液褪色
将气体通入溴的四氯化碳溶液中
溶液褪色
用排水法收集气体验纯后,点燃
火焰明亮,伴有黑烟
结论一:石蜡油分解产生了能使高锰酸钾溶液、溴的四氯化碳溶液褪色的气态产物,由此可知产物中含有与烷烃性质(烷烃不能使酸性高锰酸钾溶液褪色)不同的烃。
结论二:研究表明,石蜡油分解的产物主要是乙烯和烷烃的混合物。
类别
链状烷烃
链状单烯烃
链状单炔烃
代表物
CH4
CH2 = CH2
CH三CH
通式
CnH2n+2(n≥1)
CnH2n(n≥2)
CnH2n-2(n≥2)
结构特点
含碳碳双键
含碳碳三键
化学性质
取代反应
光照卤代
—
—
加成反应
—
与H2、X2、HX、H2O等发生加成反应
氧化反应
燃烧火焰较明亮
燃烧火焰明亮,伴有黑烟
燃烧火焰明亮,伴有浓烈黑烟
与KMnO4溶液不反应
使KMnO4溶液褪色
使KMnO4溶液褪色
加聚反应
—
能发生
能发生
鉴别
KMnO4溶液和溴水均不褪色
KMnO4溶液和溴水均褪色
分子式
结构式
结构简式
空间形状
C6H6
平面正六边形
主要成分
合成树脂
添加剂
增塑剂提高塑性
防老剂防止塑料老化
着色剂使塑料着色
名称
用途
聚乙烯
制成薄膜、用于食品、药物的包装材料
聚氯乙烯
制成薄膜、管道、日常用品、绝缘材料
聚苯乙烯
制成泡沫塑料、日常用品、绝缘材料
聚四氟乙烯
制成化工、医药等行业使用的耐腐蚀、耐高温、耐低温制品
聚丙烯
制成薄膜、管道、日常用品、包装材料等
有机玻璃(聚甲基丙烯酸甲酯)
制成飞机和汽车的风挡、光学仪器、医疗器械、广告牌等
脲醛塑料(电玉)
制电器开关,插座及日常用品等
高中第二节 乙烯与有机高分子材料优秀综合训练题: 这是一份高中第二节 乙烯与有机高分子材料优秀综合训练题,共21页。试卷主要包含了乙烯,加成反应与集合反应,乙炔,烃及其分类,有机高分子材料等内容,欢迎下载使用。
高中人教版 (2019)第二节 乙烯与有机高分子材料精品一课一练: 这是一份高中人教版 (2019)第二节 乙烯与有机高分子材料精品一课一练,共21页。试卷主要包含了加成反应与聚合反应,乙炔,烃及其分类,有机高分子材料等内容,欢迎下载使用。
化学必修 第二册第一节 认识有机化合物课堂检测: 这是一份化学必修 第二册第一节 认识有机化合物课堂检测,文件包含高中化学新版必修二第07讲认识有机物教师提升版docx、高中化学新版必修二第07讲认识有机物学生提升版docx等2份试卷配套教学资源,其中试卷共43页, 欢迎下载使用。