






人教版 (2019)选择性必修2第三节 分子结构与物质的性质精品习题ppt课件
展开学习目标 CONTENT
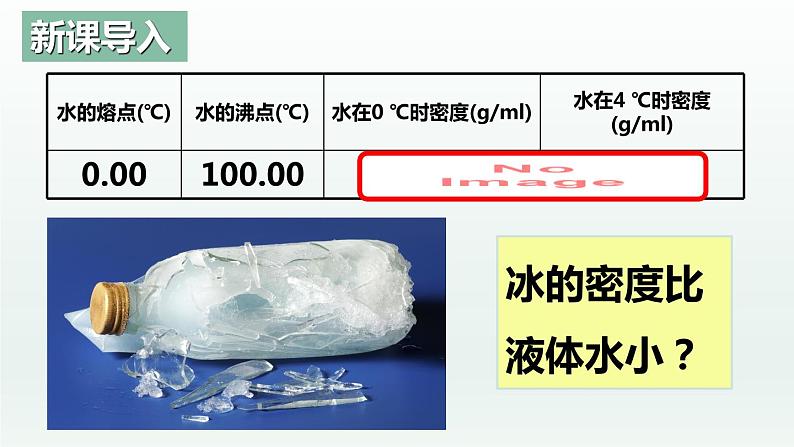
一般:同一主族非金属氢化物,从上到下,Mr逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么?
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他分子间作用力—氢键.
在水分子的O-H中,共用电子对强烈的偏向O,使得H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中相对显负电性的O的孤电子对产生静电作用,这种静电作用就是氢键。
1.定义:它是由已经与电负性很大的原子(如N、F、O)形成共价键的 氢原子与另一分子中电负性很大的原子之间的作用力.
2.表示: 氢键通常用X—H…Y —表示,“—”表示共价键,“…”表示形成的氢键(X、Y为N、O、F)如
无内层电子,几乎成为“裸露”的质子
氢键具有方向性和饱和性
①要有与电负性很大的原子X以共价键结合的氢原子;②要有电负性很大且含有孤电子对的原子Y;③X与Y的原子半径要小。
氢键不属于化学键,是一种特殊的分子间作用力。氢键键能较小,约为共价键的十分之几,但比范德华力 强;氢键具有一定的饱和 性和方向性。
(2)方向性:A—H与B形成分子间氢键时,3个原子总是尽可能沿直线分布,使A,B尽量远离,这样电子云排斥作用最小,体系能量最低,氢键最强,最稳定,所以氢键具有方向。
(1)饱和性:由于H原子半径比A,B的原子半径小得多,当H与一个B原子形成氢键A—H···B 后,H周围的空间被占据,A,B的电子云排斥作用将阻碍另一个B原子与H靠近成键,即H只能与一个B形成氢键,氢键具有饱和性。H 的体积小,1 个 H 只能形成1个氢键
氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。
如:HF、H2O、NH3 相互之间
C2H5OH、CH3COOH、H2O相互之间
(2)分子内氢键 某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构.
邻羟基苯甲醛(熔点-7 ℃)
对羟基苯甲醛(熔点115 ℃)
解释为什么邻羟基苯甲醛和对羟基苯甲醛熔、沸点不同?请将氢键表示出来说明。
①存在分子间氢键的物质一般具有较高的熔、沸点。
②存在分子内氢键使物质熔、沸点降低。
邻羟基苯甲醛的沸点低于对羟基苯甲醛
1.[2020·浙江7月选考,26(3)]常温下,在水中的溶解度乙醇大于氯乙烷,原因是_______________________________________________。
乙醇与水形成分子间氢键而氯乙烷不能与水形成氢键
2.[2020·浙江1月选考,26(3)]在常压下,甲醇的沸点(65 ℃)比甲醛的沸点(-19 ℃)高。主要原因是 ___________________。
3.[2017·全国卷Ⅲ,35(3)]在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,所涉及的4种物质中,沸点从高到低的顺序为 _______________________,原因是________________________________________________________________________________________________________________。
H2O>CH3OH>CO2>H2
H2O与CH3OH均为极性分子,水分子间含氢键比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力较大
4.[2019·全国卷Ⅱ,35(1)]元素As与N同族。预测As的氢化物分子的空间结构为__________,其沸点比NH3的____(填“高”或“低”),其判断理由是___________________。5.[2019·全国卷Ⅲ,35(3)节选]苯胺与甲苯( ) 的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是 ______________________。
氢键的存在迫使在四面体中心的水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水小。
范德华力、氢键、共价键对物质性质的影响
1.氢键的形成都会使物质的熔、沸点升高。 ( )2.氢键是一种特殊的化学键,它广泛存在于自然界中的物质中。( )3.HF的沸点较高,是因为H—F键的键能很大。( )
1.判断正误(正确的打“√”,错误的打“×”)
2.关于氢键的下列说法正确的是( )A.每个水分子内含有两个氢键B.在水蒸气、水和冰中都含有氢键C.分子间形成氢键能使物质的熔点和沸点升高D.HF的稳定性很强,是因为其分子间能形成氢键
3.铁氧体也可使用沉淀法制备,制备时常加入氨(NH3)、联氨(N2H4)等,已知氨(熔点:-77.8 ℃、沸点:-33.5 ℃),联氨(熔点:2 ℃、沸点:113.5 ℃),解释其熔、沸点高低的主要原因:________________________________________________。
数目多于氨分子间形成的氢键
4.HOOC—COOH与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101 ℃、-7.9 ℃,导致这种差异的最主要原因可能是 __________________________。
草酸分子间能形成更多氢键
5.数十亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
用上表中所涉及的分子填写下列空白:(1)含有10个电子的分子有 _____________________(填化学式,下同)。
H2O、Ne、CH4、NH3
(2)由极性键构成的非极性分子有 ___________。
(3)沸点最高的物质是________,用所学知识解释其沸点最高的原因:_______________________________________________。
水分子间存在氢键,使分子间作用力增大,沸点升高
6.回答下列问题(1)尿素[CO(NH2)2]易溶于水,其原因除尿素和水都是极性分子外,还有__________________________。(2)已知A、B的结构如下:
A的熔、沸点高于B的原因为_________________。
尿素与水分子之间可以形成氢键
(3)已知邻羟基苯胺的结构为 ,邻羟基苯胺的沸点 ______对羟基苯胺的沸点(填“低于” “高于”或“不确定”);其原因是:__________________________________________________________________________________________________________________________________________________。
邻羟基苯胺容易形成分子内氢键,沸点降低,对羟基苯胺容易形成分子间氢键,沸点升高,因此邻羟基苯胺的沸点低于对羟基苯胺的沸点
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质习题课件ppt: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002448_t3/?tag_id=26" target="_blank">第三节 分子结构与物质的性质习题课件ppt</a>,文件包含235分子结构与物质的性质第5课时溶解度手性课件精讲-名课堂精选2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2pptx、碘的溶解性mp4等2份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质习题ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002448_t3/?tag_id=26" target="_blank">第三节 分子结构与物质的性质习题ppt课件</a>,文件包含235分子结构与物质的性质第5课时溶解度手性习题精练-2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2原卷版docx、235分子结构与物质的性质第5课时溶解度手性习题精练-2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学第二章 分子结构与性质第三节 分子结构与物质的性质习题ppt课件: 这是一份高中化学<a href="/hx/tb_c4002448_t3/?tag_id=26" target="_blank">第二章 分子结构与性质第三节 分子结构与物质的性质习题ppt课件</a>,文件包含233分子结构与物质的性质第3课时范德华力及其对物质性质的影响课件精讲-名课堂精选2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2pptx、加热过程中物质的状态变化的微观模拟过程mp4等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。













