甘肃各地区2022年中考化学模拟试题汇编-计算题
展开一、计算题
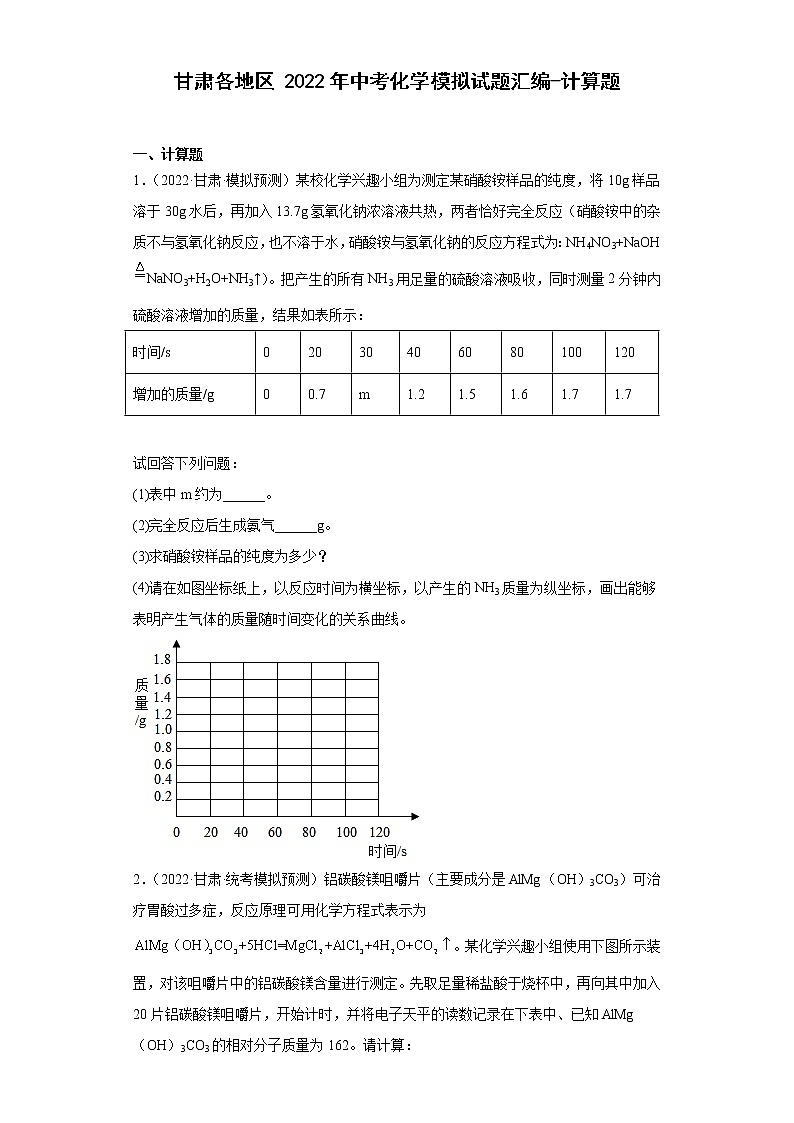
1.(2022·甘肃·模拟预测)某校化学兴趣小组为测定某硝酸铵样品的纯度,将10g样品溶于30g水后,再加入13.7g氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠的反应方程式为:NH4NO3+NaOHNaNO3+H2O+NH3↑)。把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质量,结果如表所示:
试回答下列问题:
(1)表中m约为______。
(2)完全反应后生成氨气______g。
(3)求硝酸铵样品的纯度为多少?
(4)请在如图坐标纸上,以反应时间为横坐标,以产生的NH3质量为纵坐标,画出能够表明产生气体的质量随时间变化的关系曲线。
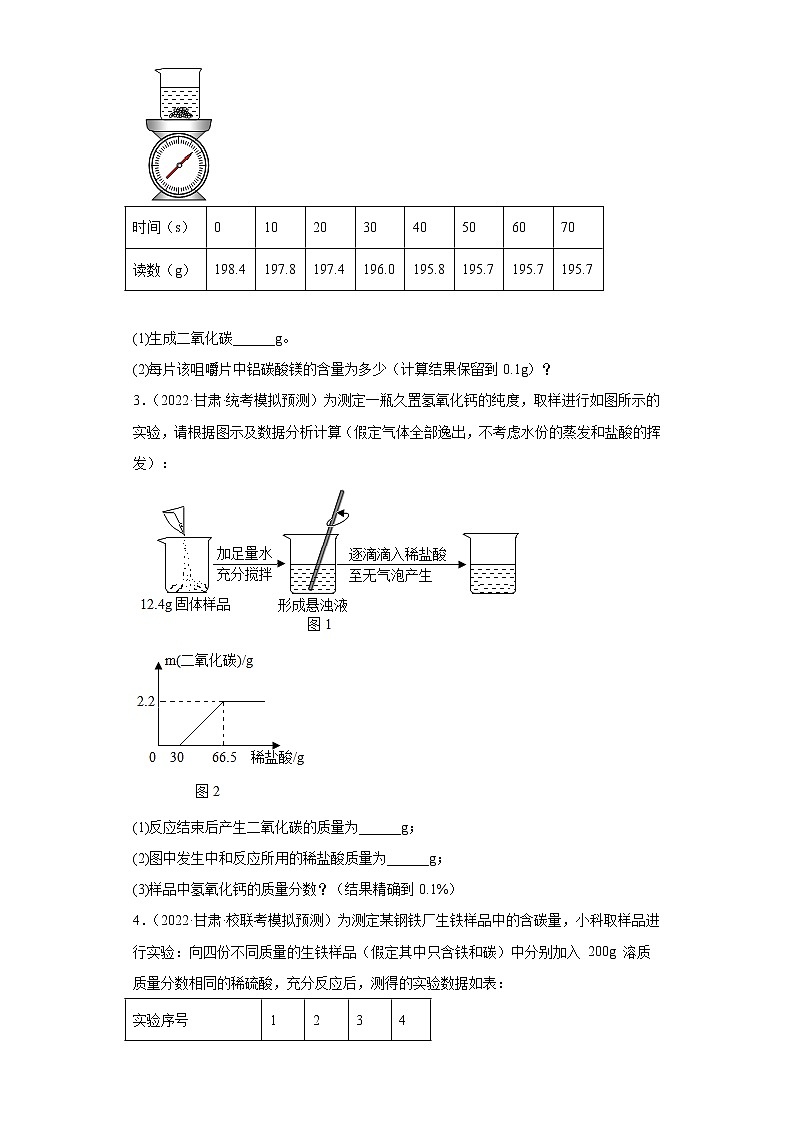
2.(2022·甘肃·统考模拟预测)铝碳酸镁咀嚼片(主要成分是AlMg(OH)3CO3)可治疗胃酸过多症,反应原理可用化学方程式表示为。某化学兴趣小组使用下图所示装置,对该咀嚼片中的铝碳酸镁含量进行测定。先取足量稀盐酸于烧杯中,再向其中加入20片铝碳酸镁咀嚼片,开始计时,并将电子天平的读数记录在下表中、已知AlMg(OH)3CO3的相对分子质量为162。请计算:
(1)生成二氧化碳______g。
(2)每片该咀嚼片中铝碳酸镁的含量为多少(计算结果保留到0.1g)?
3.(2022·甘肃·统考模拟预测)为测定一瓶久置氢氧化钙的纯度,取样进行如图所示的实验,请根据图示及数据分析计算(假定气体全部逸出,不考虑水份的蒸发和盐酸的挥发):
(1)反应结束后产生二氧化碳的质量为______g;
(2)图中发生中和反应所用的稀盐酸质量为______g;
(3)样品中氢氧化钙的质量分数?(结果精确到0.1%)
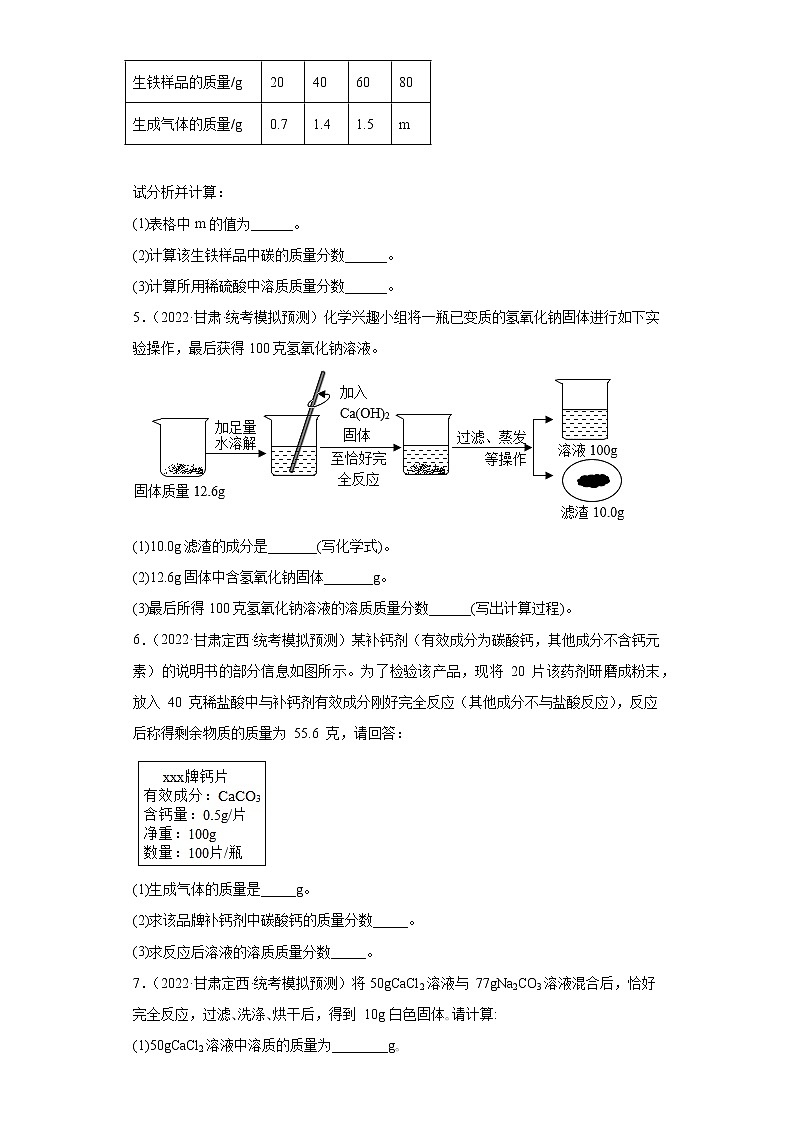
4.(2022·甘肃·校联考模拟预测)为测定某钢铁厂生铁样品中的含碳量,小科取样品进行实验:向四份不同质量的生铁样品(假定其中只含铁和碳)中分别加入 200g 溶质质量分数相同的稀硫酸,充分反应后,测得的实验数据如表:
试分析并计算:
(1)表格中m的值为______。
(2)计算该生铁样品中碳的质量分数______。
(3)计算所用稀硫酸中溶质质量分数______。
5.(2022·甘肃·统考模拟预测)化学兴趣小组将一瓶已变质的氢氧化钠固体进行如下实验操作,最后获得100克氢氧化钠溶液。
(1)10.0g滤渣的成分是_______(写化学式)。
(2)12.6g固体中含氢氧化钠固体_______g。
(3)最后所得100克氢氧化钠溶液的溶质质量分数______(写出计算过程)。
6.(2022·甘肃定西·统考模拟预测)某补钙剂(有效成分为碳酸钙,其他成分不含钙元素)的说明书的部分信息如图所示。为了检验该产品,现将 20 片该药剂研磨成粉末,放入 40 克稀盐酸中与补钙剂有效成分刚好完全反应(其他成分不与盐酸反应),反应后称得剩余物质的质量为 55.6 克,请回答:
(1)生成气体的质量是_____g。
(2)求该品牌补钙剂中碳酸钙的质量分数_____。
(3)求反应后溶液的溶质质量分数_____。
7.(2022·甘肃定西·统考模拟预测)将50gCaCl2溶液与 77gNa2CO3溶液混合后,恰好完全反应,过滤、洗涤、烘干后,得到 10g白色固体。请计算:
(1)50gCaCl2溶液中溶质的质量为________g。
(2)过滤后所得溶液中溶质的质量分数(写出计算过程)。
8.(2022·甘肃·统考模拟预测)NO2是一种常见的空气污染物,会引起酸雨。对NO2的一种吸收办法是将NO2和O2按一定比例混合通入水中生成重要的工业产品硝酸,反应的化学方程式为,现有4.6gNO2和足量的氧气一起通入94.6g水中充分反应后。试计算:
(1)NO2 中N、O元素的质量比为______。
(2)HNO3中O元素的质量分数为______(结果精确到0.1%)。
(3)生成硝酸溶液(即HNO3的水溶液)的质量是多少?
9.(2022·甘肃定西·统考模拟预测)欲测定一瓶标签破损的硫酸铜溶液的溶质质量分数,现取50g硫酸铜溶液样品于烧杯中,逐滴加入10%的NaOH溶液。生成沉淀的质量与加入NaOH溶液的质量之间的关系如图所示。回答下列问题:
(1)图中x= 。
(2)计算硫酸铜溶液的溶质质量分数。(写出计算过程)
10.(2022·甘肃·统考模拟预测)实验室里现有一包氯化镁和氯化钠的固体混合物样品,某同学取该样品25.6g,使之完全溶解在106g水中,再向其中加入80g的氢氧化钠溶液,恰好完全反应,过滤,得到11.6g沉淀(不考虑过程中物质质量的损失),请计算:
(1)25.6g样品中氯化镁的质量。
(2)所加氢氧化钠溶液的溶质质量分数。
(3)反应后所得溶液中溶质的质量分数。
11.(2022·甘肃·统考模拟预测)医疗上常用硫酸钡作透视肠的内服剂.俗称“钡餐”。一旦误将碳酸钡代替硫酸钡作“钡餐”,就会致人中毒,此时可服用硫酸镁溶液解毒。某化学兴趣小组用如下实验模拟了碳酸钡在胃液中的变化,并验证了硫酸镁解毒的原理:
I.取一定量碳酸钡固体于烧杯中,逐滴加入188g稀盐酸至过量,并不断搅拌至固体完全溶解。
II.再向该烧杯中逐滴加入硫酸镁溶液,并不断搅拌,烧杯内产生白色沉淀质量与加入硫酸镁溶液的质量关系如图所示。
请你结合图像和提供的数据进行分析与计算。
(1)请你设计实验方案证明步骤I反应后的溶液中盐酸过量(只写出试剂名称)_____;
(2)通过计算确定硫酸镁溶液的溶质质量分数_____。(写出计算过程)
(3)请你计算M点所得溶液中氯化镁的溶质质量分数为_____。
12.(2022·甘肃金昌·校联考模拟预测)小刚需测定产品生石灰中杂质CaCO3(杂质只有碳酸钙)的质量分数。他进行了如图实验。
请计算:
(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数。
时间/s
0
20
30
40
60
80
100
120
增加的质量/g
0
0.7
m
1.2
1.5
1.6
1.7
1.7
时间(s)
0
10
20
30
40
50
60
70
读数(g)
198.4
197.8
197.4
196.0
195.8
195.7
195.7
195.7
实验序号
1
2
3
4
生铁样品的质量/g
20
40
60
80
生成气体的质量/g
0.7
1.4
1.5
m
参考答案:
1.(1)1.0
(2)1.7
(3)设反应消耗硝酸铵的质量为x
解得
则硝酸铵样品的纯度为:
答:硝酸铵样品的纯度为80%;
(4)
【解析】(1)
根据表中的时间与质量数据确定一些点,然后把各点利用平滑曲线连接,从而判断出m的值大约为1.0;
(2)
由表可知,产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质量,故增重质量即为产生氨气的质量,当时间在100s时,生成氨气质量与120s时生成氨气的质量相等,即当100s时已经反应完全,故完全反应后生成氨气的质量为1.7g;
(3)
见答案;
(4)
见答案。
2.(1)2.7
(2)解:设20片该咀嚼片中铝碳酸镁的含量为x
x≈9.9g
故每片该咀嚼片中铝碳酸镁的含量为:9.9g÷20≈0.50g
答:每片该咀嚼片中铝碳酸镁的含量为0.50g
【详解】(1)根据质量守恒定律,化学反应前后,物质的总质量不变,则生成二氧化碳的质量为:198.4g-195.7g=2.7g;
(2)见答案。
3.(1)2.2
(2)30
(3)根据图中信息分析可知,加入稀盐酸的质量为30g时开始反应产生CO2,至66.5g后不再有气体产生,总共产生2.2gCO2气体。设该样品中碳酸钙的质量为x,
该样品中氢氧化钙的质量分数为。
答:该样品中氢氧化钙的质量分数为59.7%。
【解析】(1)
由图2可知反应结束后产生二氧化碳的质量为2.2g;
(2)
由图2可知加入稀盐酸0-30g时无气泡产生,此时所涉及到的反应为氢氧化钙与盐酸发生的中和反应,故图中发生中和反应所用的稀盐酸质量为30g。
(3)
见答案。
4.(1)1.5
(2)解:由表可知,20g样品中的铁完全反应生成0.7g氢气
设样品中铁的质量为x
=
x=19.6g
生铁样品中碳的质量=20g−19.6g=0.4g
该生铁样品中碳的质量分数=×100%=2%
答:该生铁样品中碳的质量分数为2%。
(3)解:由表可知,200g稀硫酸与铁反应后能够生成1.5g氢气
设200g稀硫酸中硫酸的质量为y
=
y=73.5g
所用稀硫酸中溶质质量分数=×100%=36.75%
答:所用稀硫酸中溶质质量分数为36.75%。
【解析】(1)
实验1向20g样品中加入200g稀硫酸反应生成0.7g氢气,实验2向40g样品中加入200g稀硫酸反应后生成1.4g氢气,即20g样品与硫酸反应能够生成0.7g氢气,实验3向60g样品加入200g稀硫酸后反应生成1.5g氢气,说明样品中的铁完全反应,硫酸有剩余,则实验4中向80g样品中加入200g稀硫酸反应生成氢气的质量还是1.5g,即m为1.5,故填1.5。
(2)
见答案
(3)
见答案
5.(1)CaCO3
(2)设消耗碳酸钠的质量为x,生成氢氧化钠的质量为y,
x=10.6g,
y=8.0g,
未变质的氢氧化钠的质量是12.6g-10.6g=2.0g;
(3)最后所得100克氢氧化钠溶液的溶质的质量是2.0g+8.0g=10.0g,
故溶质的质量分数是×100%=10.0%
【解析】(1)
由于碳酸钠与氢氧化钙反应生成碳酸钙沉淀,过滤、蒸发等操作后,得到滤渣10.0g,即碳酸钙的质量是10.0g,化学式为:CaCO3;
(2)
见答案;
(3)
见答案。
6.(1)4.4
(2)设生成4.4g二氧化碳所需的碳酸钙质量为x,生成的氯化钙的质量为y,则
则该品牌补钙剂中碳酸钙的质量分数
答:该品牌补钙剂中碳酸钙的质量分数为50%;
(3)反应后的溶液质量为10g+40g-4.4g=45.6g,溶液中的溶质氯化钙质量为11.1g,则反应后溶液的溶质质量分数为
答:反应后溶液的溶质质量分数为24.3%。
【解析】(1)
反应前物质的药片质量为,反应前重质量为20g+40g=60g;反应后的总质量为55.6g,则生成气体的质量为60g-55.6g=4.4g,故填4.4;
(2)
见答案。
(3)
见答案。
7.(1)11.1
(2)设反应生成的氯化钠为y
根据反应恰好完全进行得出溶液中溶质只有氯化钠
解出y=11.7g
故溶质的质量分数为
答:过滤后溶液中溶质的质量分数为10%。
【分析】本题考查根据化学反应方程式的计算及关于溶质质量分数的计算。
(1)
设生成的氯化钠质量为x
氯化钙与碳酸钠反应生成碳酸钙沉淀与氯化钠,反应为恰好完全反应,故氯化钙溶液与碳酸钠溶液中的溶质都反应完,且反应后溶质只有氯化钠,根据化学反应方程式得出
解出x=11.1g
故50gCaCl2溶液中溶质的质量为11.1g
(2)
见解析。
【点睛】根据化学反应方程式计算时相对分子质量之比等于实际质量之比;溶质质量分数计算为溶质的质量分数=。
8.(1)7:16
(2)76.2%
(3)设4.6gNO2能与氧气反应的质量为x
x=0.8g
根据质量守恒定律可以得出:
生成硝酸溶液的质量=4.6g+0.8g+94.6g=100g
答:生成硝酸溶液(即HNO3的水溶液)的质量是100g。
【解析】(1)
NO2中N、O元素的质量比为:(14×1):(16×2)=7:16。
(2)
HNO3中O元素的质量分数为:。
(3)
见答案。
9.(1)40g;(2)16%
【详解】(1)设生成4.9g氢氧化铜需要硫酸铜的质量为m,氢氧化钠的质量为n。
m=8g
n=4g;
生成4.9g氢氧化铜需要10%的氢氧化钠溶液质量=4g÷10%=40g;
(2)硫酸铜溶液的溶质质量分数=
答:硫酸铜溶液的溶质质量分数为16%。
10.(1) 19g;(2) 20%;(3) 15%
【详解】(1)设氯化镁质量为x,氢氧化钠质量为y,氯化钠质量为z。
x=19g
y= 16g
z=23.4g
(2)所加氢氧化钠溶液的溶质质量分数=
(3)
反应后所得溶液中溶质的质量分数=
答:25.6g样品中氯化镁的质量为19g,所加入氢氧化钠溶液的溶质质量分数为20%,反应后所得溶液中溶质的质量分数为15%。
11.(1)紫色石蕊试剂
(2)解:设硫酸镁的质量为X,氯化镁的质量为Y。
;
硫酸镁溶液的溶质质量分数为:
答:硫酸镁溶液的溶质质量分数为6%; 故填:6%
(3) M点时,硫酸镁和氯化钡完全反应,所得溶液中氯化镁的质量由(2)已经求出等于9.5g;根据硫酸钡的质量推求出碳酸钡的质量及产生二氧化碳气体的质量为:
此时溶液的质量把所有加入的试剂全部加起来,以沉淀和其体形式脱离溶液体系的都减去。得其质量为:19.7g+188g+200g-23.3g-4.4g=380g
故M点所得溶液中氯化镁的溶质质量分数为:
答:M点所得溶液中氯化镁的溶质质量分数为2.5% ;故填:2.5%
【分析】碳酸钡可以与稀盐酸反应生成氯化钡、二氧化碳和水,加入过量的盐酸目的是使碳酸钡完全溶解,然后用硫酸镁与氯化钡反应生成沉淀,如图所示;刚开始时氯化钡过量,不断加入硫酸镁,沉淀一直产生,知道氯化钡完全反应完后,不再产生沉淀,完全反应的点是M点。
【详解】(1)设计实验方案证明步骤I碳酸钡和稀盐酸反应后的溶液中盐酸过量可以采用紫色石蕊试剂;若过量则显示为红色;故填:紫色石蕊试剂
(2)解:设硫酸镁的质量为X,氯化镁的质量为Y。
;
硫酸镁溶液的溶质质量分数为:
答:硫酸镁溶液的溶质质量分数为6%; 故填:6%
(3) M点时,硫酸镁和氯化钡完全反应,所得溶液中氯化镁的质量由(2)已经求出等于9.5g;根据硫酸钡的质量推求出碳酸钡的质量及产生二氧化碳气体的质量为:
此时溶液的质量把所有加入的试剂全部加起来,以沉淀和其体形式脱离溶液体系的都减去。得其质量为:19.7g+188g+200g-23.3g-4.4g=380g
故M点所得溶液中氯化镁的溶质质量分数为:
答:M点所得溶液中氯化镁的溶质质量分数为2.5% ;故填:2.5%
【点睛】在有坐标图的计算题中,需要仔细分析坐标图的横纵坐标代表的意义,特别要注意起点,拐点,这些点通常是临界点,在计算的过程中通常会用到;在计算一个混合溶液的质量时,把所有加入的试剂全部加起来,以沉淀和其体形式脱离溶液体系的都减去,即得溶液的质量。
12.(1)0.22g (2)5%
【详解】(1)反应前后的质量差即是生成的二氧化碳的质量,生成的二氧化碳的质量为:10g+500g+100g﹣609.78g=0.22g;
答:生成CO2气体的质量为0.22g;
(2)解:设样品中CaCO3的质量为x
x=0.5g
样品中CaCO3的质量分数为:
答:样品中CaCO3的质量分数为5%。
海南各地区2022年中考化学模拟试题汇编-计算题(提升题): 这是一份海南各地区2022年中考化学模拟试题汇编-计算题(提升题),共7页。试卷主要包含了计算题等内容,欢迎下载使用。
广西各地区2022年中考化学模拟试题汇编-计算题(基础题): 这是一份广西各地区2022年中考化学模拟试题汇编-计算题(基础题),共6页。试卷主要包含了计算题等内容,欢迎下载使用。
广西各地区2022年中考化学模拟试题分类汇编-计算题(中档题): 这是一份广西各地区2022年中考化学模拟试题分类汇编-计算题(中档题),共21页。试卷主要包含了计算题等内容,欢迎下载使用。












