

初中化学课题2 溶解度精品当堂达标检测题
展开这是一份初中化学课题2 溶解度精品当堂达标检测题,共16页。试卷主要包含了定义,组成,性质,溶解时的热现象 温度不变,分类等内容,欢迎下载使用。
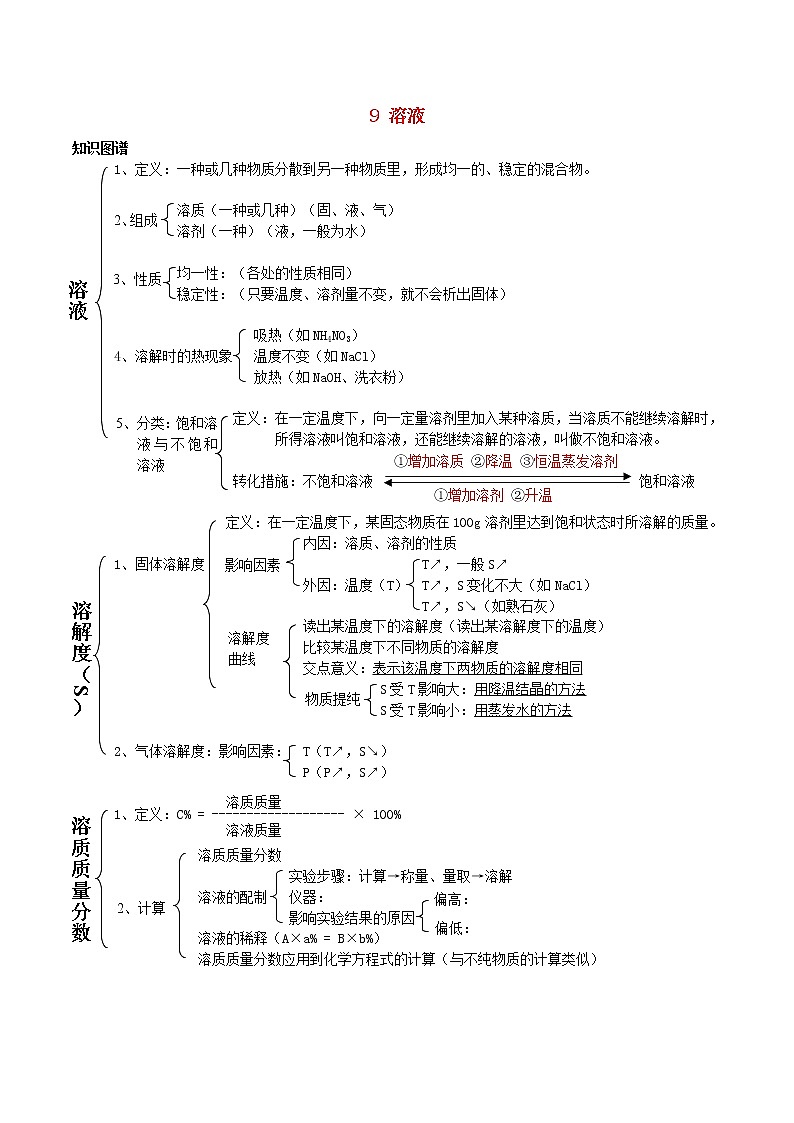
9 溶液
知识图谱
1、定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
溶质(一种或几种)(固、液、气)
溶剂(一种)(液,一般为水)
均一性:(各处的性质相同)
稳定性:(只要温度、溶剂量不变,就不会析出固体)
吸热(如NH4NO3)
4、溶解时的热现象 温度不变(如NaCl)
放热(如NaOH、洗衣粉)
定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得溶液叫饱和溶液,还能继续溶解的溶液,叫做不饱和溶液。
转化措施:不饱和溶液 饱和溶液
定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
内因:溶质、溶剂的性质
1、固体溶解度 T↗,一般S↗
外因:温度(T) T↗,S变化不大(如NaCl)
T↗,S↘(如熟石灰)
读出某温度下的溶解度(读出某溶解度下的温度)
比较某温度下不同物质的溶解度
交点意义:表示该温度下两物质的溶解度相同
S受T影响大:用降温结晶的方法
S受T影响小:用蒸发水的方法
2、气体溶解度:影响因素: T(T↗,S↘)
P(P↗,S↗)
1、定义:C% = ------------------- × 100%
溶质质量分数
实验步骤:计算→称量、量取→溶解
溶液的配制 仪器:
影响实验结果的原因
溶液的稀释(A×a% = B×b%)
溶质质量分数应用到化学方程式的计算(与不纯物质的计算类似)
一、饱和溶液和不饱和溶液
1.饱和溶液:在一定温度下,一定量溶剂里,不能继续溶解溶质的溶液。
2.不饱和溶液:在一定温度下,一定量溶剂里,能继续溶解溶质的溶液。
3.结晶的定义:热的溶液冷却后,已溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫做结晶;析出 晶体后的溶液叫母液,母液对于析出的溶质来说是饱和溶液。
二、溶解度
1.判断溶液是否饱和的方法。
一般来说,要确定某一溶液是否饱和,只要看在一定温度下(溶质为气体时,还需指明压强),在一定量的溶剂里有没有不能继续溶解的溶质存在,若有,那么这种溶液就是饱和溶液。只有指明“在一定温度下”和“在一定量的溶剂里”,溶液的“饱和”或“不饱和”才有确定的意义。
2.饱和溶液、不饱和溶液、结晶的一般转化方法。
3.固体的溶解度
(1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和时所溶解的质量。
(2)四要素:
①条件:一定温度。因为物质的溶解度随温度的变化而变化,不指明温度时,溶解度没有意义。
②标准:100 g溶剂。物质的溶解量与溶剂量成正比,为了便于比较,要取等量溶剂,且溶剂质量为100 g,而不是溶液质量。
③状态:饱和状态。只有在一定温度下,100 g溶剂中溶质达到饱和时,溶解的溶质的量才是一个定值,且是最大溶解量。
④单位:克。因为溶解度实质上是溶质的质量,所以质量的单位为克。
(3)影响因素:
①内因:溶质、溶剂的性质。
②外因:温度。
a.大多数物质的溶解度随温度升高而增大,如KNO3。
b.少数物质的溶解度受温度影响很小,如NaCl。
c.极少数物质的溶解度随温度升高而减小,如Ca(OH)2。
(4)溶解度曲线及其应用:
①定义:用横坐标表示温度,纵坐标表示溶解度,画出物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
②溶解度曲线的意义:
a.溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某温度下的溶解度,溶液必然是饱和溶液;
c.两条曲线交叉点表示两种溶质在同一温度下具有相同的溶解度;
d.在溶解度曲线下方的点,则表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(在较高温度下制成饱和溶液,慢慢地降到室温,溶液中溶解的溶质的质量超过室温下的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
③溶解度曲线的变化规律:a.大多数固体物质的溶解度随温度升高而增大,表现为曲线“坡度”比较“陡”,如KNO3。b.少数固体物质的溶解度受温度的影响很小,表现为曲线“坡度”比较“平”,如NaCl。c.极少数物质的溶解度随温度的升高而减小,表现为曲线“坡度”下降,如Ca(OH)2。
④溶解度曲线的应用:
a.可以查出某种物质在某温度下的溶解度。
b.可以比较不同物质在同一温度下的溶解度大小。
c.可以确定温度对溶解度的影响状况。
d.根据溶解度曲线确定怎样制得某温度时该物质的饱和溶液。
4.气体的溶解度
(1)概念:在压强为101kPa和一定温度时气体溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素:
①内因:溶质和溶剂的性质。
②外因:随温度升高而减小,随压强增大而增大。
5.结晶
(1)定义:溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫做结晶。
(2)方法:
①降温结晶;
②蒸发溶剂结晶。
【例1】下列关于溶液的说法,正确的是( )
A.溶液都是无色透明的 B.饱和溶液一定是浓溶液
C.饱和溶液不能再溶解任何物质 D.硝酸铵溶解在水中,溶液温度会降低
【答案】D
【解析】
【总结】溶液的特征有三个:均一、稳定、透明,透明不等于无颜色。
溶液饱和与浓稀没有必然的联系。
溶液中可以含有多种溶质,溶液的饱和与否是针对某一种溶质而言的。
【例2】下列说法正确的是( )
①浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液 ②向ag20℃时的NaCl饱和溶液中加入bgNaCl晶体,则溶液的质量变为(a+b)g ③条件改变,饱和溶液可能会变成不饱和溶液
A.① B.①② C.①③ D.①②③
【答案】C
【解析】溶液的浓稀与其是否饱和无必然联系,同一温度时,同一物质在同样溶剂(如水)中饱和溶液比不饱和溶液要浓.Ca(OH)2由于溶解度小,即使达到饱和,相对于易溶于水的物质来说,浓度很小,是稀溶液,①对;20℃时向ag饱和NaCl溶液再加入bgNaCl晶体,晶体不再溶解,溶液质量仍为ag,②错;条件改变,如改变温度、增加溶剂可以使饱和溶液变成不饱和溶液,③对.
【总结】①对于同一种溶质来说,在相同温度时饱和溶液比不饱和溶液要浓。
②对于不同种溶质来说,饱和溶液不一定是浓溶液。
③不饱和溶液不一定是稀溶液。
【例3】氯化钾在30℃时的溶解度是37g,则此温度下配制得的饱和溶液中,溶质、溶剂、溶液三者间的质量比为________.
【答案】37︰100︰137
【总结】①固体物质的溶解度为在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。
②在相同温度下,同一种物质的饱和溶液中溶质、溶剂、溶液三者之间的质量比都是一个定值= S:100:S+100。
【例4】在一定温度下,mg水中溶解某物质ng,溶液恰好达到饱和.此温度下该物质的溶解度为________g.
【答案】100n/m
【解析】溶解度=(溶质质量/溶剂质量)×100g,故此温度下该物质的溶解度=100n/m.
故答案为:100n/m.
【总结】溶解度=(溶质质量/溶剂质量)×100g(必须选取饱和溶液)。
【例5】如下图是甲、乙两种固体物质的溶解度曲线.
(1)________℃时,甲、乙两种物质的溶解度相等.
(2)t2℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系为:甲________乙(填“>”“<”或“=”).
(3)把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是________(填序号,下同).
A.溶剂的质量一定变小
B.溶质的质量可能不变
C.溶质的质量分数一定变大
D.溶液的质量一定变大
E.该饱和溶液还可以溶解其他物质
【答案】(1)t1;(2)<;(3)BE
【解析】两条曲线交点对应的温度即t1℃时,甲、乙两种物质的溶解度相等;t2℃时甲的溶解度大于乙的溶解度,将等质量的甲、乙加水制成饱和溶液,甲所需水的质量少,所得饱和溶液的质量甲<乙;当甲溶液由不饱和变为饱和溶液时,可通过加溶质A,恒温蒸发溶剂、降低温度三种方式,因此溶剂的质量可能变大、不变或变小;溶质的质量可能变大或不变;溶质的质量分数可能变大或不变,溶液的质量可能变小、不变或变大;饱和溶液还能溶解其他物质,故B、E正确.
【总结】(1)用溶解度表示饱和溶液的质量分数 w = S/(S+100) ;
(2)饱和溶液降温析出晶体,溶质减少但溶剂不变,可依溶剂列等式关系;
(3)饱和溶液升温,溶液不再饱和,但溶质质量分数不变;
(4)饱和溶液加水,溶液不再饱和,可依据溶质不变列等式关系。
【例6】20℃时,将3gA物质溶解于50g水中恰好制成饱和溶液,由此可知,该物质是( )
A.易溶物质 B.可溶物质 C.微溶物质 D.难溶物质
【答案】B
【总结】绝对不溶的物质是不存在的,习惯上把难溶物质叫做“不溶”物质。
溶解度/g(20℃) | <0.01 | 0.01~1 | 1~10 | >10 |
溶解性分类 | 难溶 | 微溶 | 可溶 | 易溶 |
举例 | AgCl、CaCO3 | Ca(OH)2 | KClO3 | KNO3、NaCl |
一、选择题:
1.将60℃的硝酸钾饱和溶液降温到10℃时,有晶体析出(晶体中不含水),下列各量没有发生改变的是( )
A.硝酸钾的溶解度
B.溶液的质量分数
C.溶液中溶质的质量
D.溶液中溶剂的质量
2.20℃时,取甲、乙、丙、丁四种纯净物各20g,分别加入到四只各盛有50g水的烧杯中,充分溶解后的情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
下列说法正确的是( )
A.所得溶液一定都是饱和溶液
B.丁溶液中溶质质量分数一定最大
C.20℃时物质溶解度的关系为:丁>甲>乙>丙
D.所得溶液的质量关系为:丙>乙>甲>丁
3.甲、乙两种物质的溶解度曲线如右图所示。下列说法不正确的是( )
A.在t1℃、t3℃时甲、乙两物质的溶解度相等
B.在t1℃至t3℃之间,乙的溶解度大于甲的溶解度
C.将甲、乙的饱和溶液从t3℃降到t1℃,析出甲、乙的质量相等
D.将t2℃时接近饱和的乙溶液变为饱和溶液可采取升温或降温的方法
4.甲、乙两种固体物质的溶解度曲线如右图所示。下列说法中,正确的是()
A.甲物质的溶解度大于乙物质的溶解度
B.在t1℃时甲、乙两种物质的溶解度相等
C.将乙物质的不饱和溶液变成饱和溶液可采取升高温度的方法
D.t2℃时甲和乙的溶解度相同
5.固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线 如图所示.下列说法错误的是( )
A.物质W能溶解在水和乙醇中
B.t1℃时,物质w在水中的溶解度为mg
C.t2℃时,物质W在水中与在乙醇中的溶解度相同
D.将t1℃时物质w的饱和水溶液升温至t2℃有晶体析出
6.喝了“可口可乐”后,常常出现打嗝现象,这是因为( )
A.“可口可乐”能稀释你体内的溶液,放出CO2
B.“可口可乐”能增加你体内的热量,使已溶的CO2溶解度升高而析出
C.你体内的热量使“可口可乐”中已溶的CO2溶解度降低而析出
D.“可口可乐”与你体内某物质反应生成CO2的缘故
7.下图为甲、乙两种固体物质在水中的溶解度曲线.下列说法错误的是( )
A.甲物质的溶解度随温度的升高而增大
B.在t1℃时,甲、乙两种物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
8.图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。
下列做法中,不能实现M、N间的相互转化的是()
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温过滤后再将其升温
D.从M→N:先将M升温再将其蒸发掉部分水
9.分别将100g甲、乙的饱和溶液从t2oC降温到t1oC,对所得溶液的叙述正确的是( )
A.甲、乙都是饱和溶液
B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙
D.甲、乙溶质质量均减小
二、非选择题:
1.有些金属的氢氧化物有相似的化学性质,但物理性质却有所不同,如Ca(OH)2、Ba(OH)2的溶解度就存在一定的差异,如下表所示:
温度/℃ | 0 | 40 | 80 | |
溶解度/g | Ca(OH)2 | 0.187 | 0.141 | 0.094 |
Ba(OH)2 | 1.67 | 8.22 | 101.4 | |
根据以上信息回答下列问题:
(1)图中,表示Ca(OH)2溶解度曲线的是________(填“A”或“B”)。
(2)如果要将Ca(OH)2的不饱和溶液转变为饱和溶液,可采取的方法是____________(只举一种)。
2.如图所示,在室温情况下,烧杯中盛装的是甲物质的溶液,试管①中盛装的是乙物质的溶液,试管②中盛装的是丙物质的溶液。当它们由室温升到80 ℃时,发现烧杯中甲物质没有明显变化,而试管①中盛装的乙物质全部溶解,试管②中有丙物质析出。
请你据此现象回答下列有关问题:
(1)室温时,________(选填“烧杯”“试管①”或“试管②”)中溶液可能是不饱和溶液。
(2)上图能表示甲物质的溶解度曲线的是________(选填“a”“b”或“c”,下同),能表示丙物质的溶解度曲线的是________。
(3)若甲物质溶液中混有少量的乙物质,可采取的提纯方法是________(选填“降温结晶”或“蒸发结晶”)。
(4)若将试管①从烧杯中取出冷却至室温后,从溶液中析出的固体质量为________g。
(5)当温度________时,乙物质的饱和溶液一定比甲物质的饱和溶液的溶质质量分数更大。
3.如下图所示,思考下列问题:
(1)A、B、C三种物质的溶解度曲线的变化规律如何?
(2)对于A物质来讲Q点、X点和R点分别代表什么意思?P点呢?
(3)对于B物质,它的曲线下方表示什么意思?上方呢?
(4)阴影部分对于A、B两物质有何意思?
4.认真分析下溶解度曲线图,回答下列问题.
①Q点的含义:________.
②P点的含义:________.
③t1℃时甲、乙、丙的溶解度由大到小的顺序为________.
④t3℃时,甲物质的饱和溶液中,溶质质量、溶剂质量与溶液质量之比为________.
⑤t3℃时,将甲物质的不饱和溶液转变成饱和可采取的方法有________或________.
⑥t3℃时甲、乙、丙的饱和溶液各W克,降温到t1℃时,析出晶体最多的是________物质,无晶体析出有________物质.
⑦从甲溶液中获取甲晶体(即提纯甲晶体)可用________的方法获取晶体.
⑧从乙溶液中获取乙晶体(即提纯乙晶体)可用________的方法获取晶体.
⑨除去甲中的泥沙用________法;分离甲与乙(含量少)的混合物,用________法.
⑩在t2℃时,30g甲物质加入到50g水中不断搅拌,能形成80g溶液吗?
一、选择题:
1.
【答案】D
【解析】
2.
【答案】D
【解析】
A、丙中无固体剩余,丙不一定是饱和溶液;
B、丁溶液中未溶解的固体最多,溶质质量分数最小;
C、溶解的固体质量为丙>乙>甲>丁,故20℃时物质溶解度的关系为:丙>乙>甲>丁;
D、溶解的固体质量为丙>乙>甲>丁,而水的质量相等,故所得溶液的质量关系为:丙>乙>甲>丁;
故选D。
3.
【答案】C
【解析】A、由图可知t1℃、t3℃时甲、乙两物质的溶解度相等;
B、由图可知:t1℃至t3℃之间,乙的溶解度曲线始终在甲的溶解度曲线上方,说明在此温度范围内乙的溶解度大于甲的溶解度;
C、由于不知二者饱和溶液质量是否相等,故无法判断,将甲、乙的饱和溶液从t3℃降到t1℃,析出甲、乙的质量大小;
D、当温度大于t2℃时乙的溶解度逐渐减小,要使不饱和溶液变为饱和溶液可采取升温的方法,而当温度低于t2℃时,乙的溶解度随温度降低逐渐减小,所以还可以采取降温的方法使其变为饱和溶液,升温、降温都能使其由不饱和变为饱和溶液;
故选C。
4.
【答案】B
C、乙物质的溶解度随温度的升高而增大,所以要将乙物质的不饱和溶液变成饱和溶液可采取降低温度的办法.C说法不正确.
D、t2℃时,甲的溶解度大于乙的溶解度.
所以答案选B.
5.
【答案】D
【解析】
A、从该物质在水和乙醇中的溶解度曲线不难看出,该物质既能溶于水,也能溶于乙醇,故A正确;
B、根据物质W在水中的溶解度曲线可知,在t1℃时,W在水的溶解度是mg,故B正确;
C、由于在t2℃时,物质W在两种溶剂中的溶解度曲线交于一点,说明该物质在这两种溶剂中的溶解度相等,故C正确;
D、由于物质W在水中的溶解度随温度的升高而增大,因此升温时,它的饱和水溶液不会有晶体析出,反而会变成不饱和溶液,故D错误;
6.
【答案】C
【解析】“可口可乐”中溶有CO2,而气体的溶解度随温度的升高而减小(与一般固体溶解度正好相反),人体内温度较外界温度高,人喝了“可口可乐”后,其中溶有的CO2的溶解度因温度升高而减小从体内溢出,从而带出了人体内的热量,达到降温的目的.故选项C符合题意.压强越小,温度越高,气体溶解度越小;压强越大,温度越低,气体溶解度越大。
7.
【答案】D
总结:固体的溶解度曲线的横坐标表示温度,纵坐标表示物质的溶解度。从溶解度曲线中我们可以得到以下信息:
某一物质在某温度时的溶解度。
同一物质在不同温度时的溶解度。
不同物质在同一温度时的溶解度。
物质的溶解度受温度变化影响大小。
8.
【答案】D
【解析】从N→M意思是单位溶剂溶解溶质的量增加,且溶液温度降低,可采取增加溶质和降低温度的方法,故A、B可以实现;从M→N意思是单位溶剂溶解溶质的量减小,且溶液温度升高,可采用降温过滤后再将升温的方法,故C可以实现.而D中先将M升温溶质质量不会变小,再将其蒸发掉部分水使其所含溶质析出而减小,则溶液就变成了饱和溶液,浓度比N高。故D不可实现.
9.
【答案】B
【解析】A、乙的溶解度随温度的降低而增大,所以,从t2°C降温到t1°C,乙变为不饱和溶液;
B、降低温度,溶剂的质量不变,所以溶液中溶剂的质量与降温前相等;从图中可看出:t2°C时甲的溶解度大于乙的溶解度,所以等质量的饱和溶液中含有溶质的质量是甲>乙,则所含溶剂的质量是甲<乙;
C、从图中可看出:甲的溶解度随温度的降低而减小,所以降低温度,甲要析出溶质,则溶液的质量减小;而乙的溶解度随温度的降低而增大,所以,从t2°C降温到t1°C,乙变为不饱和溶液,溶液的质量不变,故溶液的质量关系是:甲<乙;
D、甲的溶解度随温度的降低而减小,所以降低温度,甲要析出溶质;乙的溶解度随温度的降低而增大,所以,从t2°C降温到t1°C,乙变为不饱和溶液,溶质的质量不变。
二、非选择题:
1.
【答案】(1)B (2)升高温度(或恒温蒸发溶剂或加溶质)
2.
【答案】(1)试管② (2)b c (3)蒸发结晶 (4)1 (5)大于t ℃
【解析】(1)室温时,烧杯和试管①中都有未溶解的固体物质,它们中的溶液一定是饱和溶液,而试管②中无未溶解的固体,溶液可能是不饱和溶液。
(2)由室温升到80 ℃时,烧杯中的甲物质没有明显变化,说明甲物质的溶解度受温度影响不大,它的溶解度曲线应为b,而试管②中丙物质析出,说明丙物质的溶解度随温度的升高而降低,它的溶解度曲线应为c。
(3)由(2)知甲物质的溶解度受温度影响不大,应采取蒸发结晶的方法提纯甲。
(4)将试管①从烧杯中取出冷却至室温,溶液又恢复到起始状态,析出固体的质量就是起始状态下未溶解的1 g乙物质。
(5)由溶解度曲线可知,当温度大于t ℃时,乙物质的溶解度大于甲物质的溶解度,那么当温度大于t ℃时,乙物质饱和溶液的溶质质量分数一定比甲物质饱和溶液的溶质质量分数更大。
3.
【答案】1.A种物质的溶解度随温度升高而升高;B种物质的溶解度受温度的影响很小;C种物质的溶解度随温度升高而降低.
2.Q点代表A种物质在t2℃时达到饱和,溶解度为40g.X点代表的意思是在t2℃时,该溶液是饱和溶液且有部分溶质析出;R点代表的意思是在R点横坐标所对应的温度下,该溶液是不饱和溶液.
3.对于B物质,它的曲线下方表示在对应温度下处于不饱和状态;曲线上方表示在对应温度下处于饱和状态,且有物质析出.
4.阴影部分表示在温度小于t1℃时,B物质的溶解度大于A种物质的溶解度.
3.对于B物质,它的曲线下方表示在对应温度下处于不饱和状态;曲线上方表示在对应温度下处于饱和状态,且有物质析出.
4.阴影部分表示在温度小于t1℃时,B物质的溶解度大于A种物质的溶解度.
【总结】溶解度曲线的涵义包括“三线”和“四点”。
⑴ 三线:
① “陡升型”表示固体物的溶解度随温度升高而升高。如KNO3;
② “缓升型”表示固体物质的溶解度受温度的影响很小。如氯化钠;
③ “下降型”表示物质溶解度随温度升高而降低。如氢氧化钙。
⑵ 四点:
① 曲线上的点表示:所示某温度下某物质的溶解度(该温度下饱和状态);
② 两曲线的交点表示:两物质在该点所示温度下的溶解度数值相等;
③ 线上方的点表示:在该温度下该溶液是饱和溶液且有部分溶质析出;
④ 线下方的点表示:该温度下该溶液是不饱和溶液。
4.
【答案】①t3℃时甲物质的溶解度为80g.
②t2℃时甲物质和丙物质的溶解度都为40g.
③丙>乙>甲.
④2︰5︰7.
⑤继续加入甲物质或蒸发溶剂.
⑥甲物质;丙物质.
⑦冷却热饱和溶液.
⑧蒸发结晶.
⑨过滤甲的热饱和溶液;降温结晶.
⑩不能.因为在t2℃时,甲物质的溶解度为40g,也就意味着50g水中最多能溶解甲物质的质量为20g,所以30g甲物质加入到50g水中不断搅拌,最后将有10g甲物质析出,形成的溶液质量为70g.
【解析】①Q点的含义:t3℃时甲物质的溶解度为80g.
②P点的含义:t2℃时甲物质和丙物质的溶解度都为40g.
③t1℃时甲、乙、丙的溶解度由大到小的顺序为丙>乙>甲.
④t3℃时,甲物质的溶解度为40g,也就意味着甲物质的饱和溶液中,溶质质量、溶剂质量与溶液质量之比为40︰100︰140=2︰5︰7.
⑦若固体物质的溶解度随温度的变化较明显,从溶液中得到该物质的方法通常是降温结晶.故从甲溶液中获取甲晶体(即提纯甲晶体)可用冷却热饱和溶液的方法获取晶体.
⑧若固体物质的溶解度受温度的影响很小,从溶液中得到该物质的方法通常是蒸发结晶.故从乙溶液中获取乙晶体(即提纯乙晶体)可用蒸发结晶的方法获取晶体.
⑨除去甲中的泥沙用过滤甲的热饱和溶液法;分离甲与乙(含量少)的混合物,用降温结晶法.
⑩在t2℃时,甲物质的溶解度为40g,也就意味着50g水中最多能溶解甲物质的质量为20g,所以30g甲物质加入到50g水中不断搅拌,最后将有10g甲物质析出,形成的溶液质量为70g.故不能形成80g溶液.
【总结】溶解度曲线可以帮助我们处理以下问题:
查出某一物质在不同温度下的溶解度;
比较不同物质在同一温度下的溶解度;
分析出物质的溶解度受温度变化影响的大小。
根据溶解度曲线确定怎样制得某温度下的该物质饱和溶液。
利用温度对物质溶解度的影响提纯物质。
相关试卷
这是一份人教版九年级下册课题2 溶解度课堂检测,共4页。试卷主要包含了下列有关溶液的说法中,错误的是等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册课题2 溶解度习题,共4页。试卷主要包含了将2等内容,欢迎下载使用。
这是一份初中人教版课题2 化学肥料优秀课后作业题,共10页。试卷主要包含了化肥简介,化肥的简易鉴别等内容,欢迎下载使用。









