2023届高考化学二轮复习选择题突破实验设计与评价作业含答案
展开1.(2022·湖南卷)化学实验操作是进行科学实验的基础。下列操作符合规范的是( )
答案 A
解析 碱式滴定管排气泡时,把橡皮管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴涌出,气泡即可随之排出,A符合规范;用试管加热溶液时,试管夹应夹在距离管口的eq \f(1,3)处,用酒精灯外焰加热,B不符合规范;实验室中,有机物和无机物要分开存放,盐酸和NaOH要分开存放,C不符合规范;用胶头滴管滴加溶液时,胶头滴管不能伸入试管内部,应悬空滴加,D不符合规范。
2.某补铁剂每片含硫酸亚铁0.3 g(相当于铁60 mg),为测定含铁量是否达标,某兴趣小组用实验室常用试剂将铁元素通过氧化、碱化等步骤转化为Fe2O3,该过程不需要的操作为( )
答案 C
解析 测定补铁剂中的含铁量将补铁剂在烧杯中进行溶解后加氧化剂充分氧化,将铁转化成三价铁离子后再加碱将铁离子完全沉淀,然后过滤出氢氧化铁,在坩埚中进行灼烧,得到氧化铁后用天平称量,由此可知A为溶解、B为过滤、C为蒸发、D为称量,不需要的操作是C蒸发。
3.下列操作能够达到实验目的的是( )
答案 B
解析 A.由于Na2CO3溶液也能与CO2反应,故不能用饱和Na2CO3溶液来除去CO2中混有的NO2,A不合题意;B.检验K2CO3中是否含有钠盐,可以进行焰色试验,若观察到火焰颜色呈黄色,则说明含有Na+,B符合题意;C.粗锌可能因为能够形成原电池反而能加快其与稀硫酸的反应速率,故使用纯度更高的锌粒反而减慢其反应速率,C不合题意;D.将盐酸与NaHSO3混合产生的气体通入品红溶液,看到品红溶液褪色,只能说明盐酸的酸性强于亚硫酸,但盐酸和亚硫酸均不是各自最高价氧化物对应水化物,故不能证明非金属性:Cl>S,D不合题意。
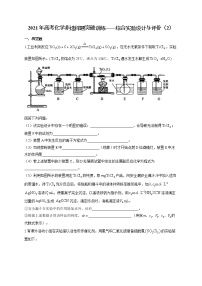
4.实验室中部分仪器或操作如图所示:
下列实验中,未涉及到图中仪器或操作的是( )
A.验证四氯化碳是非极性分子
B.用NaOH标准溶液测定未知浓度的盐酸
C.实验室制备少量氨气
D.由工业酒精制无水乙醇
答案 C
解析 A.用毛皮摩擦过的橡胶棒或绸子摩擦过的玻璃棒(带静电)靠近酸式滴定管中四氯化碳细流,细流不发生偏转,从而证明四氯化碳是非极性分子,A不符合题意;B.用NaOH标准溶液滴测定未知浓度的盐酸,需使用图中的中和滴定装置,B不符合题意;C.实验室制备少量氨气,要么用浓氨水滴入NaOH固体、生石灰或碱石灰中,要么使用固、固加热型装置,图中没有此类装置,C符合题意;D.由工业酒精制无水乙醇,采用蒸馏的方法,图中最前面的装置是蒸馏装置,D不符合题意。
5.(2022·石家庄二模)下列关于实验现象的解释或所得结论正确的是( )
答案 C
解析 A.向某无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,该无色溶液中含有SOeq \\al(2-,4)或Ag+,故A错误;B.用pH计分别测定相同浓度的Na2S和NaCl溶液的pH,Na2S溶液的pH较大,说明酸性HCl>H2S,HCl、H2S是无氧酸,不能根据无氧酸的酸性强弱判断非金属性强弱,故B错误;C.将pH=3的醋酸溶液稀释到原体积的100倍再测其pH为3
A.用甲装置制取并收集干燥纯净的NH3
B.用乙装置除去水中的苯酚
C.用丙装置配制一定物质的量浓度的硫酸溶液
D.用丁装置验证浓硫酸的吸水性
答案 D
解析 A.氨气的密度比空气小,应用向下排空气法收集,故A错误;B.苯酚微溶于水,溶于水形成乳浊液,应用分液法分离提纯,故B错误;C.容量瓶是量器,不能用来溶解或稀释物质,故C错误;D.浓硫酸具有吸水性,能使蓝色的五水硫酸铜失去结晶水形成白色的无水硫酸铜,故D正确。
7.下列操作能达到实验目的的是( )
答案 C
解析 A.25 ℃,测得可溶性正盐MR溶液的pH=7,不能证明可溶性MR为强酸强碱盐,也可能是水解程度相同的弱酸弱碱盐,A不合题意;B.由于碳酸钠溶液与二氧化碳会反应,故不能依次通过盛有饱和Na2CO3溶液和浓硫酸的洗气瓶来除去CO2中的SO2气体,应该依次通过盛有饱和NaHCO3溶液和浓硫酸的洗气瓶来除去,B不合题意;C.由于Ca(OH)2+MgCl2===Mg(OH)2↓+CaCl2,故可以用加入足量MgCl2浓溶液充分反应后过滤,洗涤的操作来除去Mg(OH)2中的Ca(OH)2,C符合题意;D.由于NaOH过量,AgNO3与NaOH会反应将生成黑色的氧化银,掩盖白色的氯化银,故检验氯乙烷中的氯原子,应先滴加NaOH水溶液,加热,再加入过量的HNO3将溶液先酸化再加入AgNO3溶液有白色沉淀生成,D不合题意。
8.(2022·济南二模)下列实验的“操作和现象”与“推测或结论”对应关系一定正确的是( )
答案 C
解析 A.题干未告知5%和30% H2O2溶液的体积,故无法确定谁先停止冒气泡,A不合题意;B.用铁丝蘸取少量某溶液进行焰色试验,火焰呈黄色,说明该溶液中一定含有钠元素,但不一定是钠盐,也可以是NaOH,B不合题意;C.已知石蕊指示剂的变色范围为5~8,某气体能使湿润的红色石蕊试纸变蓝,说明该气体溶于水后溶液的pH大于8,即该气体的水溶液显碱性,C符合题意;D.向无水乙醇中加入浓H2SO4,加热至170 ℃,将产生的气体通入酸性KMnO4溶液,红色褪去,由于挥发出来的乙醇或者反应中产生的副产物SO2均能使酸性高锰酸钾溶液褪色,故不能说明使溶液褪色的气体是乙烯,D不合题意。
B卷
9.图中实验装置正确,且能达到实验目的的是( )
A.利用图1装置模拟石油的分馏
B.利用图2装置检验NH4Cl分解产生的两种气体
C.利用图3装置蒸发结晶得到食盐晶体
D.利用图4装置验证牺牲阳极法
答案 B
解析 A.分馏装置中,温度计的水银球应置于蒸馏烧瓶的支管口处,A错误;B.氯化铵分解生成氨气和氯化氢混合气体,气体通过五氧化二磷吸收氨气后,通过观察湿润蓝色石蕊试纸变红证明生成HCl,气体通过碱石灰吸收氯化氢后,通过观察湿润的酚酞试纸变红证明生成氨气,B正确;C.蒸发结晶操作应在蒸发皿中进行,C错误;D.验证牺牲阳极法需检验Fe电极是否发生反应,而Fe做电极时反应只能得到二价铁离子,因此检验亚铁离子是否生成,不能用KSCN溶液检验,D错误。
10.下列操作能达到实验目的的是( )
答案 B
解析 A.由于蔗糖水解是酸性条件,检验水解产物葡萄糖需在碱性条件下,故加入新制Cu(OH)2之前,应先加入NaOH溶液中和水解的酸性条件,A不符合题意;B.硫酸酸化的品红溶液pH比品红溶液小,故将“84”消毒液滴入两种溶液中通过观察品红溶液褪色的快慢,可判断出氧化能力的强弱,B符合题意;C.酸性条件下,溶液中的Cl-也能与KMnO4反应使KMnO4溶液褪色,故此时KMnO4溶液褪色不一定是因为未变质的Fe2+,C不符合题意;D.Al2O3与足量的NaOH反应生成NaAlO2,Fe2O3不反应,过滤洗涤后获得Fe2O3,对NaAlO2溶液进行加热蒸发,促进其水解生成NaOH和Al(OH)3,但由于NaOH不挥发,故随着NaOH浓度增大,水解平衡又逆向移动生成NaAlO2,故蒸发结晶后获得的是NaAlO2固体,灼烧后仍为NaAlO2,无法获得Al2O3,D不符合题意。
11.(2022·重庆期考)用下列装置或操作进行相应实验,能达到实验目的的是( )
答案 A
解析 若锥形瓶内产生黄绿色气体,且淀粉KI溶液变蓝,则说明浓盐酸与高锰酸钾发生了反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,氯气通入到淀粉KI溶液中发生了反应2KI+Cl2===2KCl+I2,根据氧化剂的氧化性强于氧化产物可知,氧化性KMnO4>Cl2>I2,A能够达到实验目的;检验化合物中是否含钾元素,进行焰色试验时必须透过蓝色钴玻璃观察,否则其他颜色的光会掩盖钾的焰色(紫色),B不能达到实验目的;蒸馏时接收馏分的锥形瓶不能密封,否则会造成爆炸等实验事故,C不能达到实验目的;制备氢氧化铁胶体时,应将饱和FeCl3溶液滴加到沸水中,继续煮沸至液体呈红褐色,将饱和FeCl3溶液滴加到NaOH溶液中将生成Fe(OH)3沉淀,D不能达到实验目的。
12.(2022·日照联考)下列实验操作能达到相应实验目的的是( )
答案 C
解析 制备氢氧化铁胶体时,向煮沸的蒸馏水中滴加5~6滴饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热,A项错误;食品包装袋内脱氧剂中还原铁粉变质生成Fe2O3,取少量样品溶于盐酸后应选择KSCN溶液检验Fe3+,来确定铁粉是否变质。若铁粉未变质,铁粉溶于盐酸生成Fe2+,可用K3[Fe(CN)6]溶液来检验Fe2+,B项错误;制备无水AlCl3时,在HCl气流中加热AlCl3·6H2O,可以抑制AlCl3的水解,C项正确;溴乙烷的消去反应中,产生的乙烯气体中含有挥发出的乙醇蒸气,乙烯和乙醇都能使酸性高锰酸钾溶液褪色,D项错误。
13.(2022·广东卷)若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H2O生成
答案 B
解析 铜和浓硫酸反应生成CuSO4,体现浓硫酸的酸性,生成SO2,体现浓硫酸的强氧化性,故A错误;a处的紫色石蕊变红,其原因是SO2溶于水生成了酸,可说明SO2是酸性氧化物,故B正确;b处品红褪色,其原因是SO2具有漂白性,而c处酸性高锰酸钾褪色,其原因是SO2和KMnO4发生氧化还原反应,SO2体现还原性,故C错误;实验过程中试管底部出现白色固体,根据元素守恒可知,其成分为无水CuSO4,而非蓝色的CuSO4·5H2O,其原因是浓硫酸具有吸水性,将反应生成的H2O吸收,故D错误。
14.(2022·浙江6月选考)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是( )
答案 C
解析 KClO3溶于水,电离出钾离子和氯酸根离子,亚硝酸钠溶于水电离出钠离子和亚硝酸根离子,由于AgNO2沉淀可溶于稀硝酸,滴加硝酸银和足量稀硝酸不能生成白色沉淀,A错误;氯化钠电离出的氯离子也可以被酸性高锰酸钾氧化,而使其褪色,B错误;亚硝酸有氧化性,可以把二价铁氧化为三价铁,溶液变为黄色,C正确;稀硝酸可以把亚硫酸根离子氧化为硫酸根离子,再加入氯化钡可以生成硫酸钡白色沉淀,D错误。
15.(2022·沧州二模)下列实验方案、现象和结论都正确的是( )
答案 A
解析 A.铁粉和水蒸气反应生成氢气和四氧化三铁,氢气可以燃烧,收集后,用燃着的木条靠近会有爆鸣声,A正确;B.草酸浓度相同,体积不同,则溶液的总体积不同,不能探究浓度对反应速率的影响,B错;C.NaClO溶液具有漂白性,故不能用pH试纸测定NaClO溶液的pH,应该用pH计测定,C错;D.NaCl和KI浓度相同,向等浓度的NaCl和KI混合溶液中逐滴加入AgNO3溶液时,溶度积小的先形成沉淀,AgI为黄色沉淀,故先产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI),D错误。
16.下列实验操作、现象和结论均正确的是( )
答案 C
解析 A.由于反应后的溶液中有剩余的浓硫酸,故稀释时应该把反应后的混合物沿玻璃棒缓慢加入蒸馏水中,并不断搅拌,A选项操作错误,不符合题意;B.KMnO4具有强氧化性,可将H2O2氧化为O2,体现H2O2的还原性,B选项结论错误,不符合题意;C.K2Cr2O7溶液中,c(Cr2Oeq \\al(2-,7))>c(CrOeq \\al(2-,4)),但加入AgNO3后生成Ag2CrO4沉淀,而没有生成Ag2Cr2O7沉淀,说明Ag2CrO4比Ag2Cr2O7更难溶,即Ksp(Ag2CrO4)<Ksp(Ag2Cr2O7),C符合题意;D.加入碘水检验淀粉是否有剩余,不需要加入NaOH碱化,如果加NaOH,则I2与NaOH反应,导致无法检测淀粉,也就无法确定淀粉是否完全水解,D选项操作错误,不符合题意。
A.碱式滴定管排气泡
B.溶液加热
C.试剂存放
D.溶液滴加
选项
目的
操作
A
除去CO2中混有的NO2
通过饱和Na2CO3溶液
B
检验K2CO3中是否含有钠盐
做焰色试验,观察火焰颜色
C
增大锌粒与稀硫酸反应的速率
使用纯度更高的锌粒
D
证明非金属性:Cl>S
将盐酸与NaHSO3混合产生的气体通入品红溶液
选项
实验操作
现象
解释或所得结论
A
向某无色溶液中滴加盐酸酸化的BaCl2溶液
产生白色沉淀
该无色溶液中含有SOeq \\al(2-,4)
B
用pH计分别测定相同浓度的Na2S和NaCl溶液的pH
Na2S溶液的pH较大
Cl的非金属性强于S
C
将pH=3的醋酸溶液稀释到原体积的100倍再测其pH
3
D
将久置于空气中的NaOH固体溶于水,向其中加入BaCl2溶液
有白色沉淀生成
该NaOH固体已完全变质
选项
实验目的
实验操作
A
验证可溶性MR为强酸强碱盐
25 ℃,测得可溶性正盐MR溶液的pH=7
B
除去CO2中的SO2气体
依次通过盛有饱和Na2CO3溶液和浓硫酸的洗气瓶
C
除去Mg(OH)2中的Ca(OH)2
加入足量MgCl2浓溶液充分反应后过滤,洗涤
D
检验氯乙烷中的氯原子
先滴加NaOH水溶液,加热,再加入AgNO3溶液有白色沉淀生成
选项
操作和现象
推测或结论
A
常温下,同时向盛有5%和30%双氧水的试管中各加入一粒相同大小的MnO2后,盛有30%双氧水的试管中反应更剧烈
盛有30%双氧水的试管最先停止冒气泡
B
用铁丝蘸取少量某溶液进行焰色试验,火焰呈黄色
该溶液含有钠盐
C
某气体能使湿润的红色石蕊试纸变蓝
该气体的水溶液显碱性
D
向无水乙醇中加入浓H2SO4,加热至170 ℃,将产生的气体通入酸性KMnO4溶液,红色褪去
使溶液褪色的气体是乙烯
选项
实验目的
操作
A
检验蔗糖水解产物中的葡萄糖
取1 mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热
B
验证溶液pH减小,“84”消毒液的氧化能力增强
①将“84”消毒液(含
NaClO)滴入品红溶液中
②将“84”消毒液(含
NaClO)滴入硫酸酸化的品红溶液中
C
确定FeCl2是否完全变质
取少量的FeCl2样品于试管中,逐滴加入酸性高锰酸钾溶液
D
分离Fe2O3和Al2O3混合物
将混合物置于盛有足量NaOH溶液的烧杯中,然后依次进行过滤、洗涤、蒸发、灼烧等操作
选项
A
B
目的
探究氧化性:
KMnO4>Cl2>I2
检验化合物中是否含钾元素
装置或
操作
选项
C
D
目的
实验室里接收用自来水制取的蒸馏水
制备氢氧化铁胶体
装置或
操作
选项
实验目的
实验操作
A
制备Fe(OH)3胶体
向煮沸的蒸馏水中滴加5~6滴饱和FeCl3溶液,继续煮沸直至出现红褐色沉淀
B
验证食品包装袋内一小包脱氧剂中还原铁粉变质
取少量样品溶于盐酸,加入K3[Fe(CN)6]溶液
C
制备无水AlCl3
在HCl气流中加热AgCl3·6H2O
D
证明乙烯具有还原性
溴乙烷与氢氧化钠的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中
方案设计
现象和结论
A
先加入少量KClO3溶液,再加AgNO3溶液和足量稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
B
加到少量KMnO4溶液中,再加硫酸酸化,振荡
若溶液褪色,则样品为亚硝酸钠
C
先加到少量FeCl2溶液中,再加入稀盐酸酸化,振荡
若溶液变黄色,则样品为亚硝酸钠
D
先加入少量Na2SO3溶液,再加入BaCl2溶液和稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
选项
目的
实验方案
现象和结论
A
探究铁粉和水蒸气反应的气体产物
将产生的气体通入肥皂水中,用燃着的木条靠近产生的气泡,观察现象
气泡破裂发出爆鸣声,说明生成的是H2
B
探究浓度对反应速率的影响
向两支各装有4 mL 0.01 ml·L-1的酸性KMnO4溶液的试管中,分别加入0.1 ml·L-1的H2C2O4溶液2 mL和4 mL,记录溶液褪色时间
加入草酸量多的试管褪色快,说明浓度越大反应速率越快
C
探究
HClO和CH3COOH酸性强弱
取等浓度的NaClO溶液和CH3COONa 溶液,分别用 pH试纸测量,与标准比色卡对照
CH3COONa溶液的pH较小,说明酸性:
CH3COOH>HClO
D
探究
AgCl和
AgI的
Ksp大小
向等浓度的NaCl和KI混合溶液中逐滴加入AgNO3溶液,观察沉淀颜色
先产生黄色沉淀,说明Ksp(AgCl)
实验现象
结论
A
将Cu与浓硫酸反应后的混合物冷却,再向其中加入蒸馏水
溶液变蓝
有Cu2+生成
B
向0.1 ml·L-1 H2O2溶液中滴加 0.1 ml·L-1 KMnO4溶液
溶液褪色
H2O2具有氧化性
C
2CrOeq \\al(2-,4)+2H+
Cr2Oeq \\al(2-,7)+
H2O在 K2Cr2O7溶液中加入AgNO3溶液
有砖红色沉淀
(Ag2CrO4)生成
Ksp(Ag2CrO4)
<
Ksp(Ag2Cr2O7)
D
向淀粉溶液中加入适量 20%的 H2SO4溶液,加热,冷却后加入足量 NaOH溶液,再滴加少量碘水
溶液未变蓝色
淀粉已完全水解
高考化学二轮复习小题提速练11化学实验设计与评价含答案: 这是一份高考化学二轮复习小题提速练11化学实验设计与评价含答案,共6页。试卷主要包含了化学是以实验为基础的科学等内容,欢迎下载使用。
高考化学二轮复习小题提速练11化学实验设计与评价含答案: 这是一份高考化学二轮复习小题提速练11化学实验设计与评价含答案,共6页。试卷主要包含了化学是以实验为基础的科学等内容,欢迎下载使用。
2022届高考化学二轮复习课时作业12化学综合实验设计与评价含答案: 这是一份2022届高考化学二轮复习课时作业12化学综合实验设计与评价含答案,共9页。