






- 第一章 全章综合提升课件PPT 课件 0 次下载
- 第一节 有机化合物的结构特点课件PPT 课件 0 次下载
- 第一节 烷烃课件PPT 课件 0 次下载
- 第三节 芳香烃 课件PPT 课件 0 次下载
- 第二章 全章综合提升2课件PPT 课件 0 次下载
高中化学人教版 (2019)选择性必修3第二节 研究有机化合物的一般方法课文课件ppt
展开研究有机化合物的一般方法
课时1 有机化合物的分离和提纯
有机化合物的分离与提纯方法的选用
物质分离和提纯的物理方法
有机化合物的分离与提纯、蒸馏、萃取、重结晶、色谱法
例1[山东潍坊2020高三模拟]下列实验中,所采取的分离方法与对应原理都正确的是( )
要点1 物质分离和提纯的物理方法
【解析】乙醇与水互溶,不能作萃取剂,A错误;乙酸乙酯与乙醇互溶,不能用分液的方法分离,B错误;除去硝酸钾中的氯化钠可用重结晶的方法,是由于氯化钠在水中的溶解度受温度变化的影响较小,C错误;乙醚和丁醇互溶,但沸点差别较大,可用蒸馏的方法进行分离,D正确。【点拨】重结晶可以简单理解为多次结晶,具体过程为固体→溶液→较纯固体→溶液→更纯固体(达到所需要求)。若被提纯物质的溶解度随温度变化很大,杂质的溶解度随温度变化很小,可通过溶解配成溶液、蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到所需要的物质;若被提纯物质的溶解度随温度变化很小,一般可通过溶解配成溶液、蒸发结晶、趁热过滤、洗涤、干燥,得到所需要的物质。
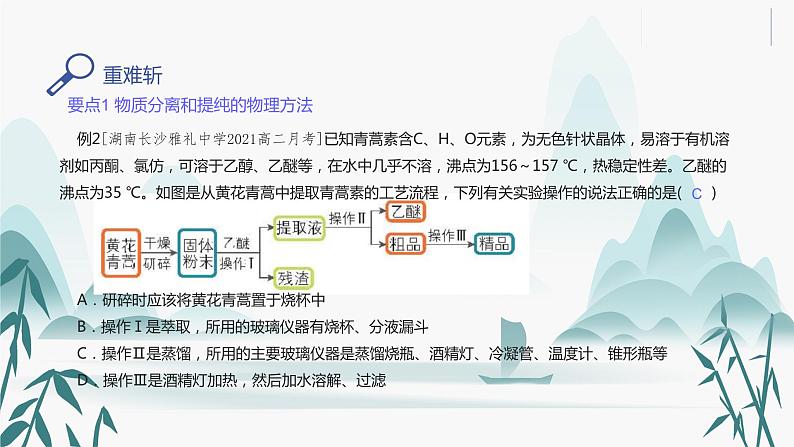
例2[湖南长沙雅礼中学2021高二月考]已知青蒿素含C、H、O元素,为无色针状晶体,易溶于有机溶剂如丙酮、氯仿,可溶于乙醇、乙醚等,在水中几乎不溶,沸点为156~157 ℃,热稳定性差。乙醚的沸点为35 ℃。如图是从黄花青蒿中提取青蒿素的工艺流程,下列有关实验操作的说法正确的是( )A.研碎时应该将黄花青蒿置于烧杯中B.操作Ⅰ是萃取,所用的玻璃仪器有烧杯、分液漏斗C.操作Ⅱ是蒸馏,所用的主要玻璃仪器是蒸馏烧瓶、酒精灯、冷凝管、温度计、锥形瓶等D.操作Ⅲ是酒精灯加热,然后加水溶解、过滤
【解析】根据流程可知,对黄花青蒿进行干燥研碎,可以增大黄花青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤可得提取液和残渣,提取液经过蒸馏后可得青蒿素粗品,在粗品中加入95%的乙醇,浓缩、结晶、过滤可得精品,以此解答。研碎时应该将黄花青蒿置于研钵中进行,选项A错误;由上述分析可知,操作Ⅰ是将固体和液体分离,是过滤操作,选项B错误;操作Ⅱ是将提取液中的乙醚分离出去,得到粗品,是蒸馏操作,蒸馏用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、冷凝管、温度计、锥形瓶等,选项C正确;操作Ⅲ是重结晶,具体操作为溶解、加热浓缩、冷却结晶、过滤,选项D错误。
例1 现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表所示。由此推知,分离甲和乙的最佳方法是( )A.萃取法 B.升华法 C.蒸馏法 D.分液法
题型1 有机化合物的分离与提纯方法的选用
【解析】甲和乙常温下均呈液态,故不能用升华法分离,B项错误;甲、乙两物质均为有机化合物,能够互溶,且均可溶于水,所以不能用分液法和萃取法分离,A、D项错误;根据表格中的沸点数据可知,可采用蒸馏法分离,C项正确。【点拨】解答本题的依据是表格中的数据:
变式练|1-1|[山东曲阜一中2021高二月考]将CH3CHO(易溶于水,沸点为20.8 ℃的液体)和CH3COOH分离的正确方法是( )A.加热蒸馏B.加入Na2CO3溶液后,通过萃取的方法分离C.和Na反应后进行分离D.先加入烧碱溶液,蒸出乙醛,再加入浓H2SO4,蒸出乙酸
【解析】CH3CHO与CH3COOH均易挥发,直接加热蒸馏不能分离二者,故A错误;加入Na2CO3溶液后,乙酸和Na2CO3反应生成的乙酸钠溶液与乙醛互溶,不能萃取分离,故B错误;乙酸与Na反应生成乙酸钠,但是分离后缺乏乙酸钠转化为乙酸的步骤,故C错误;先加入烧碱溶液,乙酸与NaOH反应生成乙酸钠,增大与乙醛的沸点差异,通过蒸馏可先蒸出乙醛,再加入浓硫酸,与乙酸钠反应生成乙酸,然后通过蒸馏操作蒸出乙酸,故D正确。
例2 [辽宁六校2021高二期中联考]为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法均正确的一组是( )
【解析】乙酸乙酯也能和氢氧化钠溶液反应,应该用饱和碳酸钠溶液除去乙酸乙酯中的乙酸,A错误;氧化钙和水反应生成氢氧化钙,然后蒸馏即可得到乙醇,B正确;单质溴易溶于有机溶剂,微溶于水,应该用氢氧化钠溶液除去溴苯和苯中的溴单质,C、D错误。【点拨】在解答物质分离提纯试题时,选择试剂和实验操作应遵循四个原则:①不能引入新的杂质,即分离提纯后的物质应是纯净物,不能有其他物质混入其中;②不减少被提纯的物质;③分离提纯后的物质状态不变;④实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
变式练|2-1|[山东临沂2021高二期中]下列实验中,所选装置或实验设计合理的是( )A.加热蒸馏B.加入Na2CO3溶液后,通过萃取的方法分离C.和Na反应后进行分离D.先加入烧碱溶液,蒸出乙醛,再加入浓H2SO4, 蒸出乙酸
【解析】苯甲酸的溶解度不大,趁热过滤提纯苯甲酸,可减少损失,故A正确;乙醇溶于水,不能作萃取剂,不能提取溴水中的溴,故B错误;苯和甲苯互溶,且沸点相差较大,可用蒸馏法分离,图中缺少温度计,故C错误;二者均与碳酸钠溶液反应,应选用饱和碳酸氢钠溶液除去CO2中混有的HCl,故D错误。
课时2 有机化合物实验式、分子式、分子结构的确定
有机化合物的分离与提纯、波谱分析法的应用
元素分析、有机化合物相对分子质量及分子式的确定、有机化合物分子结构的鉴定
确定实验式——元素分析、确定分子式——质谱法、确定分子结构——波谱分析
示例1 确定物质的实验式(最简式)和相对分子质量之后,可进一步确定其分子式。 已知某有机化合物的实验式为C4H10O,如图是该有机化合物的质谱图,则其相对分子质量为________,分子式为________。
74 C4H10O
例1 [辽宁葫芦岛2021高二期中]有机化合物A完全燃烧只生成CO2和H2O(g),将12 g该有机化合物完全燃烧的产物通过足量浓硫酸,浓硫酸增重14.4 g,再通过足量碱石灰,碱石灰增重26.4 g,该有机化合物的分子式是( )A.C4H10 B.C3H8OC.C2H6O D.C2H4O2
【解析】浓硫酸增重14.4 g,即水的质量为14.4 g,则n(H2O)= =0.8 ml,n(H)=1.6 ml,m(H)=1 g·ml-1×1.6 ml=1.6 g。碱石灰增重26.4 g,即二氧化碳的质量为26.4 g,则n(CO2)= =0.6 ml,n(C)=0.6 ml,m(C)=12 g·ml-1×0.6 ml=7.2 g。m(C)+m(H)=8.8 g<12 g,则该有机物中一定含有氧元素,12 g有机物中含有的氧元素的质量为12 g-8.8 g=3.2 g,n(O)= =0.2 ml。n(C)∶n(H)∶n(O)=0.6 ml∶1.6 ml∶0.2 ml=3∶8∶1,即该有机物的实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以该有机物的分子式为C3H8O ,故选B。【点拨】确定只含C、H、O元素的有机化合物实验式的一般步骤:根据题意计算C、H的物质的量→计算C、H的质量→有机化合物的总质量减去C、H的质量之和等于O的质量→计算O的物质的量→求C、H、O的物质的量的最简整数比→写出实验式。
变式练|1-1|[天津东丽区2021高二月考]某有机化合物在足量氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机化合物必须满足的条件是( )A.分子中的C、H、O原子的个数比为1∶2∶3B.分子中C、H原子的个数比为1∶2C.该有机化合物的相对分子质量为14D.该有机化合物分子中肯定不含氧元素
【解析】某有机化合物在氧气中充分燃烧,根据生成等物质的量的水和二氧化碳可知,该有机化合物分子中含有C、H原子的个数比为1∶2,无法确定该有机化合物中是否含有氧元素,故A、D错误,B正确;最简单的有机化合物为CH4,其相对分子质量为16>14,故C错误。
变式练|1-2|[江苏盐城中学2020高二期中]某有机化合物的蒸气跟足量O2混合点燃,充分反应后生成4.48 L(已折算成标准状况)CO2和5.4 g H2O。下列关于该有机化合物的说法正确的是( )A.该有机化合物中肯定不含氧元素B.分子中C、H、O原子个数比为1∶3∶1C.若该有机化合物中含氧元素,则该有机化合物一定为乙醇D.若该有机化合物的相对分子质量为30,则该有机化合物一定是乙烷
【解析】标准状况下,4.48 L CO2的物质的量为 =0.2 ml,5.4 g H2O的物质的量为 =0.3 ml,该有机化合物分子中含有C、H原子个数比N(C)∶N(H)=0.2 ml∶(0.3 ml×2)=2∶6=1∶3。根据上述分析,无法确定该有机化合物中是否含有氧元素,故A、B错误;若该有机化合物中含氧元素,不一定为乙醇,也可能为乙二醇、二甲醚等,故C错误;该有机化合物分子中N(C)∶N(H)=1∶3,若该有机化合物的相对分子质量为30,则一定不存在氧元素,分子式为C2H6,一定是乙烷,故D正确。
例2 将3.24 g某有机化合物装入元素分析装置,然后通入足量氧气使之充分燃烧,燃烧产物只有CO2和H2O(气态),将生成的气体依次通过装有CaCl2的A管和装有碱石灰的B管,测得A管质量增加2.16 g,B管质量增加9.24 g。已知该有机化合物的相对分子质量小于200,求其实验式并推测其分子式,写出计算过程。
题型2 有机化合物相对分子质量及分子式的确定
实验式为C7H8O,分子式为C7H8O(计算过程见解析)
变式练|2-1|[甘肃天水一中2021高二月考]8.8 g某有机化合物C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重7.2 g和17.6 g,经检验剩余气体为O2。C分子的质谱与红外光谱如图所示 下列说法错误的是( ) A.有机化合物C中含有C、H、O三种元素 B.有机化合物C的分子式为C4H8O2 C.有机化合物C难溶于水 D.符合C分子结构特征的有机化合物只有一种
【解析】某有机化合物C在足量O2中充分燃烧,生成的水的质量为7.2 g(即0.4 ml)、二氧化碳气体的质量为17.6 g(即0.4 ml),根据质量守恒,有机化合物中氧元素的质量为8.8 g-0.4 ml×2×1 g·ml-1-12 g·ml-1×0.4 ml=3.2 g(即0.2 ml),则8.8 g有机化合物C中含0.4 ml C、0.8 ml H、0.2 ml O;从质谱图中可知C的相对分子质量为88。据分析,有机化合物C中含有C、H、O三种元素,A正确;C的相对分子质量为88,8.8 g(即0.1 ml)有机化合物C中含0.4 ml C、0.8 ml H、0.2 ml O,则有机化合物C的分子式为C4H8O2,B正确;从红外光谱图中可知,符合有机化合物C分子结构特征的有机化合物不止有一种,有机化合物C可能为乙酸乙酯、丙酸甲酯,难溶于水,C正确、D错误。
例3[湖南常德一中2021高二月考]下列装置中有机化合物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机化合物的分子式(部分仪器已省略)。(1)A装置提供实验所需的O2,C中CuO的作用是___________________________________________。(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44 g样品,经充分反应 后,D管质量增加0.36 g,E管质量增加0.88 g,已知该物质的相对分子质量为44,则该样品的分 子式为________。
题型3 有机化合物分子结构的鉴定
使有机化合物中碳元素被充分氧化生成CO2
(3)若该有机化合物的核磁共振氢谱如图所示,峰面积之比为1∶3,则其结构简式为____________。(4)若该有机化合物符合下列条件,则其结构简式为__________________________________。①环状化合物;②只有一种类型的氢原子。(5)某同学认为E和空气相通,会影响测定结果的准确性,应在E后再增加一个装置E,其主要目的是________________________________________________________________________。
防止空气中的二氧化碳和水蒸气进入与D相连的E装置中
【解析】A是制备氧气的装置,B用于干燥通入C中的氧气,有机化合物在C中充分燃烧、氧化,D用来吸收水,测定生成水的质量,E用来吸收二氧化碳,测定生成二氧化碳的质量;根据一氧化碳能被CuO氧化成二氧化碳可知,氧化铜的作用是把有机化合物不完全燃烧产生的一氧化碳转化为二氧化碳。(1)C中CuO的作用是把有机化合物不完全燃烧产生的CO转化为CO2。(2)E管质量增加的0.88 g为生成二氧化碳的质量,可得碳元素的质量为 ×12 g·ml-1=0.24 g,D管质量增加的0.36 g是生成水的质量,可得氢元素的质量为 ×2×1 g·ml-1=0.04 g,从而推出含氧元素的质量为(0.44-0.24-0.04) g=0.16 g,设有机化合物的最简式为CxHyOz,则x∶y∶z= =2∶4∶1,即有机化合物的最简式为C2H4O,已知该物质的相对分子质量为44,则该样品的分子式为C2H4O 。
(3)根据该有机化合物的核磁共振氢谱可知,有两组吸收峰,则有机化合物分子中有2种不同化学环境的H原子,峰面积之比为1∶3,则两种H原子的个数比为1∶3,有机化合物结构简式为CH3CHO。(4)①环状化合物,②只有一种类型的氢原子,说明有机化合物结构中含有2个—CH2—,且具有对称性,则该有机化合物的结构简式为 。(5)某同学认为E和空气相通,会影响测定结果的准确性,应在E后再增加一个E装置,其目的是防止与D相连的E吸收空气中的二氧化碳和水蒸气,产生误差。【点拨】有机化合物的分子式的测定,关键在于清楚实验的原理,掌握燃烧法中元素守恒的应用。
变式练|3-1|根据核磁共振氢谱图可以确定有机化合物分子中氢原子的种类和数目。例如:乙醚的结构式为 ,其核磁共振氢谱中有2组峰,且峰面积之比为3∶2(如图甲所示)。(1)下列分子中,其核磁共振氢谱中只有一组峰的物质是________(填序号)。A.CH3CH3 B.CH3COOHC.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图乙所示,则A的结构简式为________,请预测B的核磁共振氢谱上有________组峰。(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是________________________________________________________________________________________________________________________________________________。
通过其核磁共振氢谱中有3组峰时可以判断,分子结构为CH3CH2OH;1组峰时分子结构为CH3—O—CH3
【解析】(1)核磁共振氢谱中只有一组峰,说明该分子中的H原子都是等效的,只有1种H原子。 CH3CH3中6个H原子都是等效的,核磁共振氢谱中只有一组峰,A正确; CH3COOH中甲基中的H原子与羧基中的H原子所处化学环境不同,CH3COOH有2种H原子,核磁共振氢谱中有2组峰,B错误;CH3COOCH3中2个甲基所处化学环境不同,有2种H原子,核磁共振氢谱中有2组峰,C错误;CH3COCH3中2个甲基连在同一个酮羰基上,6个H原子都是等效的,核磁共振氢谱中只有一组峰,D正确。(2)由A的核磁共振氢谱可知,分子中只有一种H原子,A分子中2个Br原子连接不同的碳原子,故A的结构简式为BrCH2CH2Br。B与A互为同分异构体,B分子中2个Br原子连接在同一碳原子上,B为CH3CHBr2,分子中有2种H原子,故B的核磁共振氢谱有2组峰。(3)通过其核磁共振氢谱中的峰可以判断有3组峰时,分子结构为CH3CH2OH;1组峰时,分子结构为CH3—O—CH3。
例1 [北京理综2016·9,6分]在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下: 下列说法不正确的是( )A.该反应属于取代反应B.甲苯的沸点高于144 ℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
考点1 有机化合物的分离与提纯
【解析】甲苯生成二甲苯混合物和苯的反应之一可表示为可以看作1个甲苯中的—CH3取代另1个甲苯苯环上的氢原子,发生取代反应,A正确;甲苯的相对分子质量介于苯和二甲苯之间,沸点应介于80~138 ℃之间,B错误;苯的沸点与二甲苯的沸点相差较大,可以用蒸馏的方法分离,C正确;对二甲苯的熔点比邻二甲苯和间二甲苯的高,冷却后首先结晶,可以用冷却结晶的方法分离出对二甲苯,D正确。【名师点评】本题涉及物质的分离和提纯、有机反应类型、有机化合物的性质比较,考查学生根据表格所给数据分析解决问题的能力,难度不大。但本题易错选A项,应注意通过反应前后有机化合物结构的对比,正确判断反应类型。
例2[浙江化学2019年4月·32题节选]写出C6H13NO2同时符合下列条件的同分异构体的结构简式①分子中有一个六元环,且成环原子中最多含2个非碳原子;②1H-NMR谱和IR谱检测表明分子中有4种化学环境不同的氢原子。有N—O键,没有过氧键(—O—O—)。
考点2 波谱分析法的应用
【解析】分子式为C6H13NO2,结合信息,存在一个六元环,环内最多含有两个非碳原子,先分析六元环:①六元环全为碳原子;②六元环中含有一个O原子;③六元环中含有一个N原子;④六元环中含有一个N原子和一个O原子。若六元环中含有2个O,这样不存在N—O键,不符合条件。同时核磁共振氢谱显示有4种氢原子,则该分子结构具有对称性。最后注意有N—O键,无—O—O—键。那么基于上述四种情况分析可得出4种同分异构体,结构简式分别为
例3[课标Ⅱ理综2015·38题节选] D[HOOC(CH2)3COOH]的同分异构体中能同时满足下列条件的共有________种(不含立体异构体)。 ①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生皂化反应 其中核磁共振氢谱显示为3组峰,且峰面积比为6∶1∶1的是______________________(写结构简式)。 D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是________(填标号)。 a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
【解析】①能与饱和NaHCO3溶液反应产生气体,说明含有羧基;②既能发生银镜反应,又能发生皂化反应,说明含有醛基和酯基,因此应含甲酸形成的酯基,可能的结构简式为HCOO—CH2CH2CH2COOH、HCOO—CH2CH(COOH)CH3、HCOO—CH(COOH)CH2CH3、HCOO—CH(CH3)CH2COOH、HCOO—C(CH3)2COOH,共5种。其中核磁共振氢谱显示为3组峰,且峰面积比为6∶1∶1的是【名师点评】同分异构体的分子式相同,所含原子种类及数目均相同,其在元素分析仪中显示的数据相同;同分异构体中原子或基团的连接顺序不同,在红外光谱仪、质谱仪或核磁共振仪中显示的信号不相同。在学习中多了解利用现代分析仪器鉴定分子组成与结构的原理,此类问题即可迎刃而解。
1.现有三组混合液:①乙酸乙酯和乙酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液。分离上述各混合液的正确方法依次是( )A.分液、萃取、蒸馏 B.萃取、蒸馏、分液C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
【解析】①乙酸乙酯难溶于水,乙酸钠易溶于水,可采取分液的方法分离;②乙醇和丁醇互溶,不能用分液法分离,但二者沸点相差较大,可用蒸馏法分离;③NaBr和单质溴的水溶液,可利用有机溶剂萃取出其中的Br2,故C项正确。
2.[福建莆田2021高二期中]下列实验操作中,错误的是( )A.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出D.萃取时,溶剂要互不相溶,溶质在两种溶剂中的溶解度相差很大
【解析】蒸发时当出现大量固体或剩余少量水时停止加热,A错误;蒸馏时,温度计测量的是物质的沸点,即蒸气的温度,故放置于蒸馏烧瓶支管口下沿处,B正确;分液时,下层液体从下口放出,为了避免交叉污染,上层液体从上口倒出,C正确;萃取剂应满足与原溶剂不反应、不互溶、溶解度大等要求,D正确。
3.[山东济南2021高三期末]绿原酸具有抗病毒、降血压、延缓衰老等保健作用。利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进一步提取绿原酸的流程如图所示:下列说法错误的是( )A.从“提取液”获取“有机层”的操作为萃取、分液B.蒸馏时选用球形冷凝管C.过滤时所需玻璃仪器有烧杯、漏斗、玻璃棒D.粗产品可通过重结晶的方法提纯
【解析】由流程图可知,乙酸乙酯作萃取剂,得到有机层的实验操作为萃取、分液,A正确;蒸馏时若选用球形冷凝管,会有一部分馏分经冷凝降温后滞留在冷凝管中,而不能进入接收器中,因此蒸馏时应该选用直形冷凝管,B错误;过滤时所需玻璃仪器有烧杯、漏斗、玻璃棒,C正确;绿原酸难溶于水,易溶于有机溶剂,因此可利用重结晶的方法进一步提纯,D正确。
4.某有机化合物X含有C、H、O三种元素,已测定:①X中含碳的质量分数;②X中含氢的质量分数;③X气体在标准状况下的体积;④X对氢气的相对密度;⑤X的质量。在确定X的分子式时,可以不需要的数据是( )A.①② B.③⑤ C.①②④ D.④⑤
【解析】根据①②可以确定氧元素的质量分数,从而可以确定有机化合物的实验式,由④可以确定有机化合物的相对分子质量,由相对分子质量和实验式可确定分子式,综上所述,最终可以确定有机化合物的分子式的组合是①②④,可以不需要的是③⑤,答案选B。
5.某同学为测定维生素C(只含C、H、O元素)的分子式,取维生素C样品研碎,称取该试样0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流,用酒精喷灯持续加热样品,将生成物先后通过无水氯化钙和碱石灰,生成物被完全吸收,两者质量分别增加0.144 g和0.528 g。则下列有关该实验及维生素C的说法不正确的是( )A.维生素C中氢元素的质量分数约为4.5%B.0.352 g该试样中氧元素的质量为0.192 gC.利用该实验所得数据计算可得维生素C的分子式为C3H4O3D.维生素C是一种抗氧化剂,俗称抗坏血酸,它在中性或碱性溶液中易被氧化
【解析】根据题意知,将生成物先后通过无水氯化钙和碱石灰,两者质量分别增加0.144 g和0.528 g,则燃烧生成水0.144 g、二氧化碳0.528 g,0.528 g二氧化碳的物质的量为0.012 ml,含有碳元素的质量m(C)=12 g·ml-1×0.012 ml=0.144 g,0.144 g水的物质的量为0.008 ml,0.008 ml水中含有0.016 ml H原子,维生素C中氢元素的质量分数w(H)= ×100%≈4.5%,A正确;0.352 g维生素C中含有碳元素的质量为0.144 g,含有氢元素的质量为0.016 g,则含有C、H元素的总质量为0.144 g+0.016 g=0.160 g<0.352 g,则维生素C中一定含有氧元素,含有氧元素的质量为0.352 g-0.160 g=0.192 g,B正确;n(O)= =0.012 ml,n(C)∶n(H)∶n(O)=3∶4∶3,可得维生素C的实验式为C3H4O3,无法确定分子式,C错误;维生素C是一种抗氧化剂,俗称抗坏血酸,它在中性或碱性溶液中易被氧化,D正确。
6.某含氧有机物中含碳的质量分数为64.86%,含氢的质量分数为13.5%,结合该有机物的质谱图,该有机物的相对分子质量为________,分子式为________。
【解析】由质谱图可知,该有机物的相对分子质量为74;碳的质量分数是64.86%,氢的质量分数是13.5%,则氧元素质量分数是100%-64.86%-13.5%=21.64%,则该物质中碳、氢、氧原子个数之比为 ≈4∶10∶1,所以其实验式为C4H10O,该有机物相对分子质量为74,则其分子式为C4H10O 。
7.下列不是用来确定有机化合物结构或官能团的是( )A.红外光谱 B.核磁共振氢谱C.质谱 D.银镜反应
【解析】红外光谱法可用于确定有机化合物分子中含有的官能团,故A不符合题意;核磁共振氢谱法可用于确定有机化合物结构,故B不符合题意;质谱法可用于确定有机化合物的相对分子质量,但不能用于确定有机化合物的结构,故C符合题意;银镜反应可以用于确定分子中是否含有醛基,故D不符合题意。
8.[辽宁沈阳城郊市重点联合体2020高二月考]对分子式为C3H8O的有机化合物进行仪器分析:红外光谱显示有对称甲基以及羟基等基团;核磁共振氢谱显示有三组峰,峰面积之比为1∶1∶6。则该化合物的结构简式为( )A.CH3OCH2CH3 B.CH3CH(OH)CH3C.CH3CH2CH2OH D.C3H7OH
【解析】 CH3OCH2CH3不含羟基,故A错误; CH3CH(OH)CH3有对称甲基以及羟基等基团,核磁共振氢谱有三组峰,峰面积之比为1∶1∶6,故B正确; CH3CH2CH2OH没有对称的甲基,故C错误;不知道C3H7OH具体结构,不能确定分子中有无对称的甲基,故D错误。
9.[黑龙江哈尔滨三中2021高二月考]有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )A.由红外光谱图可知,该有机物中至少有三种不同的 共价键B.由核磁共振氢谱图可知,该有机物分子中有三种不 同化学环境的氢原子C.若A的化学式为C2H6O,则其结构简式为CH3—O —CH3D.由核磁共振氢谱可知其分子中不同化学环境的氢原 子的个数比
【解析】由红外光谱图可知,有机物A一定含有C—H、O—H和C—O三种共价键,A项正确;核磁共振氢谱图中有三组峰证明含有3种不同化学环境的氢原子,B项正确;若A的化学式为C2H6O,由核磁共振氢谱图知该有机物分子中有三种不同化学环境的氢原子,且个数之比为1∶2∶3,推知A的结构简式为CH3CH2OH,C项错误;由核磁共振氢谱图中有三组峰以及峰面积之比可知其分子中不同化学环境的氢原子的个数比,D项正确。
10.[湖北汉川实验高中2021高二期中]研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是( )A.蒸馏常用于分离提纯液态有机混合物B.燃烧法是研究确定有机物成分的有效方法C.核磁共振氢谱通常用于分析有机物的相对分子质量D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团
【解析】蒸馏是利用互溶液态有机混合物中各成分的沸点相差较大而进行物质分离的方法,故A正确;利用燃烧法,能将有机物转化为简单无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素的质量分数,然后计算出该有机物分子所含元素原子最简单的整数比,即燃烧法是研究确定有机物成分的有效方法,故B正确;从核磁共振氢谱图上可以推知有机物分子有几种不同化学环境的氢原子及它们的数目比,不能确定有机物的相对分子质量,分析有机物的相对分子质量可以通过质谱图分析,故C错误;不同的化学键或官能团吸收频率不同,在红外光谱图上处于不同的位置,所以红外光谱图能确定有机物分子中的化学键或官能团,故D正确。
11.[江西高安中学2021高二期中]有机化合物A分子的质谱图如图所示。现将9.0 g有机化合物A在足量O2中充分燃烧,生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验,剩余气体为O2。下列有关说法正确的是( )A.从质谱图可看出,A的摩尔质量是45 g·ml-1B.A的实验式为C2H5OC.若A能与NaHCO3溶液反应放出气体,则它可能的结构有2种D.若A只含有一种官能团,则它可能的结构多于2种
【解析】从质谱图可看出,最大质荷比为90,A的摩尔质量是90 g·ml-1,故A错误;浓硫酸吸水,碱石灰吸收二氧化碳,分别增重5.4 g和13.2 g,5.4 g水的物质的量为 0.3 ml,n(H)=2n(H2O)=0.6 ml,13.2 g二氧化碳的物质的量为 =0.3 ml,n(C)=n(CO2)=0.3 ml,9.0 g A含O元素质量为9.0 g-0.6 g-0.3 ml×12 g·ml-1=4.8 g,n(O)= =0.3 ml,故n(C)∶n(H)∶n(O)=0.3 ml∶0.6 ml∶0.3 ml=1∶2∶1,即实验式为CH2O,故B错误;设分子式为(CH2O)n,A的相对分子质量为90,30n=90,解得n=3,故有机化合物A的分子式为C3H6O3,若A能与NaHCO3溶液反应放出气体,说明分子中含有羧基,则它可能的结构有CH3CH(OH)COOH、CH2(OH)CH2COOH、CH3OCH2COOH,不止2种,故C错误;若A只含有一种官能团,它可能的结构有 等,结构多于2种,故D正确。
12.某有机化合物经李比希法测得其含碳量为54.5%、含氢量为9.1%,其余为氧。用质谱法分析得知该有机化合物的相对分子质量为88。请回答下列有关问题:(1)该有机化合物的分子式为_____________。(2)若该有机化合物在水溶液中呈酸性,且结构中不含支链,则其核磁共振氢谱峰面积之比为____________;该物质与乙酸相比,在水中的溶解度更大的是________ (填名称),理由____________________________________。(3)若实验测得该物质不发生银镜反应,利用红外光谱仪测得该有机化合物分子的红外光谱如图所示。①该有机化合物的结构简式可能是_____________________、_____________________ (写出两种即可)。②写出其中一种与NaOH溶液反应的化学方程式:____________________________________________________。
丁酸中的憎水基比乙酸中的憎水基大
CH3COOCH2CH3
CH3CH2COOCH3
【解析】(1)由题给信息可知,1个有机化合物分子中C原子个数N(C)= ≈4,H原子个数N(H)= ≈8,O原子个数N(O)= ≈2,所以该有机化合物的分子式为C4H8O2。(2)若该有机化合物在水溶液中呈酸性,根据分子式C4H8O2可知,该有机化合物为饱和一元羧酸,且结构中不含支链,则其结构简式为CH3CH2CH2COOH,分子中含有4种化学环境的H原子,个数比为3∶2∶2∶1,则其核磁共振氢谱峰面积之比为3∶2∶2∶1; CH3CH2CH2COOH与乙酸相比,由于丁酸中的憎水基比乙酸中的憎水基大,丁酸在水中的溶解度比乙酸小。
(3)①实验测得该物质不发生银镜反应,则不含醛基或甲酸酯基,根据红外光谱图可知,该有机化合物中含有不对称的—CH3、C===O、C—O—C,该有机化合物的结构简式可能是CH3COOCH2CH3、 CH3CH2CH2COOH等;②其中一种与NaOH溶液反应的化学方程式为或
13.(双选)[江苏东台中学2021高二期中]有机化合物X是一种重要的有机合成中间体。为研究X的组成与结构,进行了如下实验:(1)有机化合物X的质谱图如图所示。(2)将10.0 g X在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。(3)经红外光谱测定,有机化合物X中含有醛基;有机化合物X的核磁共振氢谱图上有2个吸收峰,峰面积之比为3∶1。下列有关说法中正确的是( )A.该有机化合物X的分子式为C5H8O2 B.该有化合机物X的相对分子质量为55C.该有机化合物X的结构简式为HCO(CH2)3CHOD.与X官能团种类、数量完全相同的同分异构体还有3种
人教版 (2019)选择性必修3第一章 有机化合物的结构特点与研究方法第二节 研究有机化合物的一般方法课文内容课件ppt: 这是一份人教版 (2019)选择性必修3第一章 有机化合物的结构特点与研究方法第二节 研究有机化合物的一般方法课文内容课件ppt,共29页。PPT课件主要包含了项目拆解与规划,提纯葡萄糖,项目实践,李比希元素分析,提示异构化,项目成果,有序思维,模型认知等内容,欢迎下载使用。
人教版 (2019)选择性必修3第一章 有机化合物的结构特点与研究方法第二节 研究有机化合物的一般方法一等奖ppt课件: 这是一份人教版 (2019)选择性必修3第一章 有机化合物的结构特点与研究方法第二节 研究有机化合物的一般方法一等奖ppt课件,共32页。
人教版 (2019)选择性必修3第一章 有机化合物的结构特点与研究方法第二节 研究有机化合物的一般方法优秀ppt课件: 这是一份人教版 (2019)选择性必修3第一章 有机化合物的结构特点与研究方法第二节 研究有机化合物的一般方法优秀ppt课件,共28页。













