




还剩8页未读,
继续阅读
所属成套资源:科粤版化学九年级下册课件PPT送教案+视频全册
成套系列资料,整套一键下载
第七章 溶液 章末复习 课件
展开
这是一份第七章 溶液 章末复习 课件,共15页。
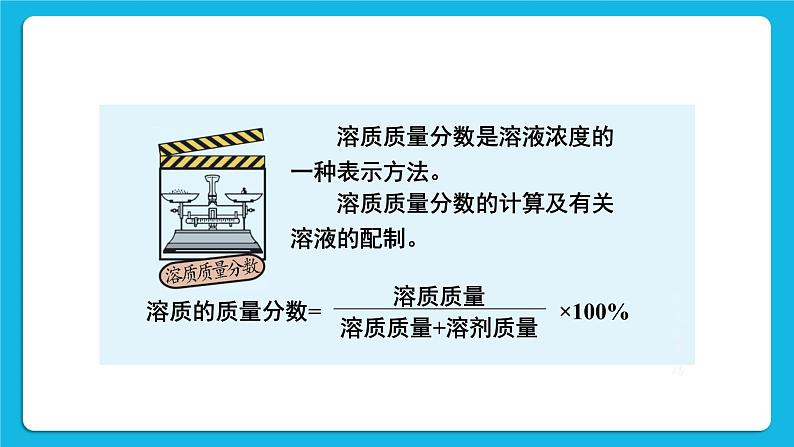
本章复习科粤版九年级化学下册 (1)溶液:由溶质和溶剂组成的透明、 均一、 稳定的混合物。 (2)饱和溶液: 一定温度下,一定量的溶剂里不能再溶解溶质的溶液。 (3)不饱和溶液:还能继续溶解溶质的溶液。 溶解度:在一定温度下,固态溶质在 100 g 溶剂中达到饱和状态时所溶解的质量。 溶质质量分数是溶液浓度的一种表示方法。 溶质质量分数的计算及有关溶液的配制。 形成晶体的过程叫结晶。 从粗盐中除去难溶杂质的步骤是:溶解—过滤—蒸发。 1. 下列物质中,前者是化合物,后者是溶液的是( ) A. 澄清的石灰水、 二氧化锰 B. 液氧、 稀硫酸 C. 蒸馏水、 冰水混合物 D. 氯化氢气体、 稀盐酸 D 2. 下列各项中, 前者一定大于后者的是 ( ) A. 20 ℃时 KNO3 的溶解度和 80 ℃时 KNO3 的溶解度 B. 30 ℃时 NaCl 不饱和溶液的质量分数和 NaCl 饱和溶液的质量分数 C. 100 g 15% 的硫酸溶液在 10 ℃的质量与 20 ℃的质量 D. NaOH 溶于水后溶液的温度和 NH4NO3溶于水后溶液的温度 D 3. 能证明某 KNO3 溶液在 20℃ 时已经达到饱和的方法是( ) A. 保持温度不变,向溶液中加入少量水,溶液变稀 B. 将该溶液升温,无晶体析出 C. 保持温度不变,向该溶液加入少量KNO3晶体,晶体不再溶解 D. 将该溶液降温到10℃时,有KNO3晶体析出C 4. 某溶液的溶质质量分数为 20%,加入 50 g 水后,变为 10%,则原溶液的质量为( ) A. 100 g B. 50 g C. 150 g D. 200gB 5. 下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。 ①20℃时,甲的溶解度____(填“>”“<”或“=”)乙的溶解度。 ②40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。<能 ③20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。请填写下表。固体逐渐减少至全部溶解固体逐渐增加 6. 小明要配制 100 g 溶质质量分数为 12% 的 NaCl 溶液,他的有关实验操作示意图如下: (1)配制过程中使用的四种玻璃仪器, 分别是广口瓶、 ______、______ 、 量筒。烧杯玻璃棒 (2)请你指出图中一处错误操作,并分析该操作可能造成的后果__________________________________________________________________________________。 (3)图②、 图③表示的操作步骤分别是____________。 (4)配制时需称量氯化钠______g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会______(填 “偏大” 或 “偏小”);量取水最好选择____的量筒(填序号①10 mL ②50 mL ③100 mL)。(水的密度为 1 g·cm-3) 称量时将物品和砝码位置放错,导致称量的氯化钠偏小,配制的溶液中溶质质量分数偏小。称量、溶解12偏小③1.从课后习题中选取;2.完成练习册本课时的习题。
本章复习科粤版九年级化学下册 (1)溶液:由溶质和溶剂组成的透明、 均一、 稳定的混合物。 (2)饱和溶液: 一定温度下,一定量的溶剂里不能再溶解溶质的溶液。 (3)不饱和溶液:还能继续溶解溶质的溶液。 溶解度:在一定温度下,固态溶质在 100 g 溶剂中达到饱和状态时所溶解的质量。 溶质质量分数是溶液浓度的一种表示方法。 溶质质量分数的计算及有关溶液的配制。 形成晶体的过程叫结晶。 从粗盐中除去难溶杂质的步骤是:溶解—过滤—蒸发。 1. 下列物质中,前者是化合物,后者是溶液的是( ) A. 澄清的石灰水、 二氧化锰 B. 液氧、 稀硫酸 C. 蒸馏水、 冰水混合物 D. 氯化氢气体、 稀盐酸 D 2. 下列各项中, 前者一定大于后者的是 ( ) A. 20 ℃时 KNO3 的溶解度和 80 ℃时 KNO3 的溶解度 B. 30 ℃时 NaCl 不饱和溶液的质量分数和 NaCl 饱和溶液的质量分数 C. 100 g 15% 的硫酸溶液在 10 ℃的质量与 20 ℃的质量 D. NaOH 溶于水后溶液的温度和 NH4NO3溶于水后溶液的温度 D 3. 能证明某 KNO3 溶液在 20℃ 时已经达到饱和的方法是( ) A. 保持温度不变,向溶液中加入少量水,溶液变稀 B. 将该溶液升温,无晶体析出 C. 保持温度不变,向该溶液加入少量KNO3晶体,晶体不再溶解 D. 将该溶液降温到10℃时,有KNO3晶体析出C 4. 某溶液的溶质质量分数为 20%,加入 50 g 水后,变为 10%,则原溶液的质量为( ) A. 100 g B. 50 g C. 150 g D. 200gB 5. 下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。 ①20℃时,甲的溶解度____(填“>”“<”或“=”)乙的溶解度。 ②40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。<能 ③20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。请填写下表。固体逐渐减少至全部溶解固体逐渐增加 6. 小明要配制 100 g 溶质质量分数为 12% 的 NaCl 溶液,他的有关实验操作示意图如下: (1)配制过程中使用的四种玻璃仪器, 分别是广口瓶、 ______、______ 、 量筒。烧杯玻璃棒 (2)请你指出图中一处错误操作,并分析该操作可能造成的后果__________________________________________________________________________________。 (3)图②、 图③表示的操作步骤分别是____________。 (4)配制时需称量氯化钠______g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会______(填 “偏大” 或 “偏小”);量取水最好选择____的量筒(填序号①10 mL ②50 mL ③100 mL)。(水的密度为 1 g·cm-3) 称量时将物品和砝码位置放错,导致称量的氯化钠偏小,配制的溶液中溶质质量分数偏小。称量、溶解12偏小③1.从课后习题中选取;2.完成练习册本课时的习题。
相关资料
更多









