

2022-2023学年福建省厦门市高三下册中考化学专项提升模拟题(AB卷)含解析
展开2022-2023学年福建省厦门市高三下册中考化学专项提升模拟题
(A卷)
考试时间75分钟,满分100分
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上.
2.答选一选时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选一选时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将答题卡交回。
可能用到的相对原子质量: S-32Fe-56 .
一.选一选(本题共15小题,每小题3分共45分,只有一项符合题目要求。)
1.下列说确的是
A.汽油可以燃烧,是因为它含有C、H、O三种元素
B.新冠德尔塔在空气中可能以气溶胶的形式传播,气溶胶属于胶体
C.“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能
D.医用口罩主要原料聚丙烯树脂,可由丙烯通过缩聚反应来合成
2.氮化铝(AlN)耐高温,可制作透明陶瓷。AlN与NaOH溶液可以反应,其化学方程式为:
AlN+NaOH+H2O=NaAlO2+NH3↑,下列化学术语正确的是
A.重水的分子式为H218O
B.NH3分子中N原子采用sp2杂化方式.
C. AlN晶体为分子晶体
D.水分子是由极性键构成的极性分子
3.下列关于蛋白质、核酸、脂肪及糖类物质的说确的是
A.蛋白质、核酸、脂肪及糖类在一定条件下都能水解,蛋白质水解的产物是氨基酸
B.核酸检测是确认类型的有效手段,核酸是一类含磷的高分子化合物
C.蛋白质、核酸、脂肪及糖类都是高分子化合物
D. (NH4)2SO4能使溶液中的蛋白质析出,加水后析出的蛋白质没有再溶解
4.下列反应的离子方程式书写正确的是
A.饱和食盐水与Ag2SO4固体反应: 2Cl-(aq)+Ag2SO4(s)2AgCl(s)+SO42- (aq)
B.用稀盐酸处理铜器表面的铜锈: CuO +2H+ =Cu2++ H2O
C. NaClO 溶液中滴入少量FeSO4溶液: Fe2+ +ClO-+2H+ =Fe3+ +Cl-+H2O
D. Na2S2O3 溶液中加入足量稀硝酸: S2O32- +2H+ =S↓+SO2↑+H2O
5.2022 北京“冰墩墩”、“雪容融”成为顶流。这些吉祥物是由PC、PVC、ABS和亚克力等环保材料制作而成。下列关于材料的说确的是
A. PC ( )中所有碳原子杂化方式均相同
B. PVC ( )的单体为氯乙烯,该单体的核磁共振氢谱图只有一组峰
C.ABS的单体之一苯乙烯属于苯的同系物
D.亚克力()的化学名称为聚甲基丙烯酸甲酯
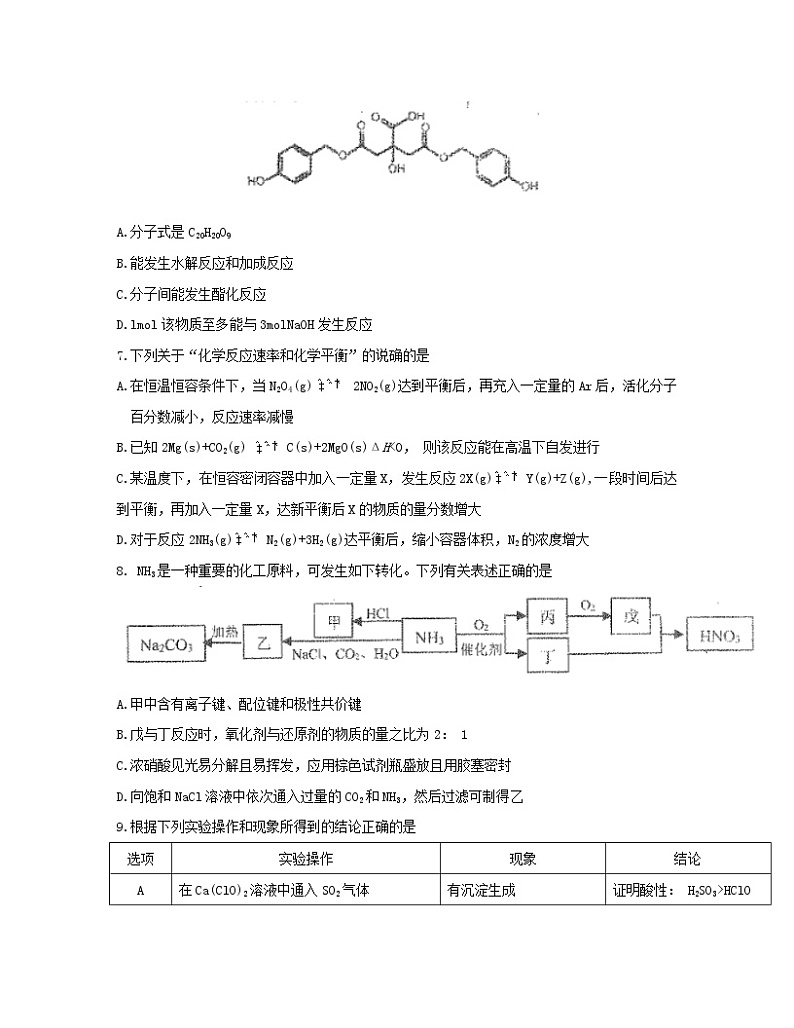
6.“柠檬酸酯D”是合成改善记忆、抗抑郁、抗衰老的的中间体,其结构简式如图所示,下列有关该物质的说法错误的是
A.分子式是C20H20O9
B.能发生水解反应和加成反应
C.分子间能发生酯化反应
D.lmol该物质至多能与3molNaOH发生反应
7.下列关于“化学反应速率和化学平衡”的说确的是
A.在恒温恒容条件下,当N2O4(g) 2NO2(g)达到平衡后,再充入一定量的Ar后,活化分子百分数减小,反应速率减慢
B.已知2Mg(s)+CO2(g) C(s)+2MgO(s)ΔH<0, 则该反应能在高温下自发进行
C.某温度下,在恒容密闭容器中加入一定量X,发生反应2X(g)Y(g)+Z(g),一段时间后达到平衡,再加入一定量X,达新平衡后X的物质的量分数增大
D.对于反应2NH3(g)N2(g)+3H2(g)达平衡后,缩小容器体积,N2的浓度增大
8. NH3是一种重要的化工原料,可发生如下转化。下列有关表述正确的是
A.甲中含有离子键、配位键和极性共价键
B.戊与丁反应时,氧化剂与还原剂的物质的量之比为2: 1
C.浓硝酸见光易分解且易挥发,应用棕色试剂瓶盛放且用胶塞密封
D.向饱和NaCl溶液中依次通入过量的CO2和NH3,然后过滤可制得乙
9.根据下列实验操作和现象所得到的结论正确的是
选项
实验操作
现象
结论
A
在Ca(ClO)2溶液中通入SO2气体
有沉淀生成
证明酸性: H2SO3>HClO
B
向5mL碘水中加入1mLCCl4振荡静置
上层无色,下层紫色
证明“相似相溶”
C
实验室将饱和食盐水滴在电石上,使生成的气体通入高锰酸钾溶液
溶液褪色
证明有乙炔生成
D
常温下,用pH计分别测定1mol/L和0.1 mol/L的醋酸铵溶液的pH
pH都等于7
证明醋酸铵溶液中水的
电离程度与其浓度无关
10.下图是Zn-空气二次电池(锌和铝的某些性质相似),电池内聚丙烯酸钠吸收了KOH溶液形成导电凝胶。下列说法错误的是
A.放电时,K+向PVC-RuO2电极移动
B.放电时,锌电极发生反应为Zn-2e- +4OH-=ZnO22-+2H2O
C.充电时,阳极附近pH减小
D.充电时,导线中每通过4mol电子,阴极产生224 (标况下)O2
11.某FexNy的晶胞如图1所示,晶胞边长为apm,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。 FexNy转化为两种Cu替代型产物的能量变化如图2所示,下列说法中正确的是
A.该FexNy的化学式为Fe2N
B.与N等距且最近的N为8个
C.两个a位置Fe的最近距离为apm
D.其中较稳定的Cu替代型产物的化学式为FeCu3N
12. M、X、Y、Z、W是原子序数依次增大的短周期元素,Z的一种单质具有漂白性。X和Y原子的最外层电子数之和等于W原了的最外层电子数。由这五种元索组成的化合物结构如图所示(箭头表示共用电子对由W
提供)。下列说法错误的是
A.电离能: Z>Y>X
B.W的氢化物的沸点低于Z的氢化物的沸点
C.X与W组成的化合物分子构型为三用锥形
D.该化合物的阴离子中所有元素原子都满足8电子稳定结构
13.右图中,甲、乙是两个完全相同的光伏并网发电模拟装置,利用它们对煤浆进行脱硫处理。下列叙述中错误的是
A.光伏并网发电装置中a为负极
B.石墨1上消耗1molMn2+,甲、乙中各转移0.5nol电子
C.脱硫反应原理为:15Mn3++ FeS2+8H2O= 15Mn2++Fe3++2SO42-+16H+
D.处理60gFeS2,石墨2上消耗7.5molH+
14.下面是探究外界条件对化学反应速率和化学平衡影响的图像,下列说确的是
A.图①若m+n=p, 則a曲线一定使用了催化剂
B.图②是在一定条件下,c(X)随时间t的变化,正反应ΔH<0,M点正反应速率
D.图④中曲线表示一定压强下NO平衡转化率随温度的变化, A、B、C三点表示没有同温度、压强下NO的平衡转化率,压强最小的是点B,化学平衡常数最小的是A点
15.乙醇胺为一元弱碱(25°C时,电离常数Kb=4.0×10-5)。其电离方程式为HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-。用0.1mol/L的盐酸滴定20mL0.1mol/L乙醇胺溶液,温度恒定在25°C时,滴定过程中由水电离出的c(H+)与滴加盐酸体积的关系如图所示(已知: lg5=0.7)。下列说法中错误的是
A. a点溶液的pH约为11.3
B. b点溶液中: c( HOCH2CH2NH2)>c(C1- )>c (HOCH2CH2NH3+)
C. c点两侧溶液均存在由水电离出的c(H+)=1×10-7mol/L
D. d点溶液中: c(Cl- )=2c(HOCH2CH2NH2)+2c(HOCH2CH2NH3+)
二、非选一选(本题共4小题,共55分)
16. (14分)某废钒渣(主要成分为V2O3,含有少量Al2O3、)为原料生产V2O5的工艺流程如图:
己知:钒酸(H3VO4)是强酸,NH4VO3难溶于水; +5 价钒在溶液中的主要存在形式与溶液pH的关系如表。
pH
4~6
6~8
8~10
10~12
主要离子
VO2+
VO3-
V2O74-
VO43-
(1 )向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为_。
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为
。
(3)己知加入石灰后生成Ca3(VO4)2沉淀,则加入石灰的作用是
。
(4)反应Ca3(VO4)2(s)+3CO32- (aq)2VO43- (aq)+3CaCO3(s)的平衡常数为
(用含m, n的代数式表示),已知: Ksp(CaCO3)=m, Ksp[Ca3(VO4)2]=n。
(5)沉钒2过程中加入氯化铵溶液,溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是
。
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1 mL cl mol ·L-1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知MnO4-被还原为Mn2+,假设杂质没有参与反应,则产品中V2O5的质量分数是____ (V2O5的摩尔质量为M g·mol-1)。
(7)下列操作会导致测定的纯度偏高的是_。
A.锥形瓶水洗后末干燥
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.滴定终点时俯视读数
D.滴定管用蒸馏水洗净后未用标准溶液润洗
17. (13分)合成氨反应N2(g)+3H2(g) 2NH3(g)是目前最有效的工业固氮方法,解决数亿人口生存问题。
(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用“ad”表示。
该历程中反应速率最慢步骤的化学方程式为。
(2)在t°C、压强为0.9MPa条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:
①反应20min达到平衡,试求0~20min内氨气的平均反应速率v(NH3)=__ MPa·min-1, 该反应的Kp=____ ( 保留小数点后两位)。(Kp为以分压表示的平衡常数)
②以下叙述能说明该条件下反应达到平衡状态的是。
a.氨气的体积分数保持没有变
b.容器中氢氮比保持没有变
c.气体平均相对分子质量保持没有变
d.气体密度保持没有变
③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中点(填“d”、
“e”、“f”或“g”)。
(3)利用催化剂通过电化学反应在室温下合成氨的原理如右图所示,该装置中阴极的电极反应式为。
(4)25°C时用氨水吸收甲酸可得到HCOONH4溶液。己知25°C时酸的电离常数Ka=1.75×10-5, NH3·H2O的电离常数Kb=2×10-5。计算反应NH3·H2O+HCOOHHCOO- +NH4++H2O 的平衡常数K=_。
l8. (14分)下面是实验室以NH3和CS2为原料模拟工业制备KSCN的装置。
已知: ①CS2密度比水大且难溶干水;
②NH3没有溶于CS2,但NH3、CS2、水和催化剂混合后可在加热条件下缓慢发生反应: CS2+3NH3
NH4SCN+NH4HS;
③NH4SCN在170°C以上时易分解;
④KSCN在水中的溶解度受温度影响较大
实验步骤: I. 确认装置气密性良好后,使三颈烧瓶下层的CS2没过导管口;
II.打开K1,点燃酒精灯,待观察到三颈烧瓶内液体没有分层时,熄灭酒精灯;待C中导管口无气泡产生时再关闭K1,保持三颈烧瓶恒温105°C一段时间,使NH4HS=NH3↑+H2S↑进行完全;
III.打开K2,滴入适量的KOH溶液,继续保持恒温105°C,制得KSCN。
(1)装置B中固体可以选用。
A.无水硫酸铜 B.生石灰C.碱石灰D.无水氯化钙
(2)C装置的作用是。
(3)操作III中,三颈烧瓶内发生的化学反应方程式.。
(4)E装置用来吸收___(填化学式),防止污染空气。
(5)从装置D中获取硫氰化钾晶体的操作:过滤除去三颈烧瓶中的固体催化剂,获取硫氰化钾粗品,再减压蒸发浓缩,,过滤,洗涤,干燥,可将硫氰化钾晶体纯化。
(6)测定KSCN纯度的操作:称取10.00g 样品,配成1000mL溶液。量取25. 00mL待测溶液于锥形瓶中,加入适量稀硝酸酸化,再加入几滴作指示剂。用AgNO3标准溶液滴定,当达到滴定终点时记录消耗AgNO3标准溶液数据,滴定终点的现象是__。[已知: SCN-+Ag+=AgSCN↓(白色)]。
19. (14 分)化合物M是一种医药中间体,有作用。实验室制备M的一种合成路线如图:
已知:① + H2O+
②RCN RCOOH
③
回答下列问题:
(1)M中含氧官能团的名称为_。
(2)A的结构简式为_____;B→C的反应类型为。
(3)E→F反应的化学方程式为;
(4)下列关于G的说确的是______ ( 填选项字母)。
A.处于同一平面的碳原子至多有13个
B.能发生酯化反应和缩聚反应
C.含有手性碳(连有四个没有同原子或基团的碳)
D.1molG至多与5molH2发生加成反应
(5)在I2的作用下,反应生成的有机物的结构简式为__。
(6)比化合物C少两个碳原子的同系物Q有多种同分异构体,符合下列条件Q的同分异构体有种。
(①除苯环外无其他环状结构
②能与Na反应生成氢气,没有能使FeCl3溶液显色;
③既能发生银镜反应,又能发生水解反应
化学答案
1B 2D 3B 4A 5D 6D 7D 8A 9B 10D
11C 12C 13B 14C 15B
16. (14 分,每空2分)
(1) +O2+V2O3 Ca(VO3)2
(2)Ca(VO3)2+4H+=Ca2++2VO2+ +2H2O
(3)调节溶液的pH值,并提供Ca2+形成Ca3(VO4)2沉淀
(4)
(5)当pH>8时,钒的主要存在形式没有是VO3-
(6)
(7)C
17. (13分,除标注外每空2分)
(1) Nad+3Had==NH ad+ 2Had(1分)
(2)①0.005 0.23 .
②acd
③g
(3) N2+6e-+6H+= 2NH3
(4) 3.5×104
18. (共14分,每空2分)
(1) BC
(2)通过观察产生气泡的快慢,以便调整生成氨气的速率
(3) NH4SCN+KOHKSCN+NH3↑+H2O
(4) NH3、H2S
(5)冷却结晶
(6) Fe(NO3)3溶液;半滴标准液滴入锥形瓶后,溶液由红色变为无色,且半分钟没有恢复原来颜色
19. (14分,每空2分)
(1)羧基、醚键、酮羰基
(2) 加成反应
(3)+CH3CHO+NaOH+2H2O
(4) ABD
(5)
(6) 4
2022-2023学年福建省厦门市高三下册中考化学专项提升模拟题
(B卷)
( 考试时间:75分钟)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Al—27 Cl—35.5 Co—59
一、 单项选一选:共14题,每题3分,共42分。每题只有一个选项题意。
1. “十四五”生态环保工作强调要落实“减污降碳”的总要求。下列说确的是( )
A. 在一定条件下,选择合适的催化剂将CO2氧化为甲酸
B. 推广使用煤液化技术,可减少二氧化碳等温室气体的排放
C. 向河水中加入明矾,可除去许多杂质并灭有害细菌
D. 人工合成淀粉技术的应用有助于实现“碳达峰”和“碳中和”
2. 反应COCl2+4NH3===CO(NH2)2+2NH4Cl可去除COCl2污染。下列化学用语表示错误的是( )
A. COCl2是极性分子 B. N2H4的电子式为
C. 二氧化硅的分子式为SiO2 D. CO(NH2)2只含共价键
阅读下列资料,完成3~5题。
二氧化硫是一种重要的化工原料,主要用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐等,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。二氧化硫的催化氧化是工业制硫酸的关键一步:2SO2(g)+O2(g)2SO3(g);ΔH=-196.6 kJ·mol-1,反应过程中的能量变化如图所示。
3. 下列有关二氧化硫的说确的是( )
A. SO2与SO3分子中硫原子的杂化方式相同
B. SO2的水溶液能导电,SO2是电解质
C. 将过量的SO2通入紫色石蕊溶液中,溶液变成无色
D. 向滴有酚酞的NaOH溶液中通入SO2后溶液褪色体现了二氧化硫的漂白性
4. 下列有关二氧化硫催化氧化反应的说确的是( )
A. 图中A表示2 mol SO2(g)的能量,C表示2 mol SO3(g)的能量
B. 充入过量O2、增大压强或降低温度,都能提高SO2的平衡转化率
C. 使用催化剂能改变Ea的大小,从而改变该反应的反应热
D. 反应2SO3(g)⇌2SO2(g)+O2(g)的活化能为196.6 kJ·mol-1
5. 实验室需制取少量SO2并验证其性质,下列实验装置能达到相应实验目的的是( )
6. 在指定条件下,下列含氮物质的转化没有能实现的是( )
A. NO2NO B. NH3NH4HSO4
C. Al3+AlO D. NH3N2
7. 短周期主族元素X、Y、Z、W、R的原子序数依次增加,X、Y、W位于没有同周期,原子序数:3Y=Z+R,常温下,X与Y可组成两种液体二元化合物。某种缓冲溶液的主要成分结构如图。
下列有关说法错误的是 ( )
A. 电解WZ溶液可制得WYX、Z2
B. 简单离子半径:Y>Z>W
C. W分别与X、Y组成的化合物均含离子键
D. 简单氢化物的沸点:Y>Z
8. 化工行业常用硒(Se)作催化剂,该催化剂具有反应条件温和、成本低、环境污染小、用后处理简便等优点。以铜阳极泥(主要成分为Cu2Se、Ag2Se,还含有少量Ag、Au、Pt等)为原料制备纯硒的工艺流程如图。
已知:① “净化除杂”时采用真空蒸馏的方法提纯硒(沸点为685 ℃);
② 焙烧后,Cu、Ag均以硫酸盐形式存在,Ksp(Ag2SO4)=1.4×10-5;
③ “浸出液”中溶质的饱和浓度没有小于0.01 mol·L-1;离子浓度小于10-5 mol·L-1时,认为没有含该离子。
下列说法错误的是( )
A. “加硫酸并焙烧”时使用的硫酸应为浓硫酸
B. “水吸收”过程得到的溶液呈酸性
C. 在实验室蒸馏时,需要用到直形冷凝管
D. “浸出液”中的溶质成分一定没有含Ag+和SO
9. 哌醋甲酯是一种中枢神经系统兴奋剂,如图为哌醋甲酯的结构。下列关于哌醋甲酯的说确的是( )
A. 1 mol哌醋甲酯至多与4 mol H2发生加成反应
B. 该有机物的一氯代物有12种
C. 该有机物既可以与盐酸反应,也可以和NaOH反应
D. 该分子中至少有8个碳原子共面
10. 利用无机物离子[(L)RuⅢ(H2O)]5-和[CeⅣ(NO3)6]2-(如图简写为CeⅣ),实现了水在催化剂作用下制氧气。用HO进行同位素标记实验,证明了产物氧气中的氧原子完全来自水。其相关机理如图所示。下列说法错误的是( )
A. CeⅣ在反应中作氧化剂
B. 催化氧化水的反应为2H2OO2↑+2H2↑
C. 进行同位素标记实验前需排尽体系中的空气
D. 若HO参与反应,则[(L)RuⅢOOH]6-中存在18O
11. 高电压水系锌—有机混合液流电池的装置如图所示。下列说法错误的是( )
A. 充电时,中性电解质NaCl的浓度增大
B. 放电时,负极反应式为Zn-2e-+4OH-===Zn(OH)
C. 充电时,1 mol FQH2转化为FQ转移2 mol电子
D. 放电时,正极区溶液的pH增大
12. 室温下,已知Ksp(CuS)=8.8×10-36,饱和Cu(OH)2溶液中x=-lg与pH的关系如右图所示。
向0.1 mol·L-1的Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说确的是( )
A. 室温下Ksp[Cu(OH)2]=2.2×10-18
B. 加入CuSO4晶体时,先生成Cu(OH)2沉淀
C. 室温下,CuS在等浓度的Na2S和H2S溶液中的Ksp相等
D. 反应后的溶液中存在离子浓度关系:c(Na+)+c(H+)+c(Cu2+)=c(S2-)+c(HS-)+c(OH-)+c(SO)
13. 已知:Ka1(H2SO3)=1.0×10-2、Ka2(H2SO3)=5.0×10-8。室温下,通过下列实验探究Na2SO3、NaHSO3溶液的性质。
实验1:用pH计测得某Na2SO3和NaHSO3混合溶液的pH为7。
实验2:将等体积、等物质的量浓度的Na2SO3和NaHSO3溶液混合,无明显现象。
实验3:向Na2SO3溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向NaHSO3溶液中滴加足量Ba(OH)2溶液,产生白色沉淀。
下列说确的是( )
A. 实验1混合溶液中=5.0×10-4
B. 实验2混合后的溶液中存在:3c(Na+)=2[c(SO)+c(HSO)+c(H2SO3)]
C. 实验3中随水的没有断加入,溶液中的值逐渐变小
D. 实验4中反应的离子方程式为Ba2++HSO+OH-===BaSO3↓+H2O
14. 在50%NiCeO2负载型金属催化作用下可实现CO2低温下甲烷化。发生的反应如下:
反应Ⅰ:CO2(g)+H2(g)===CO(g)+H2O(g);ΔH1=+41 kJ·mol-1
反应Ⅱ:CO2(g)+4H2(g)===CH4(g)+2H2O(g);ΔH2=-165 kJ·mol-1
反应Ⅲ: CO(g)+3H2(g)===CH4(g)+H2O(g);ΔH3=-206 kJ·mol-1
将CO2与H2按照一定流速通过催化氧化管,测得CO2的转化率与CH4的选择性[CH4选择性=×]随温度变化如图所示。下列说确的是( )
A. 反应Ⅱ的平衡常数可表示为K=
B. 其他条件没有变,增大压强可提高CH4的选择性
C. 其他条件没有变,升高温度,出口处甲烷的量一直增大
D. 在X(非平衡点)所示条件下延长反应时间没有能提高CO2的转化率
二、 非选一选:共4题,共58分。
15. (12分)MoS2作为石墨电极的改性剂没有仅能弥补石墨低容量的没有足,还可以有效解决自身稳定性和导电性没有佳的问题。以钼精矿(主要成分为MoS2,含SiO2、CuFeS2、CaCO3、PbS等杂质)为原料生产MoS2的工艺流程如图。
已知:① MoS2中S的化合价为-2价;
② 常温下PbCl2没有溶于水,但PbCl2可与Cl-反应,生成可溶性络合离子PbCl;
③ MoS2没有溶于水和常见酸碱,“烧熔”时可转化为酸性氧化物MoO3,“硫代”时生成MoS。
回答下列问题:
(1) 使用浓盐酸进行“初级酸浸”的工艺原理是盐酸与钼精矿中的CaCO3、PbS杂质发生反应,生成CaCl2、PbCl2,其中生成PbCl2的化学方程式为________。
(2) “氯盐浸出”的原理是利用具有强氧化性的FeCl3,在强酸性条件下氧化CuFeS2,使之生成CuCl2和S,该“氯盐浸出”过程的化学方程式为________。
(3) “碱浸”时使用氨水而没有使用NaOH溶液的原因是________。
(4) “碱浸”后滤液③的主要成分为________(填化学式)。
(5) “初级酸浸”、“碱浸”流程中操作温度没有宜过高的原因是________。
(6) 产品MoS2中存在极微量的非整比晶体杂质MoS2.8,则该杂质中Mo4+与MO6+物质的量之比为________。
16. (15分)环戊烷通过一系列反应得到化合物E(),合成路线如下图:
已知:
ⅱ. CH3CH2==CH2CH2CH3CH3COOH+CH3CH2COOH;
ⅲ. 反应⑤由2分子的C反应得到1分子的D。
(1) 反应①的条件是________________。
(2) C中碳的杂化类型是________________。
(3) D的结构简式为________________。
(4) 写出一种满足下列要求的E的同分异构体的结构简式:________________。
① 1 mol该有机物可以与足量NaHCO3反应生成4 mol CO2;
② 核磁共振氢谱显示有3组峰。
(5) 以为原料,设计路线合成,无机试剂任选。
17. (19分)Li2CO3可用于制备锂电池的正极材料LiCoO2,以某锂云母矿石(主要成分为Li2O,还有Al2O3、Fe2O3、MnO、MgF2等杂质)制备Li2CO3。
已知:① 有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5 mol·L-1)。
沉 淀
Al(OH)3
Fe(OH)2
Fe(OH)3
Co(OH)2
Mn(OH)2
Mg(OH)2
恰好完全沉淀时pH
5.2
8.8
3.2
9.4
9.8
11.1
② 部分物质的溶解度曲线见下图。
利用锂云母矿石制备Li2CO3步骤如下:
(1) 酸浸。向锂云母矿石中加入30%硫酸,加热至90 ℃,装置如上图所示。烧杯中试剂的作用是________。
(2) 调pH。向酸浸后的溶液中加入NaOH溶液,调节pH约为6,过滤。
再向滤液中继续滴加氢氧化钠溶液调pH>12,过滤,此时的滤渣主要成分为________________________。分两次调节pH的主要原因是________。
(3) 沉锂。将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入________杂质(填化学式)。
(4) Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:________________________________。
(5) CoC2O4·2H2O热分解可制备Co3O4。请补充完整由含c(Co2+)=0.1 mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验:_________________,干燥,得到CoC2O4·2H2O晶体。
(须使用的试剂:NaClO3,NaOH,AgNO3溶液,(NH4)2C2O4,蒸馏水)
(6) 为确定由CoC2O4·2H2O获得Co3O4的煅烧温度,准确称取4.575 g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385 ℃以上残留固体均为金属氧化物)。经测定,205~385 ℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积(写出计算过程,结果保留2位有效数字)。
18. (12分)硫酸厂产生的酸性废水中含有超标的H3AsO3,需处理达标后才能排放。目前含砷废水的处理常用石灰中和PFS、氧化吸附等方法。
(1) 石灰中和PFS法,处理过程如下:
含砷废水经氧化后,加入石灰,在相同时间内,废水中沉降的固体、砷的去除率与溶液pH的关系如图1所示。H3AsO4水溶液中含砷微粒的物质的量分布分数与pH的关系如图2所示。已知此温度下,Ca(H2AsO4)2溶于水,Ksp(FeAsO4)=5.7×10-21,Ksp[Ca3(AsO4)2]=6.8×10-19,Ksp(CaHAsO4)=8.4×10-4。
① 一级沉降时,当pH=2,废水中开始产生沉淀,该沉淀主要成分的化学式为____________。pH调节到8时,开始产生Ca3(AsO4)2沉淀,原因是_______________。
② 二级沉降中,保持溶液pH在8~10之间,加入PFS(聚合硫酸铁)形成的Fe(OH)3胶体粒子与含砷微粒反应可提高砷的去除率,其主要反应的离子方程式为____________。
(2) 氧化吸附法,新生态MnO2悬浊液具有较强的氧化性,能将As(Ⅲ)氧化为As(Ⅴ),也具有较强的吸附性,已知常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。pH没有同时,新生态MnO2悬浊液对砷去除率如图3所示。
图3
① 加入新生态MnO2悬浊液使废水中H3AsO3转化为H3AsO4,反应的离子方程式为________。
② 当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因:_______________________。
化学答案
一、 单项选一选:共14题,每题3分,共42分。每题只有一个选项题意。
1. D 2. C 3. A 4. B 5. B 6. C 7. A 8. D 9. C 10. B 11. A 12. C 13. D 14.B
二、 非选一选:共4题,共58分。
15. (12分)
(1) PbS+2HCl(浓)===PbCl2+H2S(2分)
(2) CuFeS2+4FeCl3===CuCl2+5FeCl2+2S(2分)
(3) NaOH溶液会与二氧化硅反应,生成的硅酸根离子进入滤液③,从而使制得的MoS2没有纯(2分)
(4) (NH4)2MoO4(2分)
(5) 在“初级酸浸”中使用了浓盐酸,如果温度过高,浓盐酸大量挥发,没有利于反应进行;“碱浸”时使用氨水,也容易受热分解(2分)
(6) 1∶4(设1个MoS2.8中Mo4+与Mo6+的个数分别为x和y, 4x+6y-2×2.8=0、x+y=1,解得x=0.2,y=0.8,则杂质中Mo4+与Mo6+的物质的量之比为1∶4)(2分)
16. (15分)
(1) 氯气,光照(2分)
(2) sp2、sp3(2分)
(3) (3分)
(4 ) COOHCOOHCOOHCOOH(3分)
(5) (5分)
17. (19分)
(1) 吸收HF,防止污染空气(2分)
(2) ① Mg(OH)2、Mn(OH)2(2分)
② 防止铝元素转化为AlO,无法去除(2分)
(3) Na2SO4(2分)
(4) 6Li2CO3+4Co3O4+O212LiCoO2+6CO2(3分)
(5) 向浸出液中边搅拌加入适量NaClO3氧化Fe2+,再滴加NaOH溶液调节pH的范围至5.2~7.4除去Al3+、Fe3+。过滤,向滤液中加入(NH4)2C2O4溶液至没有再产生沉淀,过滤,用蒸馏水洗涤至取洗涤的滤液加入AgNO3溶液没有再出现沉淀为止(5分)
(6) n(CoC2O4·2H2O)==0.025 mol
CoC2O4·2H2O中m(H2O)=0.025 mol×2×18 g·mol-1=0.9 g
CoC2O4·2H2O中m(CoC2O4)=4.575 g-0.9 g=3.675 g
根据图中A点数据可知,A处的物质为CoC2O4
AB段发生反应的化学方程式为3CoC2O4+2O2===Co3O4+6CO2
V(O2)=×0.025 mol×22.4 L·mol-1≈0.37 L(其他合理计算步骤也给分)(3分)
18. (12分)
(1) ① CaSO4(2分)
pH增大,促进HAsO电离,使溶液中c(AsO)增大,pH调节到8时,Qc=c3(Ca2+)·c2(AsO)>Ksp[Ca3(AsO4)2],产生Ca3(AsO4)2沉淀(2分)
② Fe(OH)3+HAsO===FeAsO4+2OH-+H2O(2分)
(2) ① H3AsO3+MnO2+2H+===H3AsO4+Mn2++H2O(3分)
② pH=7~9,随pH升高,H2AsO转变为HAsO,吸附剂表面所带负电荷增多,静电斥力增加,吸附量下降(3分)
2022-2023学年福建省厦门市高一上册化学期末专项突破模拟题(AB卷)含解析: 这是一份2022-2023学年福建省厦门市高一上册化学期末专项突破模拟题(AB卷)含解析,共25页。试卷主要包含了实验过程中,下列说法正确的是,下列实验操作中正确的是,下列说法中不正确的是,下列说法正确的是,用NA表示阿伏伽德罗常数的值,影响气体体积的微观因素主要有等内容,欢迎下载使用。
2022-2023学年福建省厦门市高一下册化学期中专项突破模拟题(AB卷)含解析: 这是一份2022-2023学年福建省厦门市高一下册化学期中专项突破模拟题(AB卷)含解析,共25页。试卷主要包含了实验过程中,下列说法正确的是,下列实验操作中正确的是,下列说法中不正确的是,下列说法正确的是,用NA表示阿伏伽德罗常数的值,影响气体体积的微观因素主要有等内容,欢迎下载使用。
2022-2023学年陕西省安康市高一下册期末化学专项提升模拟题(AB卷)含解析: 这是一份2022-2023学年陕西省安康市高一下册期末化学专项提升模拟题(AB卷)含解析,共18页。试卷主要包含了如图是铜-锌原电池示意图,下列反应属于放热反应的是,以下关于甲烷的说法中,正确的是,下列说法不正确的是等内容,欢迎下载使用。













