

- 1.2.第1课时 原子结构与元素周期表 试卷 试卷 0 次下载
- 2.1第一节 共价键 试卷 试卷 0 次下载
- 3.第一节 物质的聚集状态与晶体的常识 试卷 试卷 0 次下载
- 3.第三节 金属晶体与离子晶体 试卷 试卷 0 次下载
- 3.第二节 分子晶体与共价晶体 试卷 试卷 0 次下载
人教版 (2019)选择性必修2第一节 共价键优秀第1课时当堂达标检测题
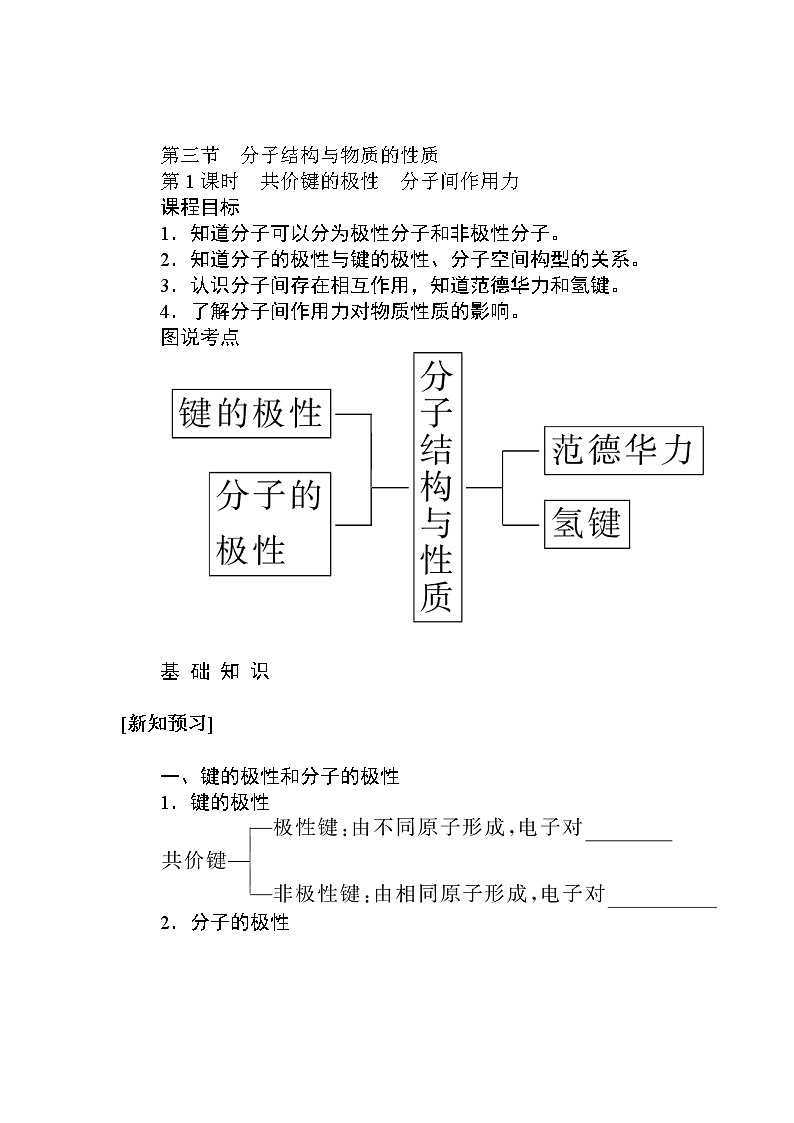
展开第三节 分子结构与物质的性质
第1课时 共价键的极性 分子间作用力
课程目标
1.知道分子可以分为极性分子和非极性分子。
2.知道分子的极性与键的极性、分子空间构型的关系。
3.认识分子间存在相互作用,知道范德华力和氢键。
4.了解分子间作用力对物质性质的影响。
图说考点
基 础 知 识
[新知预习]
一、键的极性和分子的极性
1.键的极性
2.分子的极性
3.键的极性和分子极性的关系
(1)只含非极性键的分子一定是________分子。
(2)含有极性键的分子有没有极性,必须依据分子中极性键的极性的________是否等于零而定,等于零时是________分子。
4.键的极性对化学性质的影响
(1)酸性:F3C—COOH______Cl3C—COOH________CH3COOH
(2)酸性:HCOOH________CH3COOH________CH3CH2COOH
二、范德华力及其对物质性质的影响
1.含义
范德华力是________之间普遍存在的相互作用力,它使得许多物质能以一定的凝聚态(固态和液态)存在。
2.特征
(1)范德华力很弱,比化学键的键能小________个数量级。
(2)无方向性和饱和性。
3.影响因素
(1)分子的极性越大,范德华力________。
(2)结构和组成相似的物质,相对分子质量越大,范德华力________。
4.对物质性质的影响
范德华力主要影响物质的________性质,如熔点、沸点;化学键主要影响物质的________性质。范德华力越大,物质熔、沸点________。
三、氢键及其对物质性质的影响
1.概念
已经与______很大的原子(如N、F、O)形成共价键的________与另一个________很大的原子之间的作用力。
2.表示方法
氢键通常用________表示,其中X、Y为________、________、________。“—”表示________,“…”表示形成的________。
3.分类
氢键可分为________氢键和________氢键两类。
存在________氢键,存在________氢键。前者的沸点________后者。
4.特征
氢键不属于化学键,属于一种较弱的作用力,比化学键弱,但比范德华力________。
5.氢键对物质性质的影响
氢键主要影响物质的熔、沸点,分子间氢键使物质熔、沸点________。
[即时性自测]
1.判断正误(正确的打“√”,错误的打“×”)
(1)极性分子中不可能含有非极性键。( )
(2)离子化合物中不可能含有非极性键。( )
(3)非极性分子中不可能含有极性键。( )
(4)一般极性分子中含有极性键。( )
(5)H2O、CO2、CH4都是非极性分子。( )
(6)分子间作用力是分子间相互作用力的总称。( )
(7)分子间氢键的形成使物质的熔、沸点升高。( )
(8)氢键属于分子间作用力。( )
(9)氢键是一种特殊的化学键,它广泛存在于自然界中。( )
(10)HF的沸点较高,是因为H—F键的键能很大。( )
2.下列叙述正确的是( )
A.含有非极性键的分子一定是非极性分子
B.非极性分子中一定含有非极性键
C.由极性键形成的双原子分子一定是极性分子
D.O2、O3均为非极性分子
3.下列各组物质中,都是由极性键构成的极性分子的一组是( )
A.CH4和H2O B.CO2和HCl
C.NH3和H2S D.HCN和BF3
4.下列各物质的酸性强弱关系正确的是( )
A.CH2Cl—COOH>CHCl2—COOH
B.CCl3—COOH
D.C17H35—COOH>C4H9—COOH
5.下列关于范德华力的叙述中,正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的区别是作用力的强弱问题
C.范德华力能够影响物质的化学性质和物理性质
D.范德华力非常微弱,故破坏分子间的范德华力不需要消耗能量
6.中科院国家纳米科学中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键说法中不正确的是( )
A.由于氢键的存在,HF的稳定性强于H2S
B.由于氢键的存在,乙醇比甲醚(CH3-O-CH3)更易溶于水
C.由于氢键的存在,沸点:HF>HI >HBr>HCl
D.由于氢键的存在,冰能浮在水面上
技 能 素 养
提升点一 键的极性与分子的极性
[例1] (1)①下列物质的分子属于非极性分子的是________(填序号)。
A.H2O B.CO2
C.SO2 D.BeCl2
②O3分子是否为极性分子?________(填“是”或“否”)。
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘的电子式是_________,它是由________键形成的________分子。
eq \x(状元随笔) 分子的极性不仅与键的极性有关,还与分子的空间结构有关。
[提升1] 在HF、H2O、NH3、CO2、N2、CH4分子中:
(1)以非极性键结合的非极性分子是__________。
(2)以极性键结合,具有正四面体结构的非极性分子是________
(3)以极性键结合,具有三角锥形结构的极性分子是________。
(4)以极性键结合,具有直线形结构的非极性分子是________________________________________________________________________。
(5)以极性键结合,具有V形结构的极性分子是________。
(6)以极性键结合,而且分子极性最大的是________。
eq \x(状元随笔) 判断ABn型分子极性的经验规律:
(1)若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子。
(2)若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
[关键能力]
键的极性和分子的极性
1.极性键和非极性键的区别
2.分子的极性与键的极性和分子立体构型的关系
eq \x(状元随笔) 判断常见分子极性的规律
提升点二 范德华力、氢键与共价健的比较
[例2] 下列说法不正确的是( )
A.HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B.H2O的熔、沸点高于H2S的熔、沸点是因为H2O分子间存在氢键
C.甲烷分子与水分子间可形成氢键
D.白酒中,乙醇分子和水分子间存在范德华力和氢键
eq \x(状元随笔) (1)分子间作用力不等同于范德华力,对某些分子来说,分子间作用力包括范德华力和氢键。
(2)氢键不是化学键,它分为分子间氢键和分子内氢键。
(3)氢键主要影响物质的物理性质,分子间氢键使物质的熔、沸点升高。
[提升2] 试用有关知识解释下列现象:
(1)乙醚(C2H5OC2H5)的相对分子质量大于乙醇,但乙醇的沸点却比乙醚高很多,原因是________________________________________________________________________
________________________________________________________________________。
(2)从氨合成塔里出来的H2、N2、NH3的混合物中分离NH3,常采用加压使NH3液化的方法,原因为________________________________________________________________________
________________________________________________________________________。
(3)水在常温下,其组成的化学式可用(H2O)m表示,原因是
________________________________________________________________________
________________________________________________________________________。
(4)水的沸点为100 ℃,但分解温度则需2000 ℃,原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
eq \x(状元随笔) 氢键大于范德华力,但远小于共价健。
[关键能力]
范德华力和氢键对物质性质的影响
1.化学键与范德华力的比较
2.范德华力、氢键、共价键的比较
eq \x(状元随笔) (1)氢键和范德华力都属于分子间作用力,分子间作用力的作用远小于化学键的键能,不能把氢键当成是化学键。
(2)分子间作用力主要影响由分子构成的物质的物理性质,而化学键主要影响物质的化学性质。
形成性自评
1.下列叙述中正确的是( )
A.离子化合物中不可能存在非极性键
B.非极性分子中不可能既含极性键又含非极性键
C.非极性分子中一定含有非极性键
D.不同非金属元素原子间形成的化学键都是极性键
2.下列分子是极性分子的是( )
A.PCl3 B.SO3
C.BF3 D.CS2
3.下列说法不正确的是( )
A.分子间作用力是分子间静电作用的总称
B.分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解、电离等也都有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛存在于自然界中
4.若不断地升高温度:实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的主要相互作用依次是( )
A.氢键;氢键和范德华力;极性键
B.氢键;氢键;非极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
5.用一带静电的有机玻璃棒靠近甲、乙两种纯液体流,现象如图所示,下列对甲、乙两种液体分子的极性的分析正确的是( )
A.甲是极性分子,乙是非极性分子
B.甲是非极性分子,乙是极性分子
C.甲、乙都是极性分子
D.甲、乙都是非极性分子
6.两种非金属元素A、B所形成的下列分子中一定属于极性分子的是( )
7.下列物质的性质可用范德华力的大小来解释的是( )
8.已知N、P同属于元素周期表的第ⅤA族元素,N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,三个氢原子位于锥底,N—H键间的夹角是107°。
(1)PH3分子与NH3分子的立体构型________(填“相似”或“不相似”),P—H键________(填“有”或“无”)极性,PH3分子________(填“有”或“无”)极性。
(2)NH3与PH3相比,热稳定性________(填化学式)更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________(填字母编号)。
A.键的极性N—H比P—H强
B.分子的极性NH3比PH3强
C.相对分子质量PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
eq \x(温馨提示:请完成课时作业8)
第三节 分子结构与物质的性质
第1课时 共价键的极性 分子间作用力
新知预习
一、1.发生偏移 不偏移
2.不重合 重合
3.非极性 向量和 非极性
4.(1)> >
(2)> >
二、1.分子
2.1~2/
3.越大 越大
4.物理 化学 越高
三、1.电负性 氢原子 电负性
2.X—H…Y— N O F 共价键 氢键
3.分子内 分子间 分子内 分子间 低于
4.强
5.升高
即时性自测
1.(1)× (2)× (3)× (4)√ (5)× (6)√ (7)√ (8)√ (9)× (10)×
2.答案:C
3.答案:C
4.答案:B
5.解析:范德华力的实质也是一种电性作用,但范德华力是分子间较弱的作用力,不是化学键,A项错误;化学键是微粒间的强烈的相互作用,范德华力是分子间较弱的作用力,B项正确;范德华力是一种分子间作用力,因此范德华力不会影响物质的化学性质,只影响物质的部分物理性质,C项错误;虽然范德华力非常微弱,但破坏它时也要消耗能量,D项错误。
答案:B
6.解析:HF的氢键存在于分子之间,与稳定性没有关系,HF的稳定性强于H2S是因为F的非金属性强于S,故A错误;乙醇分子可以与水分子形成氢键,所以乙醇比甲醚(CH3-O-CH3)更易溶于水,故B正确;组成和结构相似的物质,相对分子质量越大,熔沸点越高,HF分子间容易形成氢键,导致沸点:HF>HI >HBr>HCl,故C正确;由于氢键的存在,使得冰中的水分子间空隙变大,密度小于液态水,所以冰能浮在水面上,故D正确。
答案:A
技能素养
例1 解析:(1)①H2O、CO2、SO2、BeCl2,空间结构分别为:V形、直线形、V形、直线形,因此CO2和BeCl2分子结构对称,属于非极性分子,故选B、D。②根据价层电子对互斥理论分析SO2分子构型为V形,是极性分子,SO2分子与O3分子的结构相似,故O3也是极性分子。
(2)Ⅰ和Br的电负性相差不大,形成的化学键是极性共价键,电子式为,IBr中正电荷中心与负电荷中心不重合,属于极性分子。
答案:(1)①BD ②是 (2) 极性(共价) 极性
提升1 解析:同种元素的原子间形成的共价键为非极性键,由不同元素的原子形成的共价键为极性键;双原子分子中,共价键的极性越大,分子的极性越强;多原子分子的极性由空间构型的对称性决定。
答案:(1)N2 (2)CH4 (3)NH3 (4)CO2 (5)H2O (6)HF
例2 解析:HCl、HBr、HI的组成和结构相似,相对分子质量越大,分子间作用力越大,熔、沸点越高,A项正确;由于O原子的电负性大、半径小,所以H2O分子之间存在氢键,融化和汽化都需要克服氢键,所以氢键的存在使H2O的熔、沸点比H2S的高,B项正确;氢键是由已经与电负性很大的原子形成共价键的H原子与另一个电负性很大的原子之间的作用力,由于甲烷分子中C原子的电负性较小,所以甲烷分子和水分子间不能形成氢键,C项错误;乙醇分子和水分子间存在氢键和范德华力,D项正确。
答案:C
提升2 答案:(1)乙醇分子间形成的氢键作用远大于乙醚分子间的范德华力,故乙醇的沸点比乙醚的高很多
(2)NH3分子间可以形成氢键,而N2、H2分子间的范德华力很小,故NH3可采用加压液化的方法从混合物中分离
(3)常温下,液态水中水分子间通过氢键缔合成较大分子团,而不是以单个水分子形式存在,所以用( H2O)m表示
(4)水汽化只需克服分子间的范德华力和氢键,所以沸点只有100℃,而分解时要破坏氢与氧原子间强烈的共价键,所以分解温度很高
形成性自评
1.解析:过氧化钠是离子化合物,其中含有Oeq \\al(2-,2)中的非极性键,A错误;乙炔分子为非极性分子,含有极性键也含有非极性键,B错误;二氧化碳为非极性分子,只含有极性键而没有非极性键,C错误;因为不同非金属元素原子吸引电子能力不同,它们之间形成的共用电子对一定发生偏移形成极性键,D正确。
答案:D
2.解析:PCl3中P的最外层有5个电子,其化合价为+3价,中心原子的化合价的绝对值不等于原子的最外层电子数,属于极性分子,A符合题意;SO3中的S的最外层有6个电子,其化合价为+6,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,B不符合题意;BF3中B的最外层有3个电子,其化合价为+3,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,C不符合题意;CS2中C的最外层有4个电子,其化合价为+4,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,D不符合题意。
答案:A
3.解析:分子间作用力是分子间静电作用的总称,它包括氢键与范德华力,它的作用弱于化学键,但不属于化学键,它对物质熔、沸点,物质的溶解和电离等均有影响。
答案:D
4.解析:eq \x(雪花)eq \(――→,\s\up15(破坏),\s\d15(氢键))eq \x(水)eq \(――→,\s\up15(分子间距增大),\s\d15(范德华力、氢键被破坏))eq \x(水蒸气)eq \(――→,\s\up15(极性键被破坏))
eq \x(氢气、氧气)
答案:A
5.B 6.D 7.B
8.解析:(1)根据同主族元素最外层电子数相同,形成氢化物的结构相似,所以N原子与P原子结构相似,NH3分子与PH3分子结构也相似;不同原子之间形成的共价键为极性共价键,P—H键为不同种元素原子之间形成的共价键,为极性键;PH3分子与NH3相似,分子呈三角锥形,P原子位于锥顶,3个H原子位于锥底,分子中有1对孤电子对,分子的电荷分布不能呈中心对称,所以PH3分子是极性分子。
(2)由N、P在元素周期表中的位置和元素周期律知,非金属性N比P强,由元素的非金属性与氢化物之间的热稳定性关系知,NH3比PH3热稳定性强。
(3)“易液化”属于物质的物理性质,NH3与PH3都是分子晶体,其物理性质与化学键无关。按照相对分子质量与分子间作用力的关系和分子间作用力与物质的物理性质的关系分析,应该有PH3比NH3的沸点高,PH3比NH3易液化。而实际是NH3比PH3易液化,这种反常现象的客观存在必有特殊的原因,在NH3分子间存在着比范德华力较强的氢键,D项正确。
答案:(1)相似 有 有 (2)NH3 (3)D
极性键
非极性键
定义
共用电子对偏移的共价键
共用电子对不偏移的共价键
成键原子
不同
相同
共用电子对
发生偏移,偏向吸引电子能力强的原子一方
不发生偏移,不偏向任何一个原子
原子电性
一个呈δ+,另一个呈δ-
不显电性
举例
HCl、H2O、NH3
H2、O2、Cl2
化学键
范德华力
概 念
分子内相邻的原子间强烈的相互作用叫化学键
分子之间的相互作用力叫范德华力
存 在
分子内原子间
分子间(近距离)
强 弱
较强
比化学键弱得多
对性质的影响
主要影响物质的化学性质
主要影响物质的物理性质
范德华力
氢键
共价键
概念
物质分子之间普遍存在的一种相互作用力
已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力
原子间通过共用电子对所形成的相互作用
作用微粒
分子或原子(稀有气体)
氢原子、电负性很大的原子
原子
特征
无方向性,无饱和性
有方向性,有饱和性
有方向性,有饱和性
强度比较
共价键>氢键>范德华力
影响强度的因素
①随着分子极性的增大而增大
②由分子构成的,组成和结构相似的物质,相对分子质量越大,范德华力越大
X—H…Y中,X、Y的电负性越大,Y原子的半径越小,作用力越大
成键原子半径越小,键长越短,键能越大
对物质性质的影响
影响物质的熔点、沸点,溶解度等物理性质
影响物质的熔点、沸点、溶解度等物理性质
共价键的键能越大,分子越稳定
高中化学人教版 (2019)选择性必修2第一节 共价键精品第1课时练习题: 这是一份高中化学人教版 (2019)选择性必修2第一节 共价键精品第1课时练习题,共10页。
人教版 (2019)选择性必修2第一节 共价键精品第1课时练习: 这是一份人教版 (2019)选择性必修2第一节 共价键精品第1课时练习,共3页。试卷主要包含了下列叙述中正确的是等内容,欢迎下载使用。
化学选择性必修2第一节 共价键精品第1课时巩固练习: 这是一份化学选择性必修2第一节 共价键精品第1课时巩固练习,共5页。试卷主要包含了下列说法正确的是,下列关于粒子结构的描述正确的是,下列说法不正确的是,下列叙述正确的是等内容,欢迎下载使用。













