


湖南省衡阳市第六中学2022-2023学年高二上学期期末考试化学试卷(Word版含答案)
展开衡阳市第六中学2022-2023学年高二上学期期末考试
化学试题
注意事项:本试卷满分为100分,时量为75分钟
可能用到的相对原子质量:H-1,O-16,Cl-35.5,Cu-64
一、单选题(本题共10小题,每题3分,共30分,每小题的四个选项中只有一项符合要求)
1.化学与生产生活密切相关。下列叙述错误的是
A.碳酸钠溶液清洗油污时,加热可以增强去污效果
B.常用的白铁皮表面镀上了一层锌,采用的是牺牲阳极法
C.工业生产中,适当增大廉价的反应物的浓度有利于降低生产成本
D.“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转化成电能
2.下列解释事实的离子方程式正确的是
A.用碳酸氢钠治疗胃酸过多:CO+2H+=CO2↑+H2O
B.用氨水吸收烟气中的二氧化硫:SO2+2OH-=SO+H2O
C.向硫酸氢钠溶液中,逐滴加入Ba(OH)2溶液至中性:Ba2++ 2OH-+ 2H++ SO= BaSO4↓+2H2O
D.碳酸氢铵溶液中加入足量氢氧化钡溶液:NH+HCO+2OH-=CO+NH3·H2O+H2O
3.H2和O2在钯的配合物离子[PdCl4]−的作用下合成H2O2,反应历程如图,下列说法不正确的是
A.该过程的总反应为H2+O2H2O2 B.[PdCl2O2]2−在此过程中作为催化剂
C.生成1molH2O2的过程中,转移电子总数为2mol D.历程中发生了Pd+O2+2Cl− =[PdCl2O2]2−
4.有机物是制备镇痛剂的中间体。下列关于该有机物的说法错误的是
A.与环己烷互为同分异构体 B.一氯代物有五种(不考虑立体异构)
C.所有碳原子可能处于同一平面 D.能与酸性高锰酸钾溶液发生氧化反应
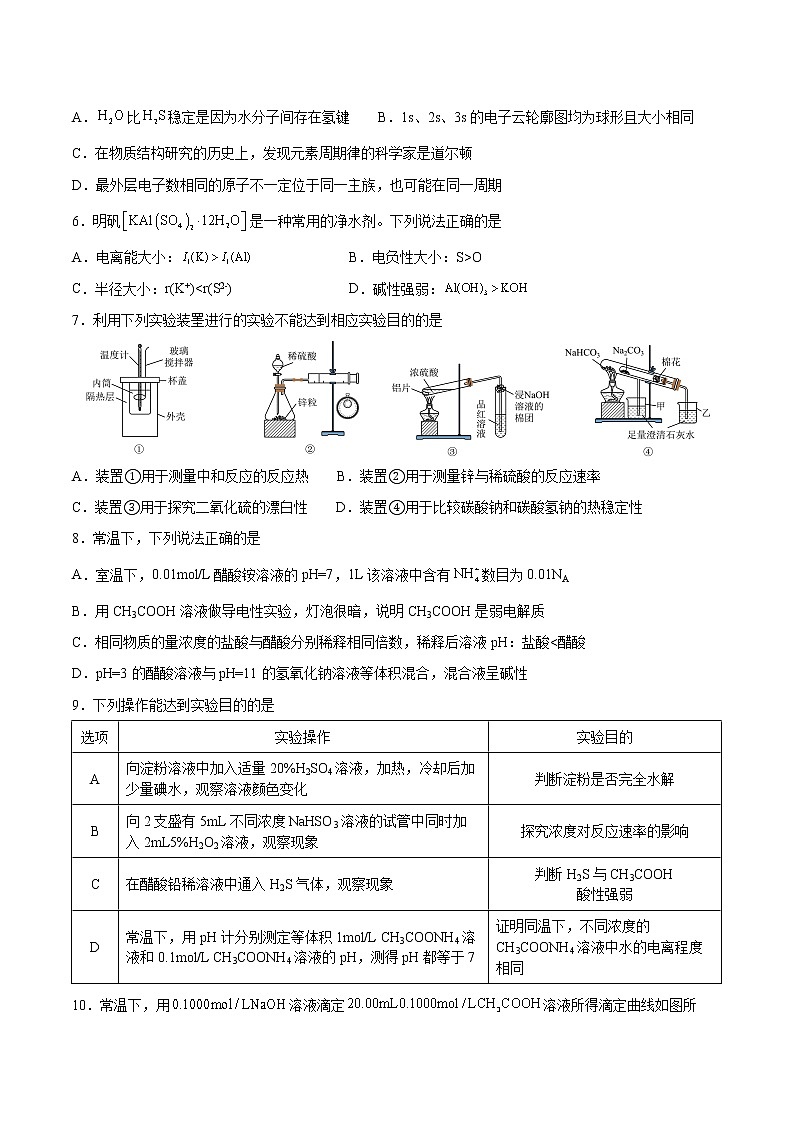
5.下列说法正确的是
A.比稳定是因为水分子间存在氢键 B.1s、2s、3s的电子云轮廓图均为球形且大小相同
C.在物质结构研究的历史上,发现元素周期律的科学家是道尔顿
D.最外层电子数相同的原子不一定位于同一主族,也可能在同一周期
6.明矾是一种常用的净水剂。下列说法正确的是
A.电离能大小: B.电负性大小:S>O
C.半径大小:r(K+)<r(S2-) D.碱性强弱:
7.利用下列实验装罣进行的实验不能达到相应实验目的的是
A.装置①用于测量中和反应的反应热 B.装置②用于测量锌与稀硫酸的反应速率
C.装置③用于探究二氧化硫的漂白性 D.装置④用于比较碳酸钠和碳酸氢钠的热稳定性
8.常温下,下列说法正确的是
A.室温下,0.01mol/L醋酸铵溶液的pH=7,1L该溶液中含有数目为0.01NA
B.用CH3COOH溶液做导电性实验,灯泡很暗,说明CH3COOH是弱电解质
C.相同物质的量浓度的盐酸与醋酸分别稀释相同倍数,稀释后溶液pH:盐酸<醋酸
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合,混合液呈碱性
9.下列操作能达到实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向淀粉溶液中加入适量20%H2SO4溶液,加热,冷却后加少量碘水,观察溶液颜色变化 | 判断淀粉是否完全水解 |
B | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察现象 | 探究浓度对反应速率的影响 |
C | 在醋酸铅稀溶液中通入H2S气体,观察现象 | 判断H2S与CH3COOH 酸性强弱 |
D | 常温下,用pH计分别测定等体积1mol/L CH3COONH4溶液和0.1mol/L CH3COONH4溶液的pH,测得pH都等于7 | 证明同温下,不同浓度的CH3COONH4溶液中水的电离程度相同 |
10.常温下,用溶液滴定溶液所得滴定曲线如图所示。下列说法正确的是
A.点①所示溶液中:
B.点②所示溶液中:
C.点③所示溶液中:
D.滴定过程中可能出现
二、不定项选择题(本题共4小题,每题4分,共16分,每小题有有一个或两个选项符合题目要求。全部选对得4分,选对但不全的得2分,有错的得0分)
11.已知液氨的性质与水相似。T℃时,NH3+NH3⇌+,的平衡浓度为1×10-15mol·L-1,则下列说法中正确的是
A.在此温度下液氨的离子积为1×10-17
B.在液氨中放入金属钠,不可生成NaNH2
C.恒温下,在液氨中加入NH4Cl,可使液氨的电离平衡逆向移动
D.降温,可使液氨电离平衡逆向移动,且c()<c()
12.用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
A.配制标准溶液的固体KOH中混有NaOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
13.一种微生物燃料电池如图所示,下列关于该电池说法正确的是
A.a电极为正极,发生还原反应 B.由左室通过质子交换膜进入右室
C.当b电极上产生时,溶液有通过 D.该电池在高温情况下无法正常工作
14.25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是
A.a点溶液满足:c(NH)>c(NH3·H2O)>c(Mg2+)>c(OH-) B.b点溶液中无Mg(OH)2沉淀产生
C.c点溶液满足:2c(Mg2+)+c()>c(Cl-) D.Ksp[Mg(OH)2]的数量级是10-12
三、填空题(本题共4小题,共54分)
15.(14分,每空2分)回答下列问题:
(1)肼分子可视为分子中的一个氢原子被(氨基取代形成的另一种氮的氢化物。
①分子中中心原子的价层电子对数为________;分子中氮原子轨道的杂化类型是________。
②肼可用作火箭燃料,燃烧时发生的反应是
若该反应中有4mol 键断裂,则形成的键有___________mol。
(2)第VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①基态Se原子的价电子轨道表示式为___________。
②的酸性比___________(填“强”或“弱”)。气态为___________分子(填“极性”或“非极性”),的空间结构为___________。
16.(10分,每空2分)科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。
(1)已知:CH4、CO、H2的燃烧热分别为890.3kJ·mol-1、283.0kJ·mol-1、285.8kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=_______。
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),ΔH<0,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2h平均反应速率v(H2)=__________。
②该温度下CO2的平衡转化率为__________。
③达到平衡后,改变下列条件,能够提高CO2转化率的是__________。
A.加入催化剂 B.压缩体积 C.升高温度 D.分离出水蒸气
(3)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=___________MPa-2 (计算结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
17.(14分,每空2分)按照要求回答下列问题。
(1)在强碱性条件下用电解法除去废水中的,装置如图所示,阳极和阳极区依次发生的反应有:
i.
ii.
iii.
除去,外电路中至少需要转移_______mol电子。
(2)为了使电解池连续工作,需要不断补充NaCl及_______。(填化学式)
(3)用NaOH溶液吸收烟气中的,将所得的溶液进行电解,可循环再生NaOH,同时得到,其原理如下图所示(电极材料为石墨)。
①图中a极要连接电源的_______填“正”或“负”)极,C口流出的物质是_______。
②放电的电极反应式为_______。
(4)用零价铁(Fe)去除水体中的硝酸盐()已成为环境修复研究的热点之一、Fe还原酸性水体中的的反应原理如图所示。
①作负极的物质是_______。
②正极的电极反应式是_______。
18.(16分,每空2分)常温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净的CuCl2溶液,宜加入_______(填化学式)调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_______mol/L。
(2)过滤后,将所得滤液经过_______、_______操作,可得到CuCl2·2H2O晶体。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O=S4O+2I-)。
①可选用_______作指示剂,滴定终点的现象是_______。
②CuCl2溶液与KI反应的离子方程式为_______。
③该试样中CuCl2·2H2O的质量百分数为_______。(精确到小数点后一位)
湖南省衡阳市重点中学2023-2024学年高二上学期开学考试化学试题(Word版含答案): 这是一份湖南省衡阳市重点中学2023-2024学年高二上学期开学考试化学试题(Word版含答案),文件包含2022级高二第一学期开学考化学docx、2022级高二第一学期开学化学考试答案pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
2022-2023学年湖南省衡阳市第八中学高二上学期期末考试化学试题(解析版): 这是一份2022-2023学年湖南省衡阳市第八中学高二上学期期末考试化学试题(解析版),共17页。试卷主要包含了5,Cu-64, 化学与生产生活密切相关, 有机物是制备镇痛剂的中间体, 明矾是一种常用的净水剂, 常温下,下列说法正确的是, 下列操作能达到实验目的的是等内容,欢迎下载使用。
湖南省嘉禾县第六高级中学2022-2023学年高二上学期期末考试化学试题(Word版含答案): 这是一份湖南省嘉禾县第六高级中学2022-2023学年高二上学期期末考试化学试题(Word版含答案),文件包含化学试卷docx、化学参考答案pdf等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。












