
天津市实验中学滨海学校2022-2023学年高三上学期期中质量调查化学试题
展开2022-2023年度第一学期高三年级期中质量调查(化学)试卷
满分:100分 时长:60min
第I卷(选择题)
一、单选题(每题3分,共36分)
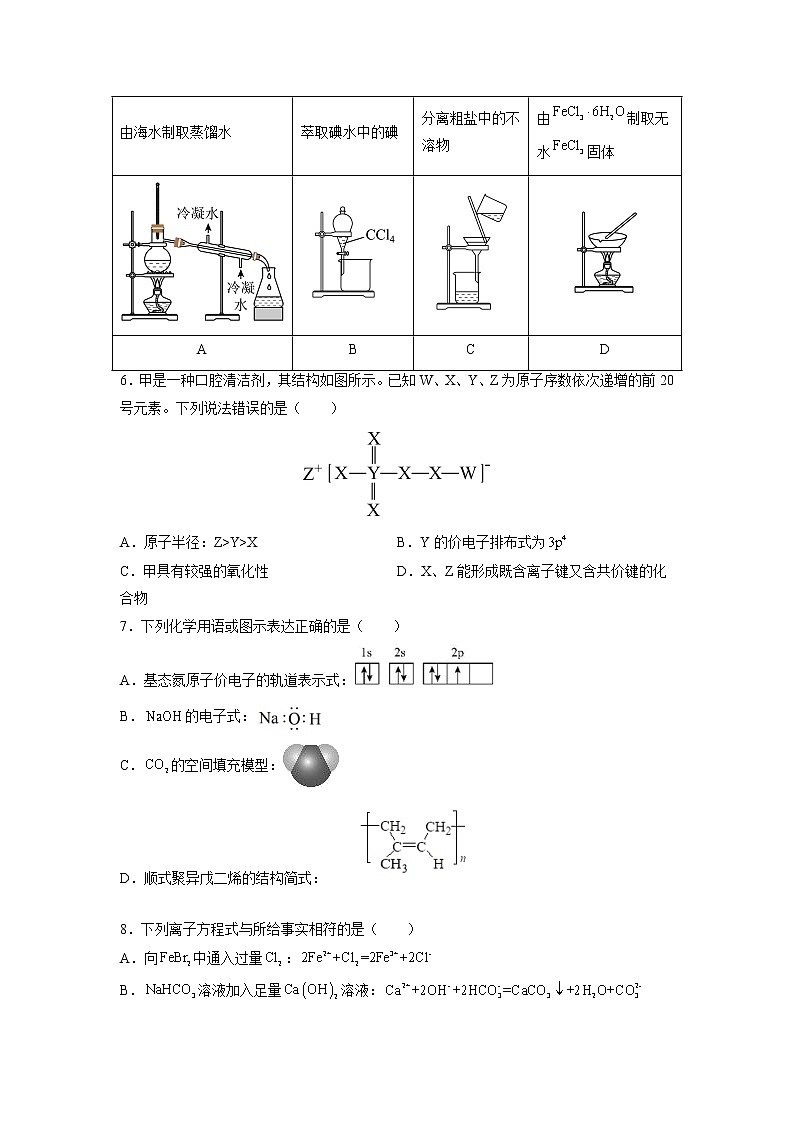
1.中华文化源远流长、博大精深,河北省馆藏文物是中华文化的重要代表。下列文物主要是由硅酸盐类材料构成的是( )
文物 | ||||
藏品 | 河北省博物馆中的长信宫灯 | 邯郸博物馆中的文字缸 | 邢台博物馆中的汉错金四神几何纹长颈铜壶 | 保定博物馆中的汉代铜马 |
选项 | A | B | C | D |
2.化学与生产生活息息相关,下列说法正确的是( )
A.用热的纯碱溶液可清洗衣物上的汽油污渍
B.二氧化硫有毒,禁止用作食品添加剂
C.新冠疫苗使用的中硼硅玻璃瓶含有的是一种复杂的氧化物
D.硫酸工业中,利用热交换器预热反应物,可降低能耗提高生产效率
3.2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
4.适时推动沧州市海兴核电站项目有助于实现“双碳”目标,目前核电站主要通过铀—235的裂变反应释放的能量进行发电。其变化过程包括:。下列说法正确的是( )
A.上述变化过程属于化学变化 B.与的原子序数相差55
C.与互为同位素 D.Ba属于过渡金属元素
5.下列实验中,不能达到实验目的的是( )
由海水制取蒸馏水 | 萃取碘水中的碘 | 分离粗盐中的不溶物 | 由制取无水固体 |
A | B | C | D |
6.甲是一种口腔清洁剂,其结构如图所示。已知W、X、Y、Z为原子序数依次递增的前20号元素。下列说法错误的是( )
A.原子半径:Z>Y>X B.Y的价电子排布式为
C.甲具有较强的氧化性 D.X、Z能形成既含离子键又含共价键的化合物
7.下列化学用语或图示表达正确的是( )
A.基态氮原子价电子的轨道表示式:
B.的电子式:
C.的空间填充模型:
D.顺式聚异戊二烯的结构简式:
8.下列离子方程式与所给事实相符的是( )
A.向中通入过量:
B.溶液加入足量溶液:
C.铝溶于溶液:
D.和浓硫酸加热条件下反应:
9.下列实验操作与预期实验目的或所得实验结论一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
B | 向含有少量FeCl3的MgCl2溶液中加入足量MgO粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D | NaAlO2溶液与NaHCO3溶液混合,有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
10.下列物质混合后,因发生氧化还原反应使溶液减小的是( )
A.向溶液中加入少量溶液,生成白色沉淀
B.向和的悬浊液中通入空气,生成红褐色沉淀
C.向溶液中加入少量溶液,生成蓝绿色沉淀
D.向溶液中通入氯气,生成黄色沉淀
11.某化学实验探究小组用电磁搅拌加热器(温度最高可达65℃)加热饱和NaHCO3溶液,并利用CO2传感器检测溶液中CO2的含量,其含量随温度变化如图所示:
下列有关叙述错误的是( )
A.ab段溶液中CO2的含量降低的原因是温度升高,溶解的CO2气体逸出
B.bc段溶液中CO2的含量升高的原因是溶液中受热分解生成CO2气体
C.实验室可用加热饱和NaHCO3溶液的方法制取少量CO2气体
D.由图像可知,NaHCO3固体受热分解的温度为48.2℃
12.铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是Al2O3)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝。主要的工艺流程如图所示:
下列说法正确的是( )
A.碱溶①后,溶液中主要含有的阳离子为Na+和Al3+
B.酸化②通足量的CO2反应的离子方程式为:2+CO2+3H2O=2Al(OH)3↓+
C.Al(OH)3受热分解,生成高熔点物质和水,常用作塑料的阻燃剂
D.灼烧③一般在坩埚中进行,电解④添加冰晶石(Na3AlF6),目的是增强导电性
第II卷(非选择题)
13.(共16分)科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:
I.氯气的制备(装置如图所示)
(1)装置G的名称为_______,装置F的作用为_______。
(2)从图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为_______(填写仪器下方字母)。
II.漂白粉的制备( 装置如图所示)
查阅资料可知:①氯气与碱反应放出热量;
②6Cl2+6Ca(OH)2CaCl2+Ca(ClO3)2+6H2O。
(3)装置C中发生反应的化学方程式为_______。
(4)多孔球泡的作用是_______,使用冰水浴的目的是_______。
(5)测定装置C中Ca(ClO)2物质的量浓度的方法如下:取C中溶液10.0mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应ClO-+2I-+2H+=I2+Cl- +H2O。用0.1000 mol·L-1Na2S2O3标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴 Na2S2O3标准溶液时,其现象为_______达到滴定终点,此时消耗Na2S2O3溶液的体积为20.00mL。 (已知: I2+2S2O=2I- +S4O。该漂白粉溶液中Ca(ClO)2的物质的量浓度为_______mol/L。(保留4位有效数字)
14.(共12分)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________。Ti在元素周期表中的位置______________
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是__________;金属离子与氧离子间的作用力为__________,Ca2+的配位数是__________。
15.(共18分)你注意到汽车加油站内的标牌了吗?某些省市加油站提供的汽油标号由90号、93号换成了E90、E93,后者是在汽油中加入了10%的燃料乙醇而制得的乙醇汽油。
(一) 燃料乙醇的生产过程可由下图表示:
(1)粉碎玉米的目的是:___________________________________。
(2)生产过程中为了检验淀粉水解是否完全,可使用试剂是____________________。
(3)步骤a的操作是_____________________。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:_______。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n(淀粉)+nH2OnC6H12O6(葡萄糖),C6H12O62CH3CH2OH+2CO2↑
根据上述反应式,可以算出100kg淀粉理论上可生产无水乙醇________________kg。(相对原子质量:C-12 H-1 O-16)
(二)到目前为止,我国已有上百个城市使用乙醇汽油。
(6)为了便于区分燃料乙醇和食用乙醇,常在燃料乙醇中添加少量煤油,这里利用了煤油的物理性质是:_______________________________________。
(7)含10%乙醇的汽油在储存和运输过程中应特别注意防水,如果混入了水,汽油中会出现的现象是______________________________________________。
(8)右图是燃料乙醇的生产和消费过程示意图。虽然燃料乙醇的使用缓解了汽车能源的紧张状况,但仍存在一些问题。由此可知,燃料乙醇__________________
A.是最理想的绿色能源 B.提供的能量来自于太阳能
C.生产和消费过程对空气没有任何影响 D.生产过程中将消耗大量粮食,以避免粮食过剩
(9).除了燃料乙醇,二甲醚(CH3OCH3)和甲醇(CH3OH)也可作为汽车燃料,其中与乙醇互为同分异构体的是______________________________________。
16.(共18分)硫酸亚铁(FeSO4)是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是_______(填一种)。
(2)以FeSO4为原料可制备碱式硫酸铁[]、铁红、硫酸亚铁铵[,俗名摩尔盐],转化关系如图1所示。
①制备时,若过高会导致碱式硫酸铁的产率偏低,其原因是_______。
②制备时,向溶液中加入过量的溶液,该反应的离子方程式为_______;铁红的化学式为_______。
③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、_______、洗涤、干燥得到产品。
(3)隔绝空气条件下,分解时的物质转化关系如图2:
①关于M的成分提出三种猜想:
猜想1:M是;
猜想2:M是_______;
猜想3:M是和。
②已知三种气体的部分性质如表所示:
物质 | |||
熔点/℃ | 16.8 | -72.4 | -210 |
沸点/℃ | 44.8 | -10 | -195.8 |
利用图3装置探究硫酸亚铁部分分解产物。能否将低温浴槽A的温度控制在?_______(填“能”或“否”),理由是_______。C中试剂可能是_______。
2022-2023年度第一学期高三年级期中质量调查(化学)试卷
答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
B | D | B | C | D | B | D | C | B | D | D | C |
13.(1) 分液漏斗 除去Cl2中混入的HCl
(2)B→F→E→D→C
(3)
(4) 增大氯气和石灰乳的接触面积,提高吸收效率 避免副反应发生
(5) 当加入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,半分钟内溶液不再变为蓝色,说明滴定达到终点 0. 05000mol /L
14.
(1)1s22s22p63s23p63d24s2 第四周期第ⅡB族
(2) TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
(3) O>Ti>Ca 离子键 12
- (1)增大反应物的接触面积,从而加快反应速率或使反应进行的更充分
(2) 碘(I2)或碘酒
(3) C
(4) 制饮料、干冰、纯碱、碳酸钙(或其他碳酸盐或碳酸氢盐)等
(5) 56.8
(6) 煤油有特殊气味
(7) 混合燃料发生分层
(8) B
(9) 二甲醚或CH3OCH3
16.(1)加适量铁粉(或其他合理答案)
(2) 部分铁离子转化成 过滤
(3) 否 之间无法分离与,且易堵塞导管 碱石灰(或其他合理答案)
天津市实验中学滨海学校2023-2024学年高二上学期期中质量调查化学试题Word版含答案: 这是一份天津市实验中学滨海学校2023-2024学年高二上学期期中质量调查化学试题Word版含答案,文件包含高二化学调查试卷docx、高二期中答案pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
天津市实验中学滨海学校2023-2024学年高二上学期期中质量调查化学试题(Word版附答案): 这是一份天津市实验中学滨海学校2023-2024学年高二上学期期中质量调查化学试题(Word版附答案),共7页。试卷主要包含了答卷前,考生务必将自己的姓名等内容,欢迎下载使用。
天津市实验中学滨海学校2022-2023学年高一上学期期中质量调查化学试题(解析版): 这是一份天津市实验中学滨海学校2022-2023学年高一上学期期中质量调查化学试题(解析版),共9页。试卷主要包含了单选题等内容,欢迎下载使用。