




- 3.3.1盐类水解课件 课件 4 次下载
- 4.1.1 原电池课件 课件 4 次下载
- 4.1.2 化学电源课件 课件 5 次下载
- 4.2第二节电解池 课件 课件 5 次下载
- 第4章 化学反应与电能 实验活动4 课件 课件 4 次下载
人教版 (2019)必修 第一册第三节 化学键精品ppt课件
展开金属的腐蚀对国民经济带来的损失是惊人的,据一份统计报告,全世界每年由于腐蚀而报废的金属设备和材料,约相当于金属年产量的1/3。
指金属或合金与周围接触到的______或________发和生_________反应而腐蚀损耗的过程。
2.金属腐蚀的本质是什么?
是金属本身失去电子变成_______的过程(发生______反应)。
M - ne- = Mn+
3.金属腐蚀的类型有哪些?
金属跟接触到的物质(如SO2、Cl2、O2等)____发生化学反应而引起的腐蚀。
_____金属跟____________接触时,发生_______反应,比较________的金属失去电子发生氧化而被腐蚀。
——根据与金属接触的介质不同分:
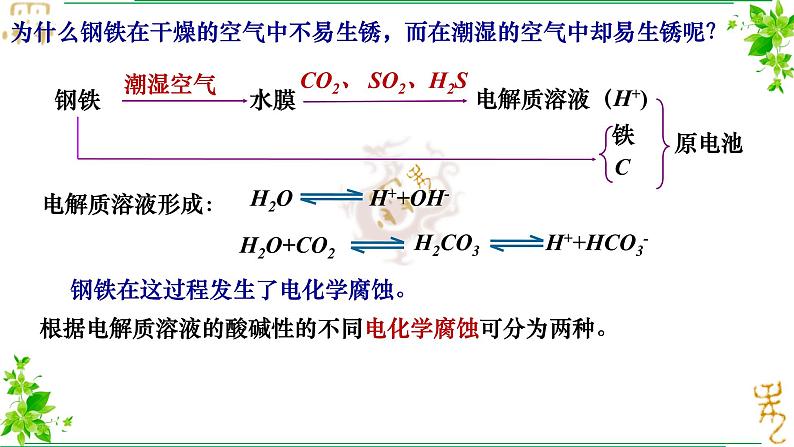
为什么钢铁在干燥的空气中不易生锈,而在潮湿的空气中却易生锈呢?
CO2、 SO2、H2S
钢铁在这过程发生了电化学腐蚀。
根据电解质溶液的酸碱性的不同电化学腐蚀可分为两种。
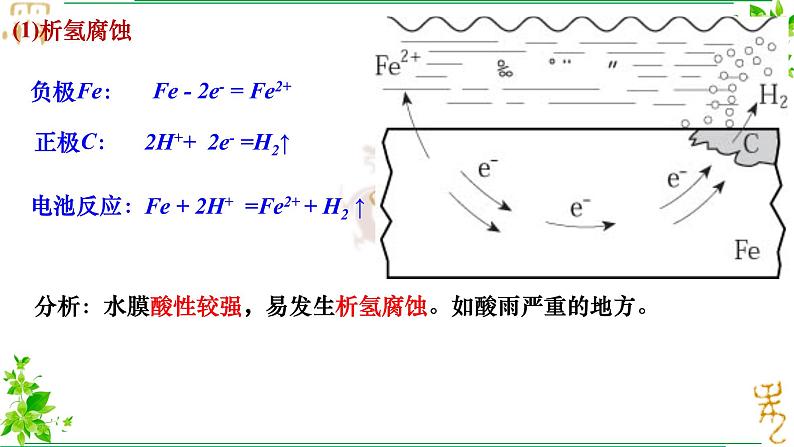
分析:水膜酸性较强,易发生析氢腐蚀。如酸雨严重的地方。
Fe - 2e- = Fe2+
2H++ 2e- =H2↑
Fe + 2H+ =Fe2+ + H2 ↑
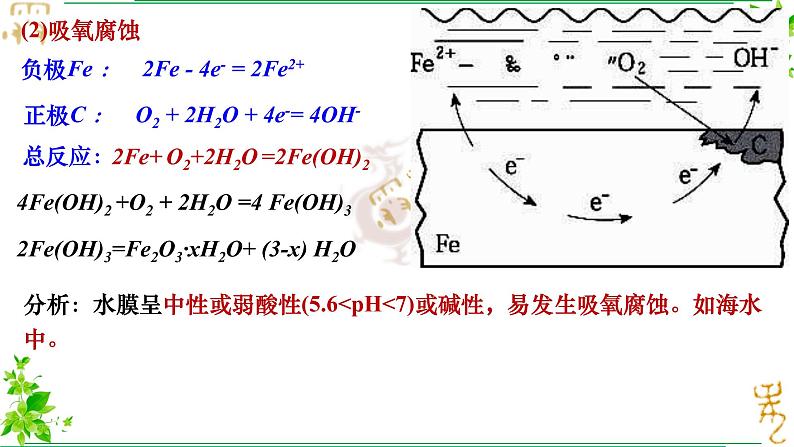
分析:水膜呈中性或弱酸性(5.6
2Fe - 4e- = 2Fe2+
O2 + 2H2O + 4e-= 4OH-
2Fe+ O2+2H2O =2Fe(OH)2
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
(1)导管中水面_______,形成一段________。
在中性条件下,铁钉发生吸氧腐蚀,消耗具支试管中的氧气,使具支试管内气压减小,水被压入导管形成水柱。
(2)加入CuSO4溶液的试管生成H2的速率______。
被Zn置换出来的Cu与Zn、稀盐酸构成很多微小的原电池,发生原电池反应,使生成H2的速率加快。
化学腐蚀与电化腐蚀的比较
不纯金属或合金跟电解质溶液接触
两者往往同时发生,电化学腐蚀更普遍,更快
1.改变金属材料的组成
在金属中添加其他金属或非金属可以制成生能优异的合金。
如:①把铬、镍加入普通钢中制成不锈钢产品;②钛合金不仅具有优异的抗腐蚀性,不具有良好的生物相溶性。
2.在金属表面覆盖保护层
在金属表面覆盖致密的保护层,将金属物品与周围物质隔开是一种普遍采用的防护方法。
如:①在钢铁制品的表面喷涂油漆、矿物性油脂或覆盖搪瓷等;②用电镀等方法在钢铁表面镀上一层锌、锡、铬、镍等金属;③用化学方法在钢铁部件表面进行发蓝处理(烤蓝,生成一层致密的四氧化三铁薄膜);④利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化等。⑤采用离子注入、表面渗透镀等方式在金属表面也可以形成稳定的钝化膜等。
白铁皮:锌比铁活泼,破损时与水膜构成原电池时,锌作负极失电子被氧化而腐蚀,铁作正被保护。
马口铁:铁比锡活泼,破损时与水膜构成原电池时,铁作负极失电子被氧化而易腐蚀。
金属发生电化学腐蚀时,总是作为原电池的___极(___极)的金属被腐蚀,作为___极(___极)的金属不被腐蚀。因此,可以将要保护的金属作__极(___极),则该金属就不会被腐蚀。
1.牺牲阳极(负极)法
在钢铁设备上装上(或连接)若干___合金或___块,它们比铁活泼作___极(____极),不断被腐蚀,作___极(___极)的钢铁被保护.
Zn-2e-=Zn2+
锌片、铁片酸化的氯化钠溶液构成原电池,锌为阳极(负极)失电子,被腐蚀,铁为阴极(正极)被保护。
Fe2++K3[Fe(CN)6]=KFe [Fe(CN)6]↓+2K+
缠有锌片的铁钉周周围只出现红色,缠有铜片的铁钉铜片周围出现红色,同时铁钉周围出现蓝色沉淀。
Fe-2e-=Fe2+
结论:不同金属构成原电池发生电化学腐蚀时,较活泼金属的被腐蚀,相对不活泼的金属被保护。
将要保护的钢铁设备作为___极,用惰性电极作为辅助___极,两者均存在于______溶液里,接外加_____电源。通电后,____被强制流向被保护的钢铁设备,使钢铁表面腐蚀_____降至零或接近于零,钢铁设备被迫成为阴而受到保护。
比被保护金属活泼(本身不断被腐蚀)
惰性材料(只起导电作用,本身不被腐蚀)
一般而言,外加电流法比牺牲阳极法保护效果更好。
金属的电化学腐蚀与防护
牺牲阳极(负极)的阴极(正极)保护法
1.下列试管中盛放的都是饱和食盐水。讨论下图几种情况,铁的腐蚀由快到慢的顺序是:______________
(4)(3)(1)(2)(5)
牺牲阳极(Zn)保护阴极(Fe)
牺牲阳极(Fe)保护阴极(Cu)
外加电流,腐蚀阳极(Fe)保护阴极(Cu)
外加电流,腐蚀阳极(Cu)保护阴极(Fe)
2.下列关于金属腐蚀的叙述正确的是( )A.金属被腐蚀的本质是B.马口铁(镀锡铁)镀层破损后,首先是镀层被氧化C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀D.常温下,置于空气中的金属主要发生化学腐蚀
3.下列金属防腐的措施中,属于牺牲阳极法的是( )A.水中的钢闸门连接电源的负极B.金属护栏表面涂漆C.汽车底盘喷涂高分子膜 D.地下钢管连接锌板
A.图1中,铁钉易被腐蚀B.图2中,滴加少量 溶液,没有蓝色沉淀出现C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
4.下列叙述正确的是( )
5.图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法正确的是( )
A.图Ⅰ中b为纯铜,电解过程中质量减轻,发生的反应为Cu2++2e-=CuB.图Ⅰ中SO42-向a极移动,但不放电C.图Ⅱ中如果a、b间用导线连接时,钢闸门作正极D.图Ⅱ中如果a、b间连接直流电源利用外加电流法保护钢闸门时,则X必须用锌
6. 港珠澳大桥的设计使用寿命高达120年,主要的防腐方法有:①钢梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不合理的是( )A.防腐涂料可以防水、隔离O2,降低吸氧腐蚀速率B.防腐过程中铝和锌均作为牺牲阳极,失去电子C.钢铁发生吸氧腐蚀时的负极反应式为Fe-3e-===Fe3+D.方法①②③只能减缓钢铁腐蚀,未能完全消除
7. 对金属制品进行抗腐蚀处理可延长其使用寿命。(1)以下为铝材表面处理的一种方法:
以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_____________________________。取少量废电解液,加入NaOH溶液直至过量,先生成白色沉淀,后沉淀又溶解,则说明废电解液中含的离子是______。(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________________________________________________________。(3)利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学保护法称为_____________。
2Al+3H2O-6e-=Al2O3+6H+
溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定
化学第四章 化学反应与电能第三节 金属的腐蚀与防护试讲课课件ppt: 这是一份化学第四章 化学反应与电能第三节 金属的腐蚀与防护试讲课课件ppt,文件包含新人教版化学选择性必修一43金属的腐蚀与防护课件pptx、新人教版化学选择性必修一43金属的腐蚀与防护针对练习含解析docx、新人教版化学选择性必修一43金属的腐蚀与防护教案doc等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护优质课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护优质课ppt课件,共29页。PPT课件主要包含了基础巩固,能力提升等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护精品课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护精品课件ppt,共39页。PPT课件主要包含了知识梳理,正误判断,问题导学,核心突破,试题调研,课后作业等内容,欢迎下载使用。














