





2022年高考总复习 化学 模块2 第四单元 第2节 原电池的工作原理及其应用课件PPT
展开原电池的工作原理及其应用
原电池是把________转化为________的装置,其反应本质是______________。
(1)一看反应:看是否有能自发进行的____________反应发生(一般是活泼性强的金属与电解质溶液反应)。(2)二看两电极:一般是____________不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:
①____________溶液;
②两电极直接或间接接触;③两电极插入____________溶液中。
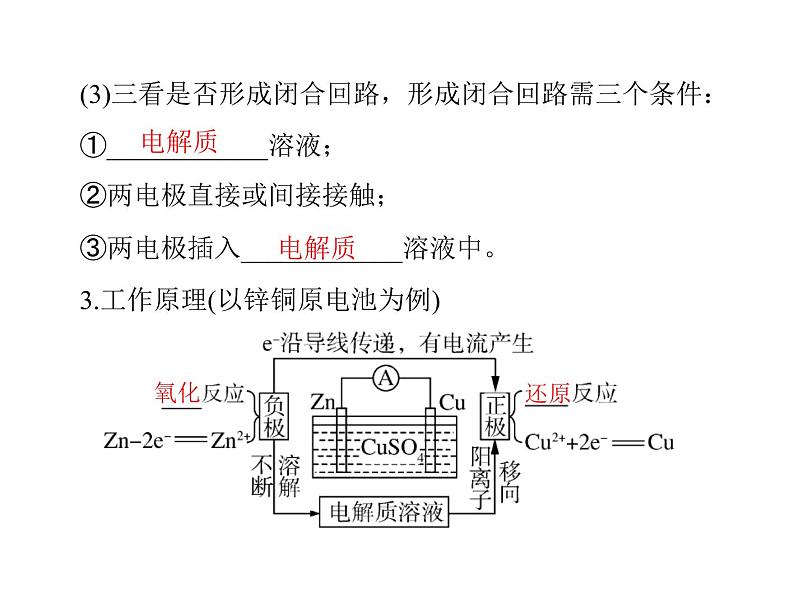
3.工作原理(以锌铜原电池为例)
发生_______反应。
流出经外电路流入______。(3)离子移动方向
总反应离子方程式为Zn+Cu2+===Zn2++Cu
①负极:_____电子,发生_____反应;②正极:_____电子,
(2)电子定向移动方向和电流方向①电子从_____流出经外电路流入_______;②电流从_____
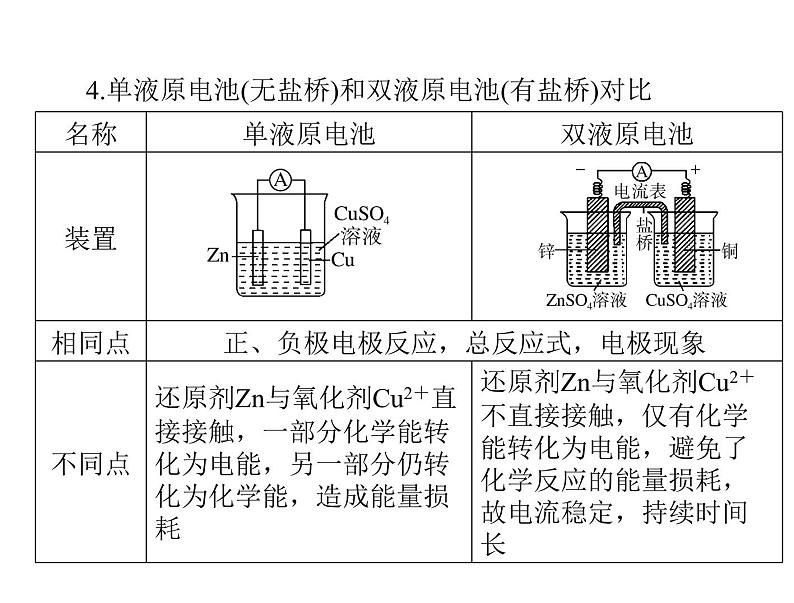
4.单液原电池(无盐桥)和双液原电池(有盐桥)对比
5.原电池在化工、农业生产及科学研究中的应用(1)加快氧化还原反应速率一个自发的氧化还原反应,设计成原电池时反应速率________,例如,Zn 与稀硫酸反应时加入少量的 CuSO4 溶液能
使产生氢气的速率加快。
(2)比较金属活动性强弱两种金属分别作原电池的两极时,一般作负极的金属活动性比正极的______。
被保护的金属制品作原电池的______极而得到保护。例如,保护铁制输水管或钢铁桥梁,可用导线将其和一锌块相连,使Zn 作原电池的____极。(4)设计制作化学电源①首先将氧化还原反应分成两个半反应。②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
如根据反应 2FeCl3+Cu===2FeCl2+CuCl2 设计的原电池为
[ 自主测评 ]1.易错易混辨析(正确的画“√”,错误的画“×”)。(1)因为铁的活泼性强于铜,所以将铁、铜用导线连接后放
入浓硝酸中组成原电池,必是铁作负极、铜作正极(
(2)在原电池中,正极本身一定不参与电极反应,负极本身
(3)一般来说,带有“盐桥”的原电池比不带“盐桥”的原
4OH-===AlO2 +2H2O(
(4)将自发的氧化还原反应设计成原电池,可以把物质内部
的能量全部转化为电能(
(5)某原电池反应为 Cu+2AgNO3===Cu(NO3)2+2Ag,装置
中的盐桥内可以是含 KCl 饱和溶液的琼胶(
(6)在 Mg-NaOH(aq)-Al 电池中,负极反应为 Al-3e-+
2.【深度思考】依据氧化还原反应:2Ag+(aq)+Cu(s)===
(aq) +2Ag(s) 设计的原电池如图所示 ( 盐桥为盛有饱 和
KNO3 溶液琼胶的 U 形管)。请回答下列问题:
(1)电极 X 的材料是________;电解质溶液 Y 是________(填化学式)。(2)银电极为电池的________极,其电极反__________。
答案:(1)Cu AgNO3溶液 (2)正 Ag++e-===Ag (3)Cu(NO3)2
(1)原电池中盐桥的三个作用:①连接内电路形成闭合回路;②维持两电极电势差(中和电荷),使电池能持续提供电流;③单液原电池(无盐桥)中有部分Zn 与Cu2+直接反应,使电池效率降低;双液原电池(有盐桥)中使Zn 与Cu2+隔离,电池效率提
(2)原电池中微粒移动的三个方向
解析:金属M失去电子,作电池负极,A正确;OH-向负极移动,因为电解质传递OH-,所以电解质不可能是熔融的MO,B错误;氧气在正极发生得到电子的还原反应,正极的电极反应:O2+2H2O+4e-===4OH-,C正确;根据以上分析可知电池反应:2M+O2+2H2O===2M(OH)2,D正确。 答案:B
原电池正、负极的判断方法
含盐桥的原电池与电极反应书写
3.(2020 年菏泽模拟)根据下图,下列判断中正确的是(
A.烧杯a中的溶液pH降低 B.烧杯b中发生氧化反应 C.烧杯a中发生的反应为2H++2e-===H2↑ D.烧杯b中发生的反应为2Cl--2e-===Cl2↑ 解析:由题给原电池装置可知,电子经过导线,由Zn电极流向Fe电极,则O2在Fe电极发生还原反应:O2+2H2O+4e-===4OH-,烧杯a中c(OH-)增大,溶液的pH升高;烧杯b中,Zn发生氧化反应:Zn-2e-===Zn2+。 答案:B
解析:根据氧化还原反应方程式可知,氧化剂是 KMnO4,故 a 为正极,b 为负极,A 错误;a 为正极,b 为负极,电子沿外电路从负极流向正极,即电子从 b 流向 a,B 错误;原电池工作时,阴离子流向负极,即乙烧杯,C 错误;a 电极为正极,
5.(2020 年淄博模拟)有 a、b、c、d 四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属的活动性顺序是(
A.a>b>c>dC.d>a>b>c
B.b>c>d>aD.a>b>d>c
解析:把四个实验从左到右分别编号为①、②、③、④,则由实验①可知,a 作原电池负极,b 作原电池正极,金属活动性:a>b;由实验②可知,b 极有气体产生,c 极无变化,则金属活动性:b>c;由实验③可知,d 极溶解,则 d 作原电池负极,c 作正极,金属活动性:d>c;由实验④可知,电流从 a极流向 d 极,则 d 极为原电池负极,a 极为原电池正极,金属活动性:d>a。综上所述可知金属活动性:d>a>b>c。答案:C
2Fe2+ +I2,设计成盐桥原电池。提供的试剂:
6. 某校化学兴趣小组进行探究性活动,将氧化还原反应
FeCl3 溶液,KI 溶液;其他用品任选。请回答下列问题:(1)请在下方虚线框中画出设计的原电池装置图,并标出电极材料、电极名称及电解质溶液。
(2) 发生氧化反应的电极反应式为________________________________________________________________________。(3)反应达到平衡时,外电路导线中________(填“有”或
(4)平衡后向 FeCl3 溶液中加入少量 FeCl2 固体,当固体全部溶解后,则此时该溶液中电极变为______(填“正”或“负”)极。
解析:(1)先分析氧化还原反应,找出正、负极反应,即可确定正、负极区电解质溶液。(2)发生氧化反应的电极是负极,I-失电子。(3)反应达到平衡时,无电子流动,故无电流产生。(4)平衡后向 FeCl3 溶液中加入少量 FeCl2 固体,平衡逆向移动,此时 Fe2+失电子,正极变成负极。答案:(1)
(2)2I--2e-===I2 (3)无 (4)负
2.二次电池(以铅蓄电池为例)铅蓄电池是最常见的二次电池,总反应为
Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l)
-2e===PbSO4(s)
PbSO4(s)+2e-===
(1)氢氧燃料电池是目前最成熟的燃料电池。
(2)燃料电池的电极本身不参与反应,燃料和氧化剂连续地
2H2-4e-===4H+
2H2+4OH--4e-===4H2O
O2+4H++4e-=== 2H2O
O2+2H2O+4e-===4OH-
[ 自主测评 ]1.易错易混辨析(正确的画“√”,错误的画“×”)。(1)碱性锌锰电池是一次电池,其中 MnO2 是催化剂,可使
锌锰电池的比能量提高、可储存时间延长(
(2)铅蓄电池放电时,正极与负极质量均增加(
(3)铅蓄电池放电时,当电路中转移 0.1 ml 电子时,负极
(4)燃料电池工作时燃料在电池中燃烧,然后热能转化为电
2.【深度思考】Li-SOCl2 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是 LiAlCl4-SOCl2。电池的总反应可表示为 4Li+2SOCl2===4LiCl+S+SO2↑。
(1)电池的负极材料为________(填化学名称),发生的电极
反应为____________________________。
(2)电池正极发生的电极反应为____________________。
解析:分析反应的化合价变化,可知Li失电子,被氧化,为还原剂,SOCl2得电子,被还原,为氧化剂。(1)负极材料为Li(还原剂),发生的电极反应为4Li-4e-===4Li+。(2)正极反应式可由总反应式减去负极反应式得到:2SOCl2+4e-===4Cl-+S↓+SO2↑。 答案:(1)锂 4Li-4e-===4Li+ (2)2SOCl2+4e-===4Cl-+S+SO2↑
解液。下列叙述错误的是(
1.(2020 年青岛一模)水系锌离子电池是一种新型二次电池,工作原理如下图。该电池以粉末多孔锌电极(锌粉、活性炭及粘结剂等)为负极,V2O5 为正极,三氟甲磺酸锌[Zn(CF3SO3)2]为电
A.放电时,Zn2+向 V2O5 电极移动B.充电时,阳极区电解液的浓度变大
C.充电时,粉末多孔锌电极发生还原反应
D.放电时,V2O5 电极上的电极反应式为 V2O5+xZn2++
2xe-===ZnxV2O5
解析:放电时,阳离子向正极移动,所以Zn2+向V2O5电
极移动,A 正确;充电时,阳极区发生氧化反应,锌离子通过阳离子交换膜向左移动,所以阳极区电解液的浓度变小,B错误;充电时,粉末多孔锌电极为阴极,发生还原反应,C正确;放电时 , V2O5 电极上的电极反应式为V2O5 + xZn2+ +2xe-===ZnxV2O5,D 正确。
2.(2019 年抚顺一模)有一种新型二次电池,其放电时的工作原理如图所示,电池两极区用阳离子交换膜隔开,下列说法
示,下列说法错误的是(
3.(2020 年宁阳一中期中)直接煤-空气燃料电池原理如图所
A.随着反应的进行,氧化物电解质的量不断减少
C.电极 X 为负极,O2-向 X 极迁移
D.直接煤—空气燃料电池的能量效率比煤燃烧发电的能量
列关于电池工作时的相关分析不正确的是(
4.(2020 年南宁第二次适应性测试)DBFC 燃料电池的结构如图,该电池的总反应为 NaBH4+4H2O2===NaBO2+6H2O。下
B.Y 极发生的还原反应为 H2O2+2e ===2OH
A.X 极为正极,电流经 X 流向外电路
C.X 极区溶液的 pH 逐渐减小D.每消耗 1.0 L 0.50 ml·L-1 的 H2O2,电路中转移 1.0 ml e-
燃料电池解题模板及审题关键
1.(2020 年新课标Ⅰ卷)科学家近年发明了一种新型 Zn-CO2水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体 CO2 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
3.(2020 年山东卷)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以 NaCl 溶液模拟海水,采用惰性电极,用图中装置处
A.负极反应为 CH3COO-+2H2O-8e-===2CO2↑+7H+B.隔膜 1 为阳离子交换膜,隔膜 2 为阴离子交换膜
C.当电路中转移 1 ml 电子时,模拟海水理论上除盐 58.5 gD.电池工作一段时间后,正、负极产生气体的物质的量之
结合电荷守恒可得电极反应式为 CH3COO +2H2O - 8e
解析:a 极为负极,CH3COO-失电子被氧化成 CO2 和 H+,
===2CO2↑+7H+,A 正确;为了实现海水的淡化,模拟海水中的氯离子需要移向负极,即 a 极,则隔膜 1 为阴离子交换膜,钠离子需要移向正极,即 b 极,则隔膜 2 为阳离子交换膜,B错误;当电路中转移 1 ml 电子时,根据电荷守恒可知,模拟海水中会有 1 ml Cl-移向负极,同时有 1 ml Na+移向正极,
即除去1 ml NaCl,质量为58.5 g,C正确;b极为正极,水溶液为酸性,所以氢离子得电子产生氢气,电极反应式为2H++2e-===H2↑,所以当转移8 ml电子时,正极产生4 ml气体,根据负极反应式可知负极产生2 ml气体,物质的量之比为4∶2=2∶1,D正确。 答案:B
(1)电池负极电极反应式为____________________;放电过程中需补充的物质 A 为_________________________________(填化学式)。
(2) 如 上图所示的HCOOH 燃料电 池放 电的本质是通过HCOOH 与 O2 的反应,将化学能转化为电能,其反应的离子方程式为___________________________________________。
5.(2020 年新课标Ⅰ卷节选)为验证不同化合价铁的氧化还
原能力,利用下列电池装置进行实验。
(1)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择________作为电解质。
因此,验证了Fe2+氧化性小于________,还原性小于
_____________________________________________________。(5)实验前需要对铁电极表面活化。在 FeSO4 溶液中加入几滴 Fe2(SO4)3 溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_____________________________________________________________________________。
高中化学人教版 (2019)选择性必修1第一节 原电池完美版课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 原电池完美版课件ppt,共35页。PPT课件主要包含了“升失氧降得还”,电极材料,电子流向,电极反应,电极现象,溶液中离子流向,活泼金属,电子流入,电子流出,还原反应等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 原电池优质课课件ppt: 这是一份人教版 (2019)选择性必修1第一节 原电池优质课课件ppt,共32页。PPT课件主要包含了基础巩固,能力提升等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 原电池优质ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 原电池优质ppt课件,共41页。PPT课件主要包含了第一节原电池,知识梳理,正误判断,问题导学,核心突破,试题调研,课后作业等内容,欢迎下载使用。












