




- 3.1 《晶体与非晶体》(第一课时) 课件 课件 11 次下载
- 3.2 《共价晶体》 (第二课时)课件 课件 13 次下载
- 3.2 《分子晶体 》(第一课时)课件 课件 13 次下载
- 3.3 《 离子晶体 过渡晶体与混合型晶体 》(第二课时)课件 课件 13 次下载
- 3.3 《金属键与金属晶体 》(第一课时)课件 课件 11 次下载
高中化学人教版 (2019)选择性必修2第四节 配合物与超分子完美版ppt课件
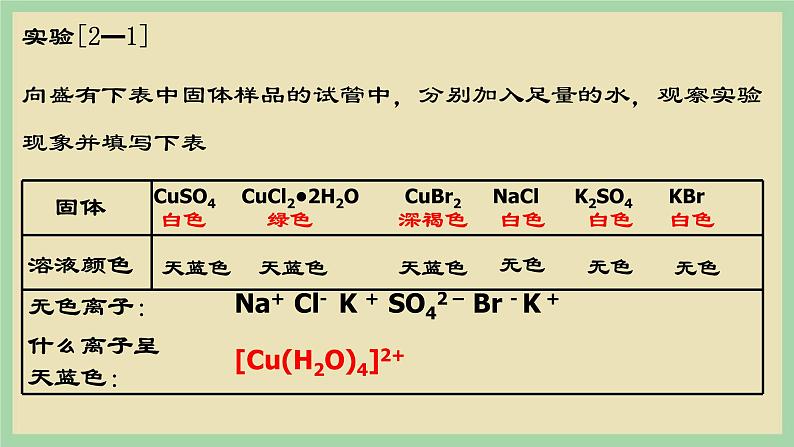
展开无水CuSO4是白色的,为什么CuSO4·5H2O晶体却是蓝色的?
[Cu(H2O)4]2+
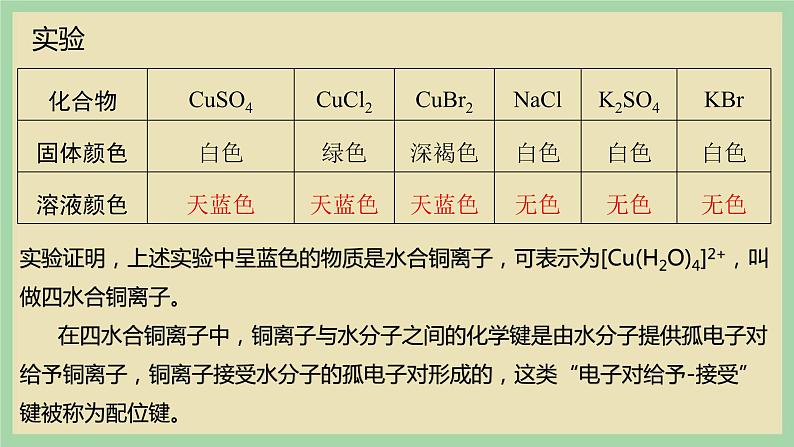
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
实验证明,上述实验中呈蓝色的物质是水合铜离子,可表示为[Cu(H2O)4]2+,叫做四水合铜离子。 在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的,这类“电子对给予-接受”键被称为配位键。
一方提供孤电子对(配体)
由一个原子单方面提供孤电子对而另一个原子接受孤电子对形成的共价键,即“电子对给予——接受”键被称为配位键。提供空轨道的原子或离子称为中心原子或离子,提供孤电子的原子对应的分子或离子称为配体或配位体。
中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、C3+、Cr3+等。
配位体:提供孤电子对的分子或离子,如分子CO、NH3、H2O等,阴离子F-、CN-、Cl-等。
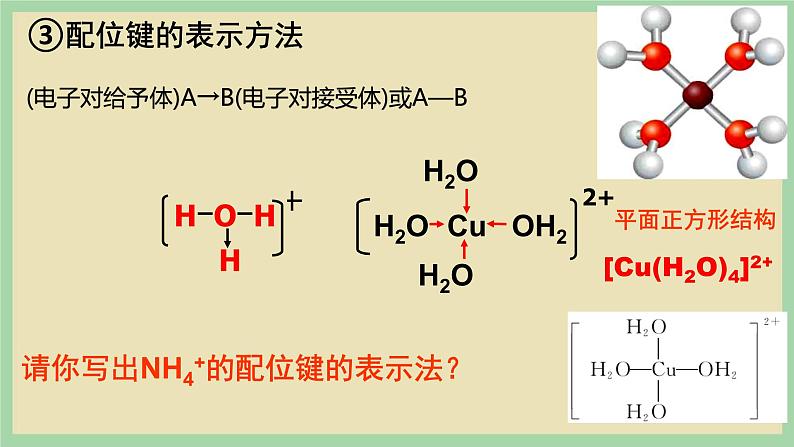
注意:①配位键是一种特殊的共价键,配位键与共价键性质完全相同.②配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。③H3O+、NH4+中含有配位键.
请你写出NH4+的配位键的表示法?
(电子对给予体)A→B(电子对接受体)或A—B
配位键与非极性键、极性键的区别与联系
配位键实质上是一种特殊的共价键。配位键的共用电子对由成键原子单方面提供,普通共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
(1) 中的配位键与其他三个N—H键的键参数是否相同?提示:相同。 可看成NH3分子结合1个H+后形成的,在NH3分子中中心原子氮采取sp3杂化,孤电子对占据一个杂化轨道,3个未成对电子分别占据另3个杂化轨道,分别结合3个H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当遇到H+时,N原子的孤电子对会进入H+的空轨道,以配位键形成 ,这样N原子就不再存在孤电子对,键角恢复至109°28',故 为正四面体形,4个N—H键完全相同,配位键与普通共价键形成过程不同,但各种键参数完全相同。
(2)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些?提示:[Cu(NH3)4]SO4中含有的化学键有离子键、共价键和配位键。(3)NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子?提示:N原子提供孤电子对,B原子提供空轨道。(4)配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么?提示:氨水呈弱碱性,滴入AgNO3溶液中会生成AgOH白色沉淀;继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,使AgOH逐渐溶解,反应过程如下:
金属离子(或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物,称为配位化合物,简称配合物。
②配合物的组成 金属离子或原子与某些分子或离子(称为配体)以配位键结合而形成的化合物称为配位化合物。配位化合物的组成如图:一般中心原子(或中心离子)的配位数是2、4、6。
①配离子念法:配位数→配体名称→合→中心原子(离子)名称②配合物→类似于盐(酸、碱)的念法
(1)溶解性的影响如:AgCl→[Ag(NH3)2]Cl,由不溶于水的沉淀,转变为易溶于水的物质。(2)颜色的改变当简单离子形成配离子时其性质往往有很大变化。颜色变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
⑤配合物的形成对性质的影响
(3)稳定性增强配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,导致血红素失去输送氧气的功能,这是CO使人体中毒的原理。
④形成配合物的条件(1)配体有孤电子对。(2)中心原子(或离子)有空轨道。
实验[2—2] 向盛有硫酸铜溶液试管中滴加几滴1ml.L-1氨水,首先形成难溶物,继续添加氨水并振荡试管,观察实验现象;再向试管中加入8ml95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。
难溶物溶解,得到深蓝色的透明溶液
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
实验2-3向盛有少量氯化铁溶液(或任何含有的Fe3+溶液)的试管中滴加1滴硫氰化钾(KSCN)溶液,观察实验现象。
原因:生成[Fe(SCN)n]3-n(n=1~6)
作用:检验或鉴定Fe3+,用于电影特技和魔术表演
配合物广泛存在于自然界中,跟人类生活有密切关系。例如,在人和动物体内起输送氧气作用的血红素,是Fe2+的配合物。配合物在生产和科学技术方面的应用也很广泛。
1.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子是广义的,包括离子。2.超分子实例(1)用超分子分离C60和C70。
冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。
(2)冠醚识别碱金属离子(如K+)。
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
(3)超分子两个的重要特征——分子识别、自组装。
1.形成配位键的条件是一方有空轨道,另一方有孤电子对。 ( )2.配位键是一种特殊的共价键。( )3.配位化合物中的配体可以是分子也可以是阴离子。( )4.共价键的形成条件是成键原子必须有未成对电子。( )5.超分子是相对分子质量很大的有机化合物。( )
1.判断正误(正确的打“√”,错误的打“×”)
2.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
3.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )A.配体为水分子,配位原子为O,外界为Br-B.中心离子的配位数为6C.中心离子Cr3+采取sp3杂化D.中心离子的化合价为+2价解析:[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-、H2O,Cr3+提供的空轨道数为6,中心离子不是采取sp3杂化。
4.下列关于配位化合物的叙述中,不正确的是( )A.配位化合物中必定存在配位键B.配位化合物中只有配位键C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物解析:配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
5.下列微粒中含配位键的是( )A.①②④⑦⑧ B.③④⑤⑥⑦C.①④⑤⑥⑦⑧ D.①②③④⑤⑥⑦⑧解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子)有空轨道。
6.(1)下列不属于配合物的是 。 A.[Cu(H2O)4]SO4·H2OB.[Ag(NH3)2]OHC.KAl(SO4)2·12H2OD.Na[Al(OH)4](2)在配合物[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ;画出配合物离子[Cu(NH3)4]2+中的配位键 。
高中化学人教版 (2019)选择性必修2第四节 配合物与超分子优秀课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子优秀课件ppt,共32页。PPT课件主要包含了空轨道,孤电子对,sp2等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第四节 配合物与超分子完美版ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子完美版ppt课件,共57页。PPT课件主要包含了孤电子对,空轨道,配位键,蓝色沉淀,深蓝色晶体,分子间,分子识别,自组装等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第四节 配合物与超分子获奖ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子获奖ppt课件,共30页。PPT课件主要包含了素养目标,课前篇素养初探,配合物,配位键,1实验探究,孤电子对,2配位键,3形成条件,课前篇素养提升,1概念等内容,欢迎下载使用。













