

江苏省南京市江宁区2022-2023学年上学期高三化学试题
展开2022~2023学年度第一学期高三阶段性学情调研
化 学 试 题
本卷满分100分,考试时间75分钟
可能用到的相对原子质量:H 1 C 12 O 16 Mg 24 Cl 35.5 Zn 65
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.2022年6月17日,中国第三艘航空母舰——“福建舰”正式下水,它是目前世界上最大的常规动力航母,配置了先进的电磁弹射和阻拦装置。下列说法错误的是
A.低磁合金钢常用于舰体材料,其强度、熔点均高于纯铁
B.航母燃料是重油,重油属于混合物
C.氮化镓常用于雷达系统,氮化镓的化学式为GaN
D.电磁弹射技术可使舰载机快速起飞,电能属于二级能源
2.尿素CO(NH2)2是一种高效化肥,也是一种化工原料。反应CO2+2NH3CO(NH2)2+H2O可用于尿素的制备。下列有关说法不正确的是
A.NH3与CO(NH2)2均为极性分子 B.N2H4分子的电子式为
C.NH3的键角大于H2O的键角 D.尿素分子σ键和π键的数目之比为6∶1
阅读下列资料,完成3题~4题:HCHO(g)与O2(g)在催化剂Ca₅(PO₄)₃(OH) (简写为HAP)表面催化生成CO2(g)和H2O(g)的历程示意图如下。已知该反应在较高温度下不能自发进行。
3.下列说法正确的是
A.基态Ca原子的内层电子为全充满 B.原子半径:r(P)>r(Ca)
C.HCHO与H2O分子中的键角相同 D.PO的空间结构为正四面体形
4.下列说法不正确的是
A.ΔH=反应物的键能总和-生成物的键能总和
B.羟基磷灰石(HAP)的作用是降低反应的活化能,加快反应速率
C.HCHO与CO2分子中的中心原子的杂化轨道类型相同
D.反应HCHO(g)+O2(g)CO2(g)+H2O(g)的 ΔS<0
5.下列化合物的性质与用途具有对应关系的是
A.ClO2具有氧化性,可用于水体消毒
B.HF显弱酸性,故可用于雕刻玻璃
C.纳米Fe3O4颗粒呈黑色,可用作磁性材料
D.MnO2具有氧化性,可用于加快H2O2分解
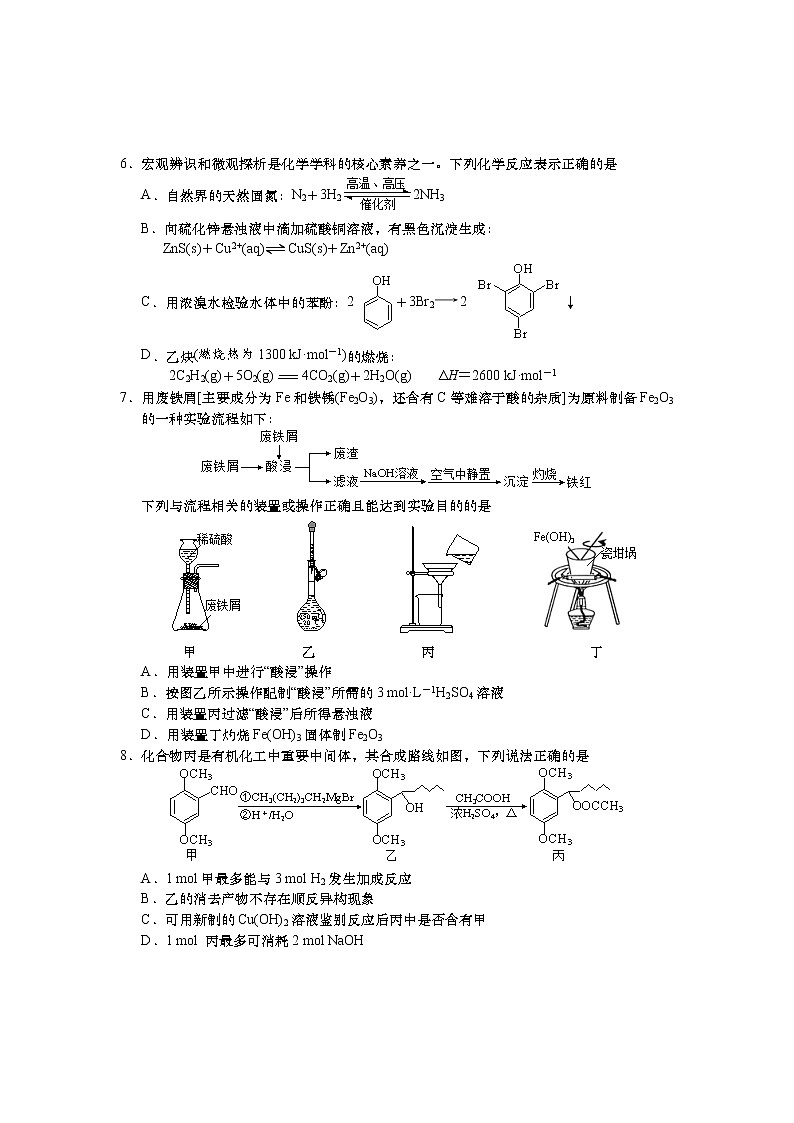
6.宏观辨识和微观探析是化学学科的核心素养之一。下列化学反应表示正确的是
A.自然界的天然固氮:N2+3H22NH3
B.向硫化锌悬浊液中滴加硫酸铜溶液,有黑色沉淀生成:
ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq)
C.用浓溴水检验水体中的苯酚:2 +3Br22 ↓
D.乙炔(燃烧热为1300 kJ·mol-1)的燃烧:
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g) ΔH=2600 kJ·mol-1
7.用废铁屑[主要成分为Fe和铁锈(Fe2O3),还含有C等难溶于酸的杂质]为原料制备Fe2O3的一种实验流程如下:
下列与流程相关的装置或操作正确且能达到实验目的的是
甲 乙 丙 丁
A.用装置甲中进行“酸浸”操作
B.按图乙所示操作配制“酸浸”所需的3 mol·L-1H2SO4溶液
C.用装置丙过滤“酸浸”后所得悬浊液
D.用装置丁灼烧Fe(OH)3固体制Fe2O3
8.化合物丙是有机化工中重要中间体,其合成路线如图,下列说法正确的是
A.1 mol甲最多能与3 mol H2发生加成反应
B.乙的消去产物不存在顺反异构现象
C.可用新制的Cu(OH)2溶液鉴别反应后丙中是否含有甲
D.1 mol 丙最多可消耗2 mol NaOH
9.汽车的安全气囊系统与座椅安全带配合使用能为乘员提供有效的防撞保护,当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应[NaN3+KNO3→K2O+Na2O+N2↑(未配平),生成大量气体。下列说法正确的是
A.上述反应中只有离子键和非极性键的断裂和形成
B.当反应过程中转移0.25 mol电子时,产生8.96 L气体
C.10 mL 1 mol·L-1的KNO3溶液中含氧原子的数目为0.03×6.02×1023
D.若被氧化的N原子的物质的量为6 mol,则氧化产物比还原产物多2.8 mol
10.室温下,下列实验探究方案能达到探究目的的是
选项 | 探究方案 | 探究目的 |
A | 向盛有SO2水溶液的试管中滴加几滴酸性KMnO4溶液,振荡,观察溶液颜色变化 | SO2具有漂白性 |
B | 将20℃ 0.5 mol·L-1CH3COONa溶液加热到40℃,用pH传感器测量溶液的pH | 温度对CH3COO-水解平衡的影响 |
C | 向Na2CO3溶液中滴加浓盐酸,反应产生的气体直接通入Na2SiO3溶液中 | 非金属性:C>Si |
D | 向浓度均为0.01mol·L-1的Na2CO3和Na2SO4的混合液中滴少量0.01mol·L-1的BaCl2溶液 | Ksp(BaCO3)>Ksp(BaSO4) |
11.工业上常用芒硝( Na2SO4·10H2O)和煤粉在高温下生产硫化钠粗品,生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。一种生产芒硝并进行纯化的流程如下图所示:
下列说法不正确的是
A.Na2SO4·10H2O和煤粉高温下反应所得CO和Na2S的物质的量之比为2∶1
B.“溶解”时需要适当升高温度
C.“操作Ⅰ”是趁热过滤
D.含少量Na2S的乙醇可通过蒸馏的方法回收乙醇
12.室温下取Na2CO3、NaHCO3进行如下实验。
实验1:测得0.1 mol·L-1 NaHCO3溶液的pH约为8。
实验2:将0.2 mol·L-1 NaHCO3溶液与0.1 mol·L-1 CaCl2溶液等体积混合,有白色沉淀生及气泡生成。
实验3:向0.05 mol·L-1 Na2CO3溶液中通CO2,pH从12降至约为9。
实验4:向Na2CO3溶液中滴加氯水,氯水颜色褪去。
下列说法正确的是
A.NaHCO3溶液中存在Ka2(H2CO3)>
B.实验2中反应生成的气体是HCl
C.实验3中pH=9的溶液中:c(Na+)>c(CO)+c(HCO)+c(H2CO)
D.实验4中 c反应前(CO)<c反应后(CO)
13.一定温度下,在2个容积均为1 L的密闭容器中,充入一定量的反应物,发生反应:
2NO(g)+2CO(g)N2(g)+2CO2 (g) ΔH<0。相关反应数据如下表所示:
容器编号 | 温度 | 起始时物质的量/mol | 10 s时物质的量/mol | |
NO | CO | N2 | ||
Ⅰ | T1℃ | 0.2 | 0.2 | 0.05 |
Ⅱ | T2℃(T2>T1) | 0.2 | 0.2 | 0.05 |
下列说法正确的是
A.10 s时,容器Ⅰ中的反应处于平衡状态
B.10 s时,容器Ⅰ中的化学反应速率v(CO2)=0.005mol·L-1·s-1
C.化学平衡常数:KⅡ>KⅠ
D.若起始时,向容器Ⅱ中充入0.08 mol NO、0.1 mol CO、0.04 mol N2和0.1 mol CO2,反应将向逆反应方向进行
二、非选择题:共4题,共61分。
14.(15分)纳米氧化锌是一种新型无机功能材料。以氧化锌烟灰(含ZnO及少量Fe2O3、FeO、MnO、CuO)为原料制备纳米氧化锌的工艺流程如下:
⑴“浸取”时盐酸不宜过量太多的原因有 。
⑵“氧化除杂”所得“滤渣1”的成分含MnO2和Fe(OH)3。
①Fe2+与KMnO4发生反应的离子方程式为 。
②判断该步骤已完成的现象是 。
⑶ZnS晶体有立方和六方两种晶型,晶胞结构如题14图-1所示。下列关于两种晶胞的说
法正确的有 (填标号)。
A.立方硫化锌中与S2-最近的S2-有12个
B.S2-都与4个Zn2+紧邻
C.1个晶胞都含有4个S2-
⑷“沉锌”得到碱式碳酸锌,化学式为2ZnCO3·3Zn(OH)2·2H2O(M=583 g·mol-1)。
①“沉锌”的离子方程式为 。
②碱式碳酸锌加热升温过程中固体的质量变化如题14图-2所示。350 ℃时,剩余固体中已不含碳元素,此时剩余固体的成分及物质的量之比是 。
15.(14分)化合物F是一种有机合成中间体,其合成路线如下:
(1)D中含氧官能团的名称为_____________________。
(2)A→B需经历的过程,中间体X的化学式为C7H5O2-。X→B
的反应类型为________________________。
(3)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______。
①属于芳香族化合物,且能发生银镜反应。
②分子中不同化学环境的氢原子数目比为1∶1∶3。
(4)D→E通过双键复分解反应生成的另一种产物分子式为CH2O,其结构简式为______。
(5)写出以为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16.(15分)FeCl3是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。。
已知:FeCl3易升华、遇水蒸气易潮解。
(1)A中反应的化学方程式为______________________________________________。
该反应中,浓盐酸表现的性质是_______________(填“氧化性”“还原性”或“酸性”)。
(2)B中的试剂是________________________。C的作用是____________________________。
(3) E装置中冰水浴的作用是___________________________________________________。
(4) F中反应的离子方程式为 ___________________________________________。
(5)上述实验装置存在两处缺陷:一是 ___________________________________________;
二是_______________________________________________________________。
(6)经改进,继续完成实验。实验完毕后,取产品探究其性质:
实验 | 操作 | 现象 |
① | 取少量固体溶于蒸馏水,滴加KSCN溶液 | 溶液变红色 |
② | 取少量固体溶于稀硫酸 | 固体溶解,无气泡产生 |
根据上述实验现象,________(填“能”或“不能”)确定产品中是否含有铁单质,理由是
_________________________________________________________(用文字描述)。
17.(17分)甲醇制烯烃是一项非石油路线烯烃生产技术,可减少我国对石油进口的依赖度。
(1)甲醇也可通过煤的液化过程获得,该过程是__________(填“物理"或“化学")变化。
(2)甲醇制烯烃的反应有3CH3OH(g)=C3H6(g)+3H2O(g)、4CH3OH(g)=C4H8(g)+4H2O(g),烯烃产物之间存在如下转化关系:
反应Ⅰ:2C3H6(g)3C2H4(g) ΔH1=+117 kJ·mol-1
反应Ⅱ:3C4H8(g)4C3H6(g) ΔH2=+78 kJ·mol-1
反应Ⅲ:C4H8(g)2C2H4(g) ΔH3
反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如下左图所示。
①反应Ⅲ的ΔH3=__________ kJ·mol-1。
②图1中曲线a代表的组分是__________,700K后,曲线a下降的原因是________
_____________________________________________________________________。
③图1中P点坐标为(900,0.48),900 K时,反应III的物质的量分数平衡常数Kx=
_______________(以物质的量分数代替浓度计算)。
(3)将0.1 mol CO2和0.3 mol H2充入0.5 L恒容密闭容器中,分别在两种不同催化剂Ⅰ、Ⅱ下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),相同时间内CO2的转化率随温度变化曲线如上右图所示。
①催化剂Ⅰ、Ⅱ中催化效率较高的是_____________。
②随温度的升高,CO2的转化率先增大后减小,理由是___________________________
_________________________________________________________________________
_______________________________________________________________________。
③已知C点容器内压强为P,在T5温度反应的平衡常数Kp为_____________________
(用含P的关系式表示)
2022~2023学年度第一学期高三阶段性学情调研
化 学 试 题 参 考 答 案 与 评 分 标 准
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.A 2.D 3.D 4.C 5.A 6.B 7.D 8.C 9.D 10.B
11.A 12.C 13.D
二、非选择题:共4题,共61分。
14.⑴防止“氧化除杂”步骤消耗更多的KMnO4和产生污染性气体Cl2
⑵①MnO+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+(3分)
②溶液变为浅紫红色
⑶AB
⑷①5Zn2++5CO+5H2O=2ZnCO3·3Zn(OH)2·2H2O+3CO2↑(3分)
②n[Zn(OH)2]∶n(ZnO)=1∶4(化学式1分,比例2分,共3分)
(除特殊标记的分值外,每空2分,共15分)
15.(1)醛基、醚键
(2)取代反应
(3) 或或(3分)
(4)HCHO
(5) (5分)
(除特殊标记的分值外,每空2分,共14分)
16.(1)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 还原性和酸性
(2)饱和氯化钠溶液(1分) 干燥氯气(1分)
(3)冷凝,使升华的FeCl3顺利凝结,便于收集FeCl3
(4)Cl2+2OH-=Cl-+ClO-+H2O
(5) D与E间的导气管太细,易堵塞 (1分)
E和F之间缺少除水装置,F中的水蒸气易使FeCl3潮解(1分)
(6)不能(1分) 过量的三价铁离子能将少量单质铁氧化
(除特殊标记的分值外,每空2分,共15分)
17.(1)化学(1分)
(2)①+104
②C3H6 反应Ⅰ和Ⅱ均为吸热反应,升高温度,平衡正向移动,且升温对反应Ⅰ的影响更大(3分)
③5.76(3分
(3)①催化剂Ⅱ (1分)
②B点前,反应未达平衡,随温度升高,反应速率加快,相同时间内CO2转化率增大;B点后,反应已达平衡,随温度升高,平衡逆向移动,CO2转化率降低(3分)
③(3分)
(除特殊标记的分值外,每空2分,共17分)
【期中真题】江苏省南京市江宁区2022-2023学年高三上学期期中考试化学试题.zip: 这是一份【期中真题】江苏省南京市江宁区2022-2023学年高三上学期期中考试化学试题.zip,文件包含期中真题江苏省南京市江宁区2022-2023学年高三上学期期中考试化学试题原卷版docx、期中真题江苏省南京市江宁区2022-2023学年高三上学期期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
江苏省南京市江宁区2022-2023学年高一下学期期末考试化学试题(原卷版+解析版): 这是一份江苏省南京市江宁区2022-2023学年高一下学期期末考试化学试题(原卷版+解析版),共27页。试卷主要包含了5 Cu-64, 下列说法正确的是等内容,欢迎下载使用。
江苏省南京市江宁区2022-2023高二下学期期末化学试卷+答案: 这是一份江苏省南京市江宁区2022-2023高二下学期期末化学试卷+答案,共11页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。












