




人教版 (2019)选择性必修1实验活动2 强酸与强域的中和滴定复习练习题
展开酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
c酸v酸=c碱v碱 (一元酸和一元碱)
以酸碱中和反应为基础,H+ + OH- = H2O在滴定达到终点(即酸碱恰好反应)时:
n(H+)=n(OH-)
例:用0.1032ml/L的HCl溶液滴定25.00mL未知浓度的NaOH溶液,滴定完成时用去HCl溶液27.84mL。计算待测NaOH溶液的物质的量浓度。
(答案:0.1149ml/L)
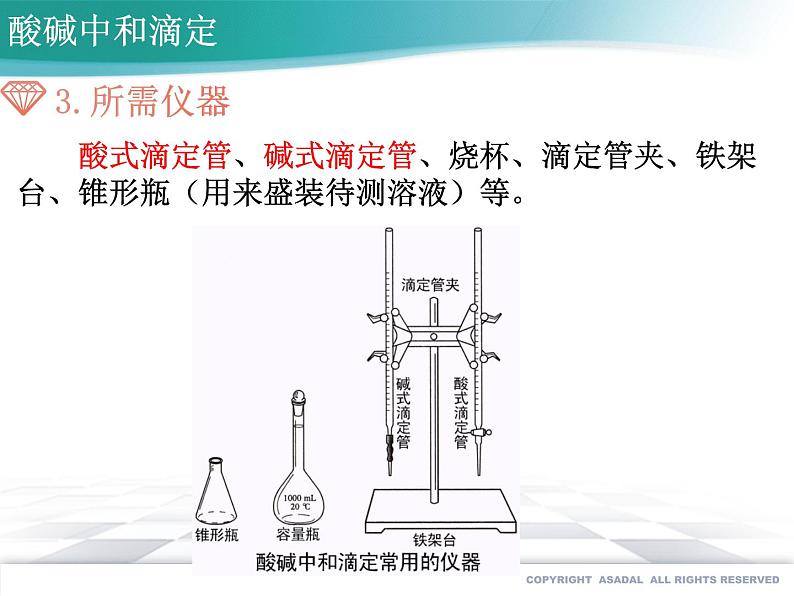
酸式滴定管、碱式滴定管、烧杯、滴定管夹、铁架台、锥形瓶(用来盛装待测溶液)等。
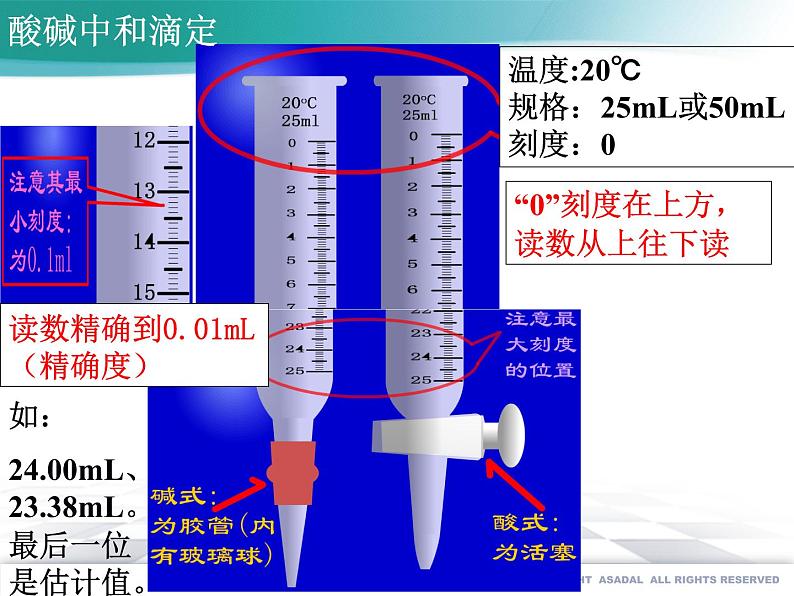
“0”刻度在上方,读数从上往下读
读数精确到0.01mL(精确度)
温度:20℃规格:25mL或50mL刻度:0
如:24.00mL、23.38mL。最后一位是估计值。
滴定管:精确量器(标有温度、刻度、规格)(1)酸式滴定管:玻璃塞 不可盛放碱性溶液(如NaOH)和HF溶液 碱式滴定管:橡胶管 不可盛放酸性和强氧化性(如KMnO4)的溶液(2)读数: 最小刻度0.1mL,读数到0.01mL.0刻度在上端,总体积大于实际量程类比——量筒: -粗略量器精确度:0.1mL,无0刻度
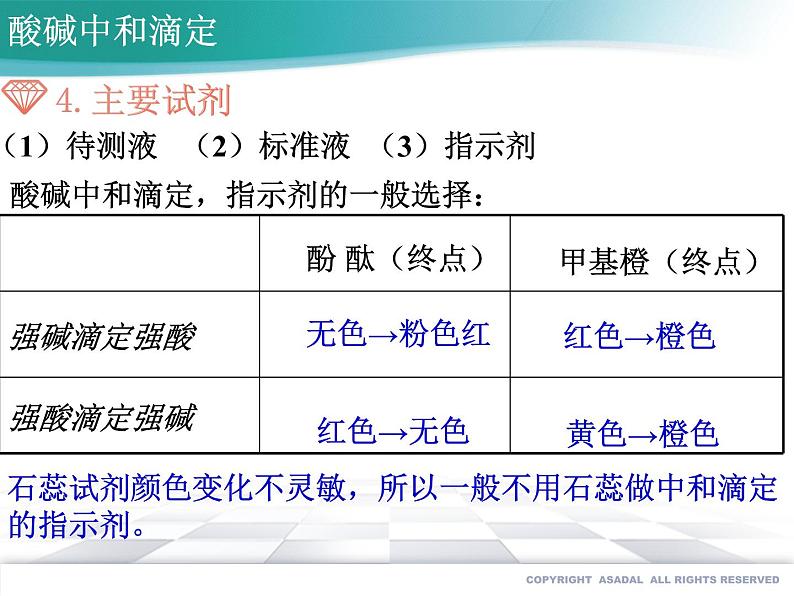
酸碱中和滴定,指示剂的一般选择:
石蕊试剂颜色变化不灵敏,所以一般不用石蕊做中和滴定的指示剂。
(1)待测液 (2)标准液 (3)指示剂
(1)滴定前准备工作 (2)滴定过程(3)终点的判断(读数)(4)数据处理(计算)
(1)实验前的准备工作
锥形瓶只能用蒸馏水润洗,不能用待测液润洗;指示剂一般加1~2滴,不能加多。
当加入最后一滴标准液,溶液颜色刚好发生变化且在半分钟内不再变色。
例:用盐酸标准液滴定未知浓度的NaOH溶液,酚酞做指示剂,终点描述:当加入最后一滴盐酸时溶液由红色变为无色,且半分钟内不再变色。
V标准=V后 - V前
为减少实验误差,滴定时,要求____________2~3次,求出所用标准溶液体积的_________。然后计算待测液的物质的量浓度。
数据的处理:例:用0.1000ml/L的盐酸滴定某未知浓度的NaOH溶液数据如下,求NaOH浓度
V待测 = 25.00mL V标准 = 25.20mL C(NaOH) = 0.0992ml/L
在实际操作中认为C标是已知的,V待是固定的,所以一切的误差都归结为对V标的影响,V标偏大则C待偏大, V标偏小则C待偏小。
滴定前实验准备过程中产生的误差:
例:用已知浓度的HCl标准液滴定未知浓度的NaOH待测液
滴定过程中产生的误差:
(1)滴定时起始读数正确,达到终点后仰视刻度线
V标偏大,所以C待偏大
(2)滴定时起始读数正确,达到终点后俯视刻度线
V标偏小,所以C待偏小
(3)滴定前仰视刻度线,滴定后俯视刻度线
V标=V(后)-V(前),读数偏小
V标=V(后)-V(前),读数偏大
(4) 滴定前俯视刻度线,滴定后仰视刻度线
中和滴定误差分析:根据:c(H+)·V(酸)=c(OH-)·V(碱) 分析:中和滴定时(已知酸的浓度),下列错误操作对所测碱液的浓度有何影响?(1)酸式(或碱式)滴定管未用待装溶液润洗 (2)锥形瓶用待装碱液润洗(3)滴定前酸式(或碱式)滴定管尖嘴有气泡(后无)
(4)滴定后酸式(或碱式)滴定管尖嘴有气泡(前无)(5)观察液面时,滴定前俯视,滴定后仰视(6)观察液面时,滴定仰俯视,滴定后俯视(7)滴定前酸式(或碱式)滴定管液面未调到“0”或“0”以下(8)锥形瓶中溶液的红色刚好褪去时,瓶壁上还沾有少量碱液或振荡时有溶液溅出
1.0 1.2 1.8 2.3 2.6 3.9 7.0 10.0 11.4
向20.00 mL 0.100 ml/L HCl中滴加0.100 ml/L NaOH溶液的过程中,溶液的pH变化如下。
v(NaOH)/(mL)
如果酸碱指示剂的颜色在此pH突变范围发生明显的改变,误差很大吗?
0 10 20 30 40 V(NaOH)mL
12 10 8 6 4 2
0 10 20 30 40 V(NaOH)/mL
12 10 8 6 4 2
在滴定终点前后,溶液的pH发生突变。
①强酸和弱碱滴定 强酸弱碱盐 甲基橙②强碱滴弱酸滴定 强碱弱酸盐 酚酞③强酸强碱滴定 酚酞和甲基橙都可以
已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)
标准液、待测液、 酸碱指示剂
装液、调液和取液(记下读数)
记录(记下读数)并计算
c酸v酸=c碱v碱 (一元酸和一元碱)
Asadal has been running ne f the biggest dmain and web hsting sites in Krea since March 1998. Mre than 3,000,000 peple have.visited ur website, fr dmain registratin and web hsting
苏教版 (2019)选择性必修1第二单元 溶液的酸碱性课时作业: 这是一份苏教版 (2019)选择性必修1第二单元 溶液的酸碱性课时作业,共32页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 溶液的酸碱性练习题: 这是一份苏教版 (2019)选择性必修1第二单元 溶液的酸碱性练习题,共16页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
【同步讲义】高中化学(苏教版2019)选修第一册--3.2.3 酸碱中和滴定 讲义: 这是一份【同步讲义】高中化学(苏教版2019)选修第一册--3.2.3 酸碱中和滴定 讲义,文件包含同步讲义高中化学苏教版2019选修第一册--323酸碱中和滴定学生版docx、同步讲义高中化学苏教版2019选修第一册--323酸碱中和滴定教师版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。













