
苏教版 (2019)专题3 微粒间作用力与物质性质第一单元 金属键 金属晶体学案设计
展开一、金属键与金属特性
1.金属键
(1)金属键的概念
金属原子失去部分或全部外围电子形成的金属离子与自由电子之间强烈的相互作用。
(2)金属键的形成
金属原子失去部分或全部外围电子形成的金属离子与“脱落”下的自由电子相互作用。
2.金属特性
(1)导电性
在外电场作用下,自由电子在金属内部会发生定向移动,形成电流。温度升高,金属的导电性减弱。
微点拨:
电解质导电和金属导电的区别
(2)导热性
金属受热时,自由电子与金属离子(或金属原子)碰撞频率增加,自由电子把能量传给金属离子(或金属原子),从而把能量从温度高的区域传到温度低的区域。
(3)延展性
金属键没有方向性,在外力作用下,金属原子之间发生相对滑动,各层金属原子之间仍然保持金属键的作用,不会断裂。
3.金属键的强弱
(1)原子化热
金属键的强弱可以用金属的原子化热来衡量。金属的原子化热是指1 ml金属固体完全气化成相互远离的气态原子时吸收的能量。
(2)金属键的强弱
金属键的强弱与金属元素的原子半径、单位体积内自由电子的数目有关。一般而言,金属元素的原子半径越小、单位体积内自由电子的数目越多,金属键越强。
(3)金属键的强弱与金属的物理性质的关系
金属键越强,金属晶体的硬度越大,熔、沸点越高。
判断正误(正确的打“√”,错误的打“×”)
(1)金属键是金属离子与自由电子之间的吸引力。(×)
(2)任何固体中含有阳离子时一定含有阴离子。(×)
(3)金属单质中金属键越强,金属的还原性越弱。(√)
(4)熔、沸点:Li>Na>K>Rb,硬度:Na
1.晶体:具有规则几何外形的固体,通常条件下,大多数金属单质也是晶体。在金属晶体中,金属原子如同半径相等的小球一样,彼此相切、紧密堆积成晶体。
2.晶胞:能够反映晶体结构特征的基本重复单位。金属晶体是晶胞在空间连续重复延伸而形成的。
3.金属原子在平面内的两种排列方式:非密置层(一个原子周围有4个原子)和密置层(一个原子周围有6个原子)。
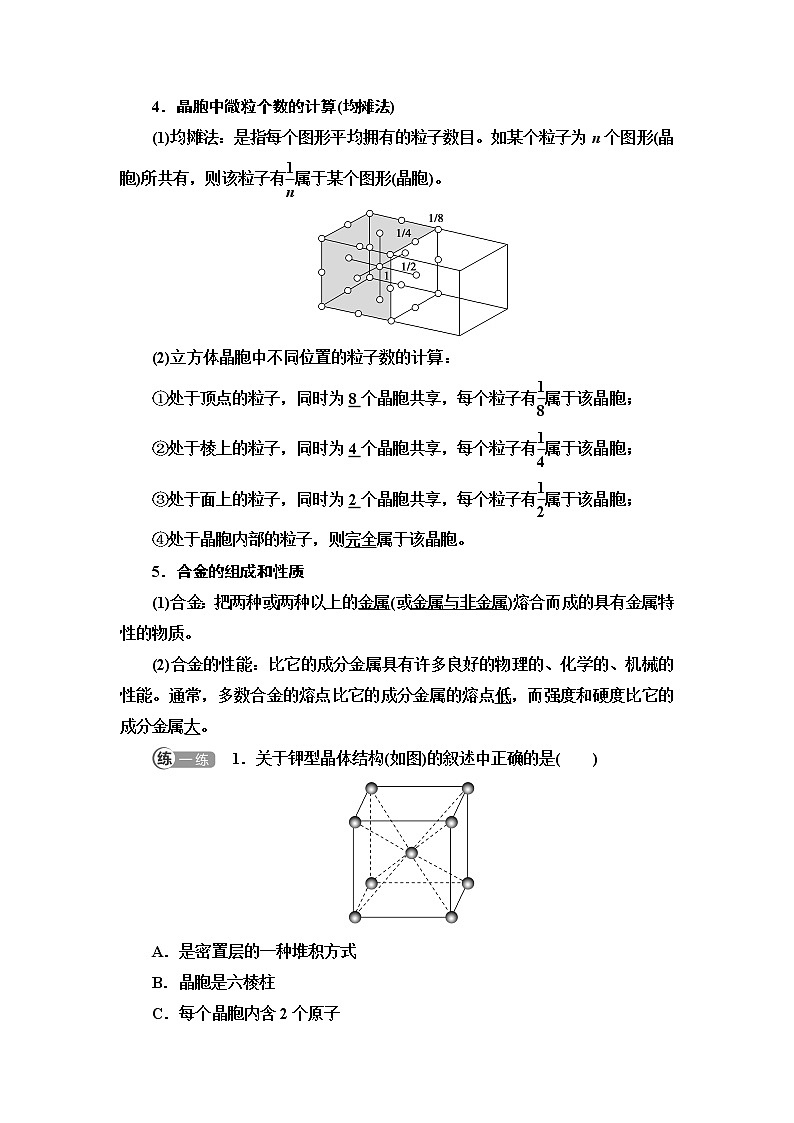
4.晶胞中微粒个数的计算(均摊法)
(1)均摊法:是指每个图形平均拥有的粒子数目。如某个粒子为n个图形(晶胞)所共有,则该粒子有eq \f(1,n)属于某个图形(晶胞)。
(2)立方体晶胞中不同位置的粒子数的计算:
①处于顶点的粒子,同时为8个晶胞共享,每个粒子有eq \f(1,8)属于该晶胞;
②处于棱上的粒子,同时为4个晶胞共享,每个粒子有eq \f(1,4)属于该晶胞;
③处于面上的粒子,同时为2个晶胞共享,每个粒子有eq \f(1,2)属于该晶胞;
④处于晶胞内部的粒子,则完全属于该晶胞。
5.合金的组成和性质
(1)合金:把两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
(2)合金的性能:比它的成分金属具有许多良好的物理的、化学的、机械的性能。通常,多数合金的熔点比它的成分金属的熔点低,而强度和硬度比它的成分金属大。
1.关于钾型晶体结构(如图)的叙述中正确的是( )
A.是密置层的一种堆积方式
B.晶胞是六棱柱
C.每个晶胞内含2个原子
D.每个晶胞内含6个原子
C [钾型晶体的晶胞为体心立方体,是非密置层的一种堆积方式,其中8个顶点和体心处各有一个原子,晶胞内含有8×eq \f(1,8)+1=2个原子。]
2.金属晶体中金属原子有三种常见的堆积方式:六方堆积、面心立方堆积和体心立方堆积,下图(a)、(b)、(c)分别代表这三种晶胞的结构,其晶胞内金属原子个数比为( )
(a) (b) (c)
A.3∶2∶1 B.11∶8∶4
C.9∶8∶4D.21∶14∶9
A [晶胞(a)中含有12×eq \f(1,6)+2×eq \f(1,2)+3=6个金属原子,晶胞(b)中含有8×eq \f(1,8)+6×eq \f(1,2)=4个金属原子,晶胞(c)中含有8×eq \f(1,8)+1=2个金属原子,晶胞内金属原子个数的比值为3∶2∶1。]
下表是部分金属的原子半径、原子化热和熔点
[问题1] 表格中金属原子外围电子数目最少和最多的分别是哪种?
[提示] 表格中金属原子外围电子数目最少和最多的分别为Na和Cr。
[问题2]表格中金属原子半径最大和最小的分别是哪种?
[提示] 表格中金属原子半径最大和最小的分别是Na和Cr。
[问题3] 表格中金属的原子化热大小关系怎样排序?
[提示] 金属的原子化热Na
[提示] 金属的熔点从高到低的顺序Cr> Al> Mg> Na。
[问题5] 通过分析表格数据,总结决定金属熔点高低的因素是什么?
[提示] 决定金属熔点高低的因素是金属键的强弱,金属键越强,金属的熔点越高。金属元素的原子半径越小、单位体积内自由电子数目(或金属离子的电荷数)越多,金属键越强。
1.金属键
(1)成键微粒:金属阳离子和自由电子。
(2)存在:在金属单质和合金中都存在金属键。
(3)本质和特点
金属键的本质是一种电性作用,即金属阳离子和自由电子之间的静电作用。金属键的特征是没有方向性和饱和性,金属中的电子在整个晶体内运动,属于整块金属。
(4)影响因素
金属元素的原子半径和单位体积内自由电子的数目及金属阳离子所带电荷数。
①金属键的强弱差别较大。如钠、钾的熔、沸点低,存在的金属键较弱;铬的硬度大,熔、沸点高,存在的金属键较强。
②同主族元素,随着核电荷数的增大,金属原子的半径增大,金属键减弱;同周期元素,随着核电荷数的增大,金属原子半径减小,金属键增强,熔、沸点升高。
2.金属键与金属的性质
金属的延展性、导电性、导热性、熔沸点等均与金属键有关。金属键越强,金属的熔沸点越高。
1.关于金属键的叙述错误的是( )
A.金属键没有方向性和饱和性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
B [金属键是金属阳离子和自由电子之间存在的强烈的相互作用,包括静电吸引作用和静电排斥作用。]
2.下列关于金属单质的叙述正确的是( )
A.常温下,金属单质都以固体形式存在
B.金属键在一定外力作用下,不因形变而消失
C.钙的熔、沸点低于钾
D.温度越高,金属的导电性越好
B [常温下,金属单质汞以液体形式存在,A项错;离子半径Ca2+
红砷镍矿(NiAs)是常见的镍矿之一,是一种六方晶体(底面为60°和120°的菱形),其晶胞如图所示,图中深色小球为Ni,浅色大球为As。已知NiAs的晶胞边长分别为a pm和c pm,阿伏加德罗常数的值为NA。
[问题1] 红砷镍矿晶胞所含的镍、砷原子数分别是多少?
[提示] As位于晶胞内部,As原子数目为2;Ni位于六方晶胞的顶点和棱上,Ni原子数目为eq \f(1,6)×4+eq \f(1,12)×4+eq \f(1,6)×2+eq \f(1,3)×2=2。
[问题2]一个红砷镍矿晶胞的质量为多少?
[提示] eq \f(59+75g/ml×2 ml,NA)。
[问题3] 一个红砷镍矿晶胞的体积是多少?
[提示] eq \f(\r(3),2)a2c×10-30 cm3。
[问题4] 红砷镍矿的密度如何表示?
[提示] 晶胞密度ρ=eq \f(m,V)=eq \f(\f(59+75g/ml×2 ml,NA),\f(\r(3),2)a2c×10-30 cm3)=eq \f(\r(3)×5.36×1032,3a2cNA) g/cm3。
晶体结构的相关计算
(2)晶体密度计算公式:ρ=eq \f(NM,NA·V),其中N为1个晶胞中所含“分子”数目,M为摩尔质量,NA为阿伏加德罗常数,V为1个晶胞的体积。
(3)晶胞质量=晶胞含有的微粒的质量=晶胞含有的微粒数×eq \f(M,NA)。
(4)空间利用率=eq \f(晶胞含有的微粒体积,晶胞体积)×100%。
(5)金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a)
①面对角线长=eq \r(2)a;
②体对角线长=eq \r(3)a;
③体心立方堆积4r=eq \r(3)a(r为原子半径);
④面心立方堆积4r=eq \r(2)a(r为原子半径)。
1.金属铝的晶胞结构如图甲所示,原子之间相互位置关系的平面图如图乙所示。
甲 乙
2.研究发现氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
氨硼烷晶体的密度ρ=________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
[解析] 在氨硼烷的2×2×2的超晶胞结构中,共有16个氨硼烷分子,晶胞的长、宽、高分别为2a pm、2b pm、2c pm,若将其平均分为8份可以得到8个小长方体,则平均每个小长方体中占有2个氨硼烷分子,小长方体的长、宽、高分别为a pm、b pm、c pm,则晶胞的质量为eq \f(31×2g,NA),小长方体的体积为abc×10-30cm3,因此,氨硼烷晶体的密度为eq \f(\f(31×2g,NA),abc×10-30cm3)=eq \f(62,NAabc×10-30) g·cm-3。
[答案] eq \f(62,NAabc×10-30)
1.金属能导电的原因是( )
A.金属晶体中金属阳离子与自由电子间的相互作用较弱
B.金属晶体中的自由电子在外加电场作用下发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
B [金属中存在自由移动电子,在外加电场的作用下,自由电子就会定向移动而形成电流。]
2.按下列四种有关性质的叙述,可能属于金属晶体的是( )
A.由分子间作用力结合而成,熔点很低
B.固体或熔融后易导电,熔点在1 000 ℃左右
C.由共价键结合成网状晶体,熔点很高
D.固体不导电,但溶于水或熔融后能导电
B [A是分子晶体;B中固体能导电,熔点在1 000 ℃左右,不是很高,应是金属晶体;C为原子晶体;D为离子晶体。]
3.下列对各组物质性质的比较中,正确的是( )
A.熔点:Li<Na<K
B.导电性:Ag>Cu>Al>Fe
C.密度:Na>Mg>Al
D.硬度:Na>Mg>Al
B [同主族的金属单质,原子序数越大,熔点越低,这是因为它们的价电子数相同,随着原子半径的增大,金属键逐渐减弱,A错误;常用的金属导体中,导电性最好的是Ag,其次是Cu,再次是Al、Fe,B正确;Na、Mg、Al是同周期的金属单质,密度逐渐增大,C错误;金属键:Al>Mg>Na,则硬度:Al>Mg>Na,D错误。]
4.石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数及碳原子个数为( )
A.9,4
B.9,180
C.12,10
D.12,240
D [由晶胞结构可知,晶胞中位于棱上和体内的M原子个数为12×eq \f(1,4)+9=12个,位于顶点和面心的C60个数为8×eq \f(1,8)+6×eq \f(1,2)=4,碳原子个数为4×60=240,则晶胞中M原子的个数及碳原子个数为12和240,故选D。]
5.金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定___________________________________________________________________。
(3)一个晶胞的体积是________________。
(4)金晶体的密度是________________。
[解析] (1)金晶体中每个晶胞中含有8×eq \f(1,8)+6×eq \f(1,2)=4个金原子。(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定在立方体各个面的对角线上3个金原子两两相切。(3)金原子直径为d,则晶胞的面对角线长为2d,立方体的边长为eq \r(2)d,所以一个晶胞的体积为(eq \r(2)d)3=2eq \r(2)d3。(4)一个晶胞中含有4个金原子,则一个晶胞的质量为eq \f(4M,NA),故金晶体的密度为eq \f(4M,NA×2\r(2)d3)=eq \f(\r(2)M,NAd3)。
[答案] (1)4 (2)在立方体各个面的对角线上3个金原子两两相切 (3)2eq \r(2)d3 (4)eq \f(\r(2)M,d3NA)学 习
任 务
1.能描述金属晶体中金属键的成键特征。
2.能用金属键理论解释金属的典型性质。
3.能借助模型说明常见金属晶体中晶胞的构成。
4.能举例说明合金的优越性能。
物质类型
电解质
金属晶体
导电时的状态
水溶液或熔融状态下
晶体状态
导电粒子
自由移动的离子
自由电子
导电时发生的变化
化学变化
物理变化
导电能力随温度的变化
温度升高导电能力增强
温度升高导电能力减弱
金属键与金属特性的关系
金属
Na
Mg
Al
Cr
原子外围电子排布
3s1
3s2
3s23p1
3d54s1
原子半径/pm
186
160
143.1
124.9
原子化热/(kJ·ml-1)
108.4
146.4
326.4
397.5
熔点/ ℃
97.5
650
660
1 900
有关晶胞的计算
苏教版 (2019)选择性必修2专题3 微粒间作用力与物质性质第一单元 金属键 金属晶体学案及答案: 这是一份苏教版 (2019)选择性必修2<a href="/hx/tb_c4009336_t4/?tag_id=42" target="_blank">专题3 微粒间作用力与物质性质第一单元 金属键 金属晶体学案及答案</a>,共8页。学案主要包含了学习目标,合作探究,学习情境,新知生成,核心突破,随堂检测等内容,欢迎下载使用。
苏教版 (2019)第二单元 溶液的酸碱性学案: 这是一份苏教版 (2019)第二单元 溶液的酸碱性学案,共13页。学案主要包含了酸碱中和滴定等内容,欢迎下载使用。
化学第二单元 溶液的酸碱性学案: 这是一份化学第二单元 溶液的酸碱性学案,共12页。













