




















2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题八 化学反应速率与化学平衡
展开【课标要求】 1.知道化学反应速率的表示方法,了解测定化学反应速率的简单方法。2.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响。3.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。4.能进行化学反应速率的简单计算,能用一定的理论模型说明外界条件改变对化学反应速率的影响。
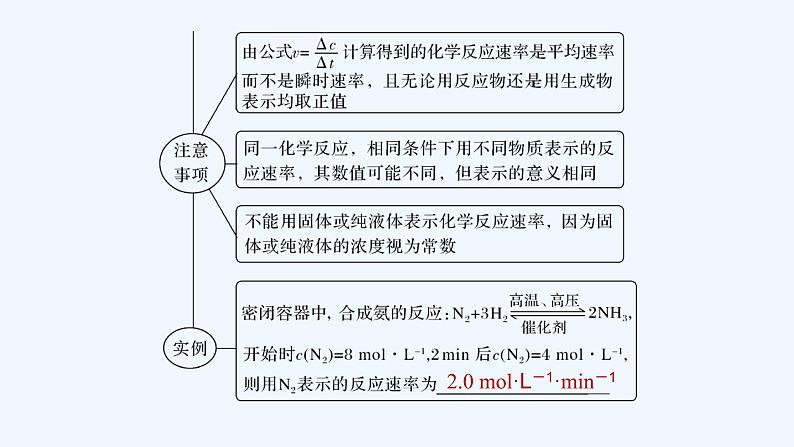
1.化学反应速率的概念与表示方法
2.0 ml·L-1·min-1
2.化学反应速率与化学计量数的关系对于已知反应:mA(g)+nB(g)===pC(g)+qD(g),在同一段时间内,用不同物质来表示该反应速率,当单位相同时,反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比。即v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
【诊断1】 判断下列叙述的正误(正确的划“√”,错误的划“×”)。
1.影响化学反应速率的因素
二、影响化学反应速率的因素
(1)内因反应物本身的性质是主要因素。如相同条件下Mg、Al与稀盐酸反应的速率大小关系为__________。
(2)外因(只改变一个条件,其他条件不变)
(3)“惰气”对反应速率的影响
(1)基元反应:大多数化学反应往往经历多个反应步骤才能实现,其中________反应都称为基元反应。如,H2(g)+I2(g)===2HI(g),经历了如下两步基元反应:I2===2I H2+2I===2HI
(2)活化分子、活化能①化学反应中,能量较高、有可能发生有效碰撞的分子称为活化分子。②活化分子的平均能量与所有分子的平均能量之差称为活化能。(3)有效碰撞与化学反应速率当增加反应物的浓度时,单位体积内反应物的活化分子数目增多,反应物发生有效碰撞的次数增多,反应速率增大。
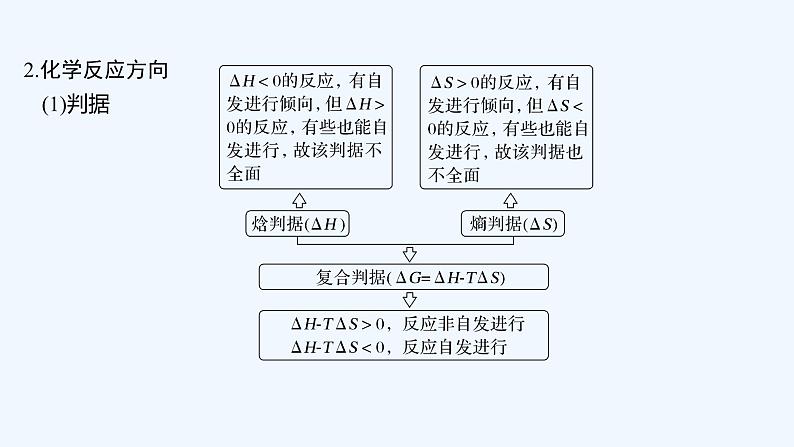
(1)含义:反应物转化为生成物的过程中要经过能量较高的过渡状态。(2)活化能:过渡状态的平均能量与反应物分子的平均能量的差为反应的活化能(如图)。
图中:E1为______________,使用催化剂时的活化能为E3,反应热为_______。(注:E2为逆反应的活化能)(3)活化能与化学反应速率化学反应速率与反应的活化能大小密切相关,活化能越小,反应速率增大。
【诊断2】 判断下列叙述的正误(正确的划“√”,错误的划“×”)。
(1)对于反应:2H2O2===2H2O+O2↑,加入MnO2或降低温度都能加快O2的生成速率( )(2)反应C(s)+H2O(g)===CO(g)+H2(g)在固定容积的容器中进行,充入N2后,体系压强增大,反应速率加快( )(3)升高温度可以使吸热反应的反应速率增大,但放热反应的反应速率减小( )(4)两试管各加入5 mL 0.1 ml·L-1Na2S2O3溶液,同时分别滴入5 mL 0.1 ml·L-1硫酸和盐酸,两支试管同时变浑浊( )
考点二 化学反应速率的影响因素、活化能
考点一 化学反应速率的计算与比较
考点三 “变量控制”法探究影响化学反应速率的因素
A.v(X)=0.30 ml·L-1·min-1B.v(Y)=0.02 ml·L-1·min-1C.v(Z)=0.02 ml·L-1·min-1D.v(W)=0.10 ml·L-1·min-1
2.一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
A.v(N2)=0.125 ml·L-1·min-1B.v(H2O)=0.375 ml·L-1·min-1C.v(O2)=0.225 ml·L-1·min-1D.v(NH3)=0.250 ml·L-1·min-1
化学反应中各物质浓度的计算模板——“三段式”法
❶写出有关反应的化学方程式。❷找出各物质的起始量、转化量、某时刻量。❸根据已知条件列方程式计算。
题组二 化学反应速率大小的比较
A.v(H2)=0.01 ml·L-1·s-1B.v(N2)=0.3 ml·L-1·min-1C.v(NH3)=0.15 ml·L-1·min-1D.v(H2)=0.3 ml·L-1·min-1
解析 ②经转化可表示为v(CO)=2v(NO2)=1.4 ml·L-1·min-1;③v(CO)=4v(N2)=1.6 ml·L-1·min-1;④v(CO)=v(CO2)=1.1 ml·L-1·min-1;⑤v(CO)=2v(NO2)=0.02 ml·L-1·s-1=1.2 ml·L-1·min-1,故③>①>②>⑤>④。
题组一 影响化学反应速率的因素
解析 ①铁粉是固体,增加铁粉的质量,反应速率不变,错误;②将容器的容积缩小一半,H2O(g)、H2(g)的浓度增大,反应速率加快,正确;③保持容器的容积不变,充入N2使体系压强增大,H2O(g)、H2(g)的浓度不变,反应速率不变,错误;④保持容器的容积不变,充入水蒸气使体系压强增大,H2O(g)浓度增大,反应速率加快,正确。
A.保持容器容积不变,向其中加入1 ml H2(g),反应速率一定加快B.保持容器容积不变,向其中加入1 ml N2(N2不参加反应),反应速率一定加快C.保持容器内气体压强不变,向其中加入1 ml N2(N2不参加反应),反应速率一定加快D.保持容器内气体压强不变,向其中加入1 ml H2(g)和1 ml I2(g),反应速率一定加快
解析 增大H2的物质的量且保持容器容积不变,H2的浓度增大,反应速率加快,A项正确;保持容器容积不变,向其中加入1 ml N2(N2不参加反应),反应混合物各组分的浓度不变,反应速率不变,B项错误;保持容器内气体压强不变,向其中充入1 ml N2(N2不参加反应),容器体积增大,各组分的浓度减小,反应速率减小,C项错误;保持容器内气体压强不变,向其中加入1 ml H2(g)和1 ml I2(g),因容器的体积变为原来的2倍,起始物质的量变为原来的2倍,则浓度不变,反应速率不变,D项错误。
影响化学反应速率的答题方向
❶解释影响反应速率的因素
❷催化剂(绝大多数催化剂都有其活性温度范围,温度过高,易使催化剂活性降低)
题组二 活化能与反应机理
3.已知热化学方程式H2(g)+2ICl(g)===2HCl(g)+I2(g) ΔH=a kJ·ml-1。其反应过程如下:①H2(g)+ICl(g)===HClI(g)+H(g) (慢)②H(g)+ICl(g)===HCl(g)+I(g) (快)③HClI(g)===HCl(g)+I(g) (快)④__________ (快)
下列说法错误的是( )A.四个反应中活化能最大的是①B.反应④为I(g)+I(g)===I2(g)C.总反应的速率主要由反应①决定D.若a<0,则生成物的总能量大于反应物的总能量
解析 活化能越大,反应速率越慢,A正确;由总反应及各步反应式知,反应④中应有I2(g)生成,B正确;化学反应的速率取决于反应速率最慢的一步,C正确;ΔH=生成物总能量—反应物总能量,放热反应中生成物总能量小于反应物总能量,D错误。
4.(2021·荆州模拟)光照条件下,甲烷氯化反应是一个自由基型的取代反应。在链转移反应过程中,经历两步反应:(·CH3和Cl·分别表示甲基和氯原子)反应1:CH4(g)+Cl·(g)→·CH3(g)+HCl(g);反应2:·CH3(g)+Cl2(g)→CH3Cl(g)+Cl·(g)。各物质的相对能量变化如图所示。下列说法不正确的是( )
A.链转移反应的反应速率由第1步反应决定B.反应1的活化能Ea=16.7 kJ·ml-1C.链转移反应的反应热ΔH=-105.4 kJ·ml-1D.由图可知,过渡态结构的稳定性:1>2
解析 A.化学反应取决于化学反应速率慢的一步反应,由图可知,反应1的活化能大于反应2的活化能,则反应1的反应速率小于反应2,链转移反应的反应速率由第1步反应决定,故A正确;B.由图可知,反应1的活化能Ea=16.7 kJ·ml-1,故B正确;C.由图可知,链转移反应的反应物总能量高于生成物总能量,该反应为放热反应,反应热ΔH=-105.4 kJ·ml-1,故C正确;D.由图可知,过渡态1的能量高于过渡态2,则过渡态结构2的稳定性强于过渡态结构1,故D错误。
❶催化剂改变反应历程、活化能的示意图
❷使用催化剂,活化能降低,活化分子百分数增大,单位体积内活化分子数增大,反应速率增大。
【典例】 已知:2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O。某化学小组欲探究H2C2O4溶液和酸性KMnO4溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(忽略溶液体积变化):
下列说法不正确的是( )A.V1=1,V2=2B.设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响C.实验计时是从溶液混合开始,溶液呈紫红色时结束D.实验Ⅲ中用酸性KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=0.01 ml·L-1·min-1
“变量控制”法的解题流程
【对点训练】 为了进一步探究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。
请完成此实验设计,其中:V1=________,V6=________,V9=________。
解析 若研究CuSO4的量对H2生成速率的影响,则实验中除CuSO4的量不同之外,其他物质的量均相同,则V1=V2=V3=V4=V5=30,最终溶液总体积相同。由实验F可知,溶液的总体积均为50 mL,则V6=10,V9=17.5。
微专题19 高考热点——催化剂与反应机理
【典例】 (2021·湖南卷)铁的配合物离子(用[L—Fe—H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
催化反应机理的分析思维模型
1.(2021·1月湖南适应性考试)据文献报道,某反应的反应历程如图所示:
解析 分析图可知,反应一共经历4步历程,依据图像差值分析,步骤4的正反应活化能最大。
1.化学反应速率常数及应用
微专题20 化学反应速率常数及其应用
(1)速率常数含义速率常数(k)是指在给定温度下。反应物浓度皆为1 ml·L-1时的反应速率。在相同的浓度条件下,可用速率常数大小来比较化学反应的反应速率。化学反应速率与反应物浓度(或浓度的次方)成正比,而速率常数是其比例常数,在恒温条件下,速率常数不随反应物浓度的变化而改变。因此,可以应用速率方程求出该温度下任意浓度时的反应速率。
(3)速率常数的影响因素温度对化学反应速率的影响是显著的,速率常数是温度的函数,同一反应,温度不同,速率常数将有不同的值,一般温度越高,速率常数越大,但浓度不影响速率常数。
2.K与k正、k逆的一般定量关系
【典例】 三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g) ΔH=+48 kJ·ml-1,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
(2)图中A、B、C、D点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K=________ml-1·L。已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2 ml·L-1,此时v正________v逆(填“>”或“<”)。
下列说法正确的是( )A.600~1 200 s,生成NO2的平均速率为5.0×10-4 ml·L-1·s-1B.反应2 220 s时,放出的O2体积为11.8 L(标准状况)C.反应达到平衡时,v正(N2O5)=2v逆(NO2)D.推测上表中的x为3 930
A.其他条件相同时,催化剂浓度越大,反应速率越大B.其他条件相同时,降冰片烯浓度越大,反应速率越大C.条件①,反应速率为0.012 ml·L-1·min-1D.条件②,降冰片烯起始浓度为3.0 ml·L-1时,半衰期为62.5 min
2.(2021·辽宁卷)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是( )
A.0~30 min时间段内,Y的平均反应速率为6.67×10-3 ml·L-1·min-1B.反应开始后,体系中Y和Z的浓度之比保持不变C.如果反应能进行到底,反应结束时62.5%的M转化为ZD.反应①的活化能比反应②的活化能大
3. (2021·河北卷)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N===X+Y;②M+N===X+Z。反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是( )
4. (2021·湖南卷节选)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 ml NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=____________ ml·L-1·min-1(用含t1的代数式表示)。
1.在实验或生活中为了控制反应速率,下列做法不正确的是( )
A.用过氧化氢制取氧气时可加入少量的二氧化锰以增大反应速率B.为加快制取氢气的速率可以用锌粒代替锌片C.为降低浓硫酸与Cu反应制备SO2的速率可以采用稀硫酸代替浓硫酸D.为了延长疫苗的保质期在运输和保存的过程中最好保持较低的温度
解析 稀硫酸与Cu不反应,而浓硫酸与Cu在加热条件下反应才能制备SO2,故C错误。
当用氢气浓度的减少来表示该化学反应的速率时,其速率为( )A.0.4 ml·L-1·s-1B.0.6 ml·L-1·s-1C.0.9 ml·L-1·s-1D.1.2 ml·L-1·s-1
3.一定温度下,反应①C(s)+CO2(g)===2CO(g) ΔH>0,反应②2SO2(g)+O2(g)===2SO3(g) ΔH<0。下列有关以上两个反应的说法正确的是( )
A.降低温度反应①的速率减小,反应②的速率增大B.增大压强反应①的速率不变,反应②的速率增大C.增大压强反应①的速率增大,反应②的速率增大D.升高温度反应①的速率增大,反应②的速率减小
解析 降低温度反应速率减小,升高温度反应速率增大,A、D错误;对于有气体参加的可逆反应,增大压强反应速率增大,减小压强反应速率减小,B错误,C正确。
4.(2021·江苏淮安高三期中)下列措施可使H2的生成速率减小的是( )
A.Na与H2O反应制取H2,增加H2O的用量B.Al与稀硫酸反应制取H2,向稀硫酸中加入K2SO4溶液C.Mg与H2O反应制取H2,将冷水改为热水D.碳粉与H2O(g)反应制取H2,增加碳粉的用量
解析 A项,Na与水反应时,增大水的用量,水是纯液体,量变浓度不变,错误;B项,往稀硫酸中加入K2SO4溶液,溶液体积增大,浓度减小,反应速率减小,正确;C项,将冷水改为热水,温度升高,反应速率加快,错误;D项,碳粉是固体,增加其用量反应速率不变,错误。
5.(2021·江苏启东中学测试)下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多B.有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增大活化分子的百分数,从而使反应速率增大C.升高温度能使化学反应速率增大的主要原因是减小了反应物分子中活化分子的百分数D.催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大反应速率
解析 增大浓度,单位体积内活化分子数目增多,活化分子百分数不变,则使有效碰撞次数增大,反应速率加快,A项错误;有气体参加的化学反应,若增大压强(即缩小反应容器的容积),单位体积内活化分子数目增多,从而使反应速率增大,但活化分子百分数不变,B项错误;升高温度能使化学反应速率增大的主要原因是提供分子需要的能量,活化分子的百分数增大,从而使有效碰撞次数增大,则反应速率加快,C项错误;催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大反应速率,D项正确。
7.(2021·邯郸模拟)如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质的能量变化关系图,下列说法正确的是( )
A.题述反应为吸热反应B.升高温度,Ea1、Ea2 均减小,反应速率加快C.增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小D.第一步反应的速率大于第二步反应的速率
8.(2021·芜湖模拟)在一密闭容器中通入W、X、Y、Z四种气体,保持一定温度,在t1~t4时测得各物质的浓度如表,则下列判断正确的是( )
根据表中的测定结果,下列结论不正确的是( )A.表中x的值为3.3×10-4B.化学反应速率v=2.2c(CO) c(NO2)C.升高温度,各物质浓度不变,化学反应速率不变D.催化剂可能对k影响较大
11.Ⅰ.下列各项分别与影响化学反应速率的哪个因素关系最为密切?(1)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气泡有快有慢:____________________________。(2)MnO2加入双氧水中放出气泡更快:_______________。
Ⅱ.在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
(1)比较t2时刻,正逆反应速率大小v正__________v逆。(填“>“=”或“<”)(2)若t2=2 min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为__________________。(3)t3时刻化学反应达到平衡,反应物的转化率为____________。(4)如果升高温度,则v逆__________(填“增大”“减小”或“不变”)。
0.25 ml·L-1·min-1
12.汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下Ⅰ:NO+Pt(s)===NO(*) [Pt(s)表示催化剂,NO(*)表示吸附态NO,下同]Ⅱ:CO+Pt(s)===CO(*)Ⅲ:NO(*)===N(*)+O(*)Ⅳ:CO(*)+O(*)===CO2+2Pt(s)Ⅴ:N(*)+N(*)===N2+2Pt(s)Ⅵ:NO(*)+N(*)===N2O+2Pt(s)
尾气中反应物及生成物浓度随温度的变化关系如图。
(1)330 ℃以下的低温区发生的主要反应的化学方程式是________________________________。(2)反应Ⅴ的活化能________(填“<”“>”或“=”)反应Ⅵ的活化能,理由是_________________________________________________________________。
生成N2O的选择性高,说明反应Ⅵ的化学反应速率大,该反应的活化能就小
下列说法中正确的是( )A.FeO+也是该反应的催化剂B.第一步中Fe+与N2O的碰撞仅部分有效C.第二步反应速率小于第一步反应速率D.增大CO的浓度可显著增大处理N2O的反应速率
解析 A.FeO+为中间产物,不作催化剂,故A错误;B.由信息可知,第一步为慢反应,活化能较大,则第一步中Fe+与N2O的碰撞仅部分有效,故B正确;C.第二步反应不影响总反应达到平衡所用的时间,则第二步反应速率大于第一步反应速率,故C错误;D.CO参与第二步反应,且不影响达到平衡的时间,则增大CO的浓度对处理N2O的反应速率几乎无影响,故D错误。
14.(2021·济南模拟)某课题组研究煤燃烧过程中氮氧化物氧化砷的微观机理,得到如下图像和数据。(其中k为速率常数,Ea为活化能)。对于所研究的三个反应,下列说法错误的是( )
反应动力学参数 反应 Ea/(kJ·ml-1)As+N2O―→AsO+N2 78.45As+NO2―→AsO+NO 2.58As+NO―→AsO+N 155.85
A.相同条件下的氧化性:NO2>NOB.相同条件下,As与NO的反应速率最慢C.升高温度能增大As与N2O反应的活化能D.升高温度不能显著加快As与NO2的反应速率
解析 由As+NO2―→AsO+NO可知,N元素的化合价降低,二氧化氮为氧化剂.则相同条件下的氧化性:NO2>NO,故A正确;由题干信息可知,NO与As反应对应的活化能最大,则相同条件下As与NO的反应速率最慢,故B正确;升高温度,提供能量,可增大活化分子百分数,增大反应速率,而反应的活化能不变,故C错误;由图可知,As与NO2反应中对应的k受温度影响不大,则升高温度不能显著加快As与NO2的反应速率,故D正确。
15.一氧化二氮(N2O)气体具有轻微的麻醉作用,被广泛应用于医学中。(1)在恒容容器、不同温度(T)下,反应2N2O(g)===2N2(g)+O2(g) ΔH=-163 kJ·ml-1中N2O分解半衰期随起始压强的变化关系如图所示(半衰期指任一浓度的N2O消耗一半时所需的时间),则T1________(填“>”“<”或“=”)T2。当温度为T1、起始压强为p0,反应至t1 min时,体系压强p=________(用p0表示)。
(2)碘蒸气能大幅度提高N2O的分解速率,反应历程:第一步 I2(g)===2I(g) (快反应)第二步 I(g)+N2O(g)===N2(g)+IO(g) (慢反应)第三步 IO(g)+N2O(g)===N2(g)+O2(g)+I(g) (快反应)实验表明,N2O的分解速率方程为v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是________(填字母)。A.温度升高,k增大B.第一步反应对总反应速率起决定作用C.第二步反应的活化能比第三步反应的大D.N2O的分解速率与I2浓度无关
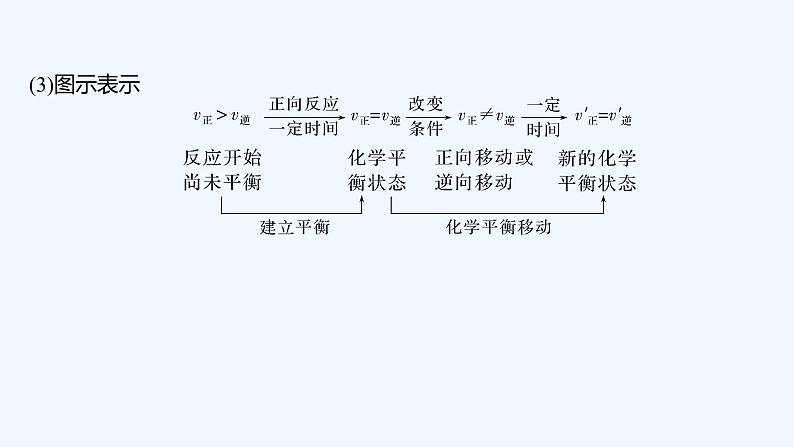
2024版新教材高考化学全程一轮总复习第七章化学反应速率与化学平衡第23讲化学平衡状态化学平衡移动课件: 这是一份2024版新教材高考化学全程一轮总复习第七章化学反应速率与化学平衡第23讲化学平衡状态化学平衡移动课件,共49页。PPT课件主要包含了同一条件下,同一条件,反应物,生成物,3平衡特点,答案D,②④⑤,答案C,减弱这种改变,答案B等内容,欢迎下载使用。
2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题十一 化学实验: 这是一份2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题十一 化学实验,文件包含2023版创新设计高考化学新教材苏教版总复习一轮课件第一单元化学实验常用仪器和基本操作pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第三单元高考化学综合实验题探究pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第二单元物质的分离与提纯pptx等3份课件配套教学资源,其中PPT共180页, 欢迎下载使用。
2023版创新设计高考化学(新教材人教版)总复习一轮课件第八章 化学反应速率与化学平衡: 这是一份2023版创新设计高考化学(新教材人教版)总复习一轮课件第八章 化学反应速率与化学平衡,文件包含2023版创新设计高考化学新教材人教版总复习一轮课件第一讲化学反应速率pptx、2023版创新设计高考化学新教材人教版总复习一轮课件第三讲化学平衡常数化学反应的调控pptx、2023版创新设计高考化学新教材人教版总复习一轮课件第二讲化学平衡与化学反应的方向pptx等3份课件配套教学资源,其中PPT共180页, 欢迎下载使用。












