



2024版新教材高考化学全程一轮总复习第七章化学反应速率与化学平衡微专题大素养19化学反应速率和化学平衡图像课件
展开考点一 常规图像分类突破1.瞬时速率—时间图像(1)当可逆反应达到一种平衡后,若某一时刻外界条件发生改变,都可能使速率—时间图像的曲线出现不连续的情况,根据出现“断点”前后的速率大小,即可对外界条件的变化情况作出判断。如图t1时刻改变的条件可能是使用了催化剂或增大压强(仅适用于反应前后气体物质的量不变的反应)。
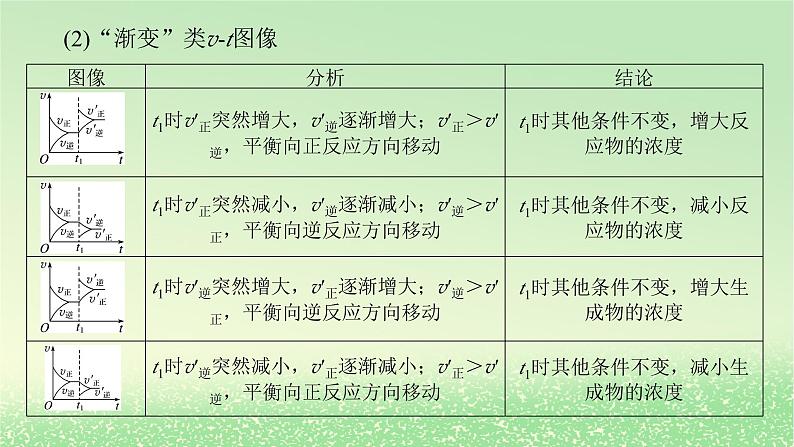
(2)“渐变”类vt图像
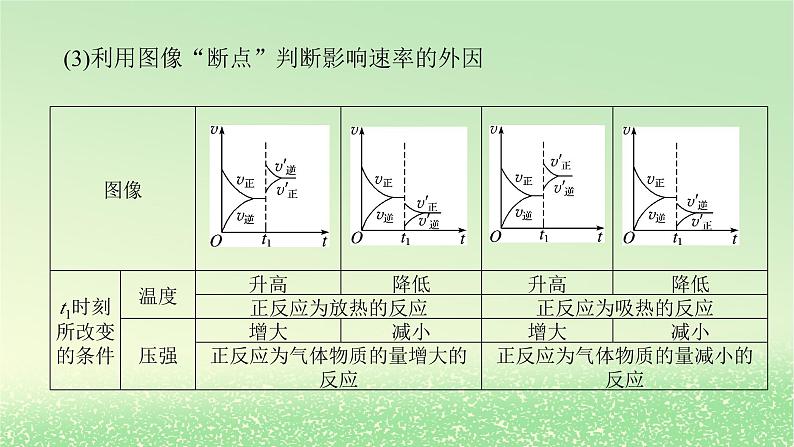
(3)利用图像“断点”判断影响速率的外因
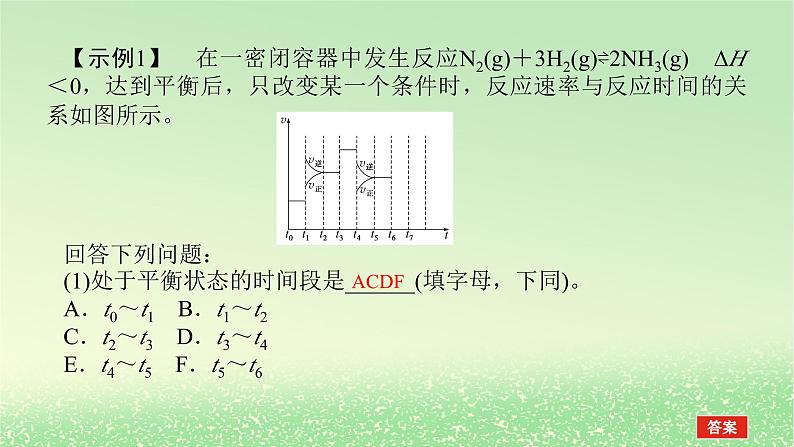
【示例1】 在一密闭容器中发生反应N2(g)+3H2(g)⇌2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。回答下列问题:(1)处于平衡状态的时间段是______(填字母,下同)。A.t0~t1 B.t1~t2C.t2~t3 D.t3~t4E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。A.增大压强 B.减小压强C.升高温度 D.降低温度E.加催化剂 F.充入氮气t1时刻____________;t3时刻____________;t4时刻____________。(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是________。A.t0~t1 B.t2~t3C.t3~t4 D.t5~t6
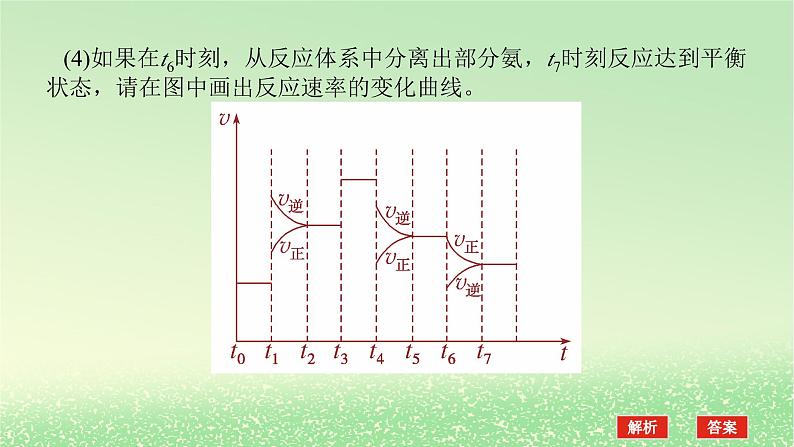
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
解析:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。(2)t1时,v正、v逆同时增大,且v逆增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最高。(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达到平衡,据此可画出反应速率的变化曲线。
2.全程速率—时间图像例如:Zn与足量盐酸的反应,化学反应速率随时间的变化出现如图所示情况。(1)AB段(v增大),原因是反应放热,溶液温度逐渐升高,v增大。(2)BC段(v减小),原因是溶液中c(H+)逐渐减小,v减小。
【示例2】 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) ⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
解析:A项,化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,一定未达平衡,错误;B项,a到b时正反应速率增加,反应物浓度随时间不断减小,错误;C项,从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,错误;D项,随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,SO2的转化率将逐渐增大,正确。
3.含量—时间—温度(压强)图像常见图像形式有如下几种。其中C%指生成物的百分含量,B%指反应物的百分含量。
【示例3】 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ⇌yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________。(2)根据图示可确定x∶y=________。
0.02 ml·L-1·min-1
(3)0~10 min容器内压强______(填“变大”“不变”或“变小”)。(4)推测第10 min引起曲线变化的反应条件可能是________(填编号,下同);第16 min引起曲线变化的反应条件可能是________。①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”“=”或“<”)。
4.转化率(或质量分数)与压强—温度图像恒压线图像
【示例4】 已知某可逆反应mA(g)+nB(g)⇌pC(g)在密闭容器中进行,如图表示在不同反应时间(t)时,温度(T)和压强(p)与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )A.T1<T2,p1>p2,m+n>p,放热反应B.T1>T2,p1<p2,m+n>p,吸热反应C.T1<T2,p1>p2,m+n<p,放热反应D.T1>T2,p1<p2,m+n<p,吸热反应
解析:由图可知,压强一定时,温度T1先达到平衡,故温度:T1>T2,升高温度,B在混合气体中的体积分数减小,说明平衡正向移动,正反应为吸热反应;温度一定时,压强p2先达到平衡,故压强:p1<p2,增大压强,B在混合气体中的体积分数增大,说明平衡逆向移动,正反应为气体体积增大的反应,则m+n<p。
5.化学平衡中的其他图像(1)对于化学反应:mA(g)+nB(g) ⇌pC(g)+qD(g),M点前,表示从反应开始,v(正) >v(逆);M点为刚达到平衡点;M点后为平衡受温度影响的情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故ΔH<0。
(2)对于化学反应:mA(g)+nB(g)⇌pC(g)+qD(g),L线上所有的点都是平衡点。L线的上方(E点),A的百分含量大于此压强时平衡体系中A的百分含量,所以E点满足v(正)>v(逆);同理L线的下方(F点)满足v(正)
微点拨 图像题的解题方法
(1)先拐先平:在含量(转化率)—时间曲线中,先出现拐点的先达到平衡,说明该曲线反应速率大,表示温度较高、有催化剂、压强较大等。(2)定一议二:当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。(3)三步分析法:一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
考点二 复杂化学平衡图像分类突破【典型图像例析】题型一 转化率—投料比—温度图像【示例1】 将燃煤废气中的CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)。已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图:此反应_______(填“放热”或“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将______(填“增大”“减小”或“不变”)。
解析:当投料比一定时,温度越高,CO2的转化率越低,所以升温,平衡左移,正反应为放热反应。平衡常数只与温度有关,不随投料比的变化而变化。
题型三 最佳反应条件选择【示例3】 汽车尾气是雾霾形成的原因之一。研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g) ⇌4N2(g)+6H2O(g) ΔH<0根据下图判断提高脱硝效率的最佳条件是________________________________;氨氮比一定时,在400 ℃时,脱硝效率最大,其可能的原因是__________________________________。
氨氮物质的量之比为1,温度为400 ℃
在400 ℃时催化剂的活性最好,催化效率最高,同时400 ℃温度较高,反应速率快
(2)若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为______________________________________________。(3)用平衡移动原理解释为什么加入CO后NO转化为N2的转化率增大:_____________________________________________________。
该反应放热,升高温度,反应向逆反应方向进行
加入的CO会与NO的分解产物O2发生反应,促进NO分解平衡向生成N2的方向移动,导致NO转化率升高
题型五 陌生反应方程式书写【示例5】 向密闭容器中加入0.2 ml H2S,反应在不同温度(900~1 500 ℃)下达到平衡时,混合气体中各组分的体积分数如图所示,则在此温度区间内,H2S分解反应的化学方程式为__________________________________________________________。
解析:图中纵轴表示各组分的体积分数,H2S的分解反应为吸热反应,随着温度升高,体积分数减小的是反应物H2S,体积分数增大的是生成物单质硫和氢气;选择1 100 ℃时的数据进行分析,H2S的体积分数为70%,此时生成的两种单质的体积分数分别为20%、10%,若将单质硫写为“S”,则与氢气的体积分数应该相等,若将单质硫写为双原子分子“S2”,则氢气的体积分数为“S2”的两倍,故H2S分解反应的化学方程式为
[体验1] 下图是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂为_____、相应温度为____________;使用Mn作催化剂时,脱氮率b~a段呈现如图变化的可能原因是_______________________________________________________。
b~a段,开始温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡,随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐增大
[体验2] 采用一种新型的催化剂(主要成分是CuMn的合金),利用CO和H2制备二甲醚,反应为4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)。有研究者在压强为5.00 MPa的条件下,将H2和CO反应直接制备二甲醚,结果如下图所示,其中CO的转化率随温度升高而降低的原因是__________________________________________________________。
该反应为放热反应,温度升高,平衡逆向移动,导致CO的转化率降低
温度升高,催化剂的活性增大
2024版新教材高考化学全程一轮总复习第七章化学反应速率与化学平衡第23讲化学平衡状态化学平衡移动课件: 这是一份2024版新教材高考化学全程一轮总复习第七章化学反应速率与化学平衡第23讲化学平衡状态化学平衡移动课件,共49页。PPT课件主要包含了同一条件下,同一条件,反应物,生成物,3平衡特点,答案D,②④⑤,答案C,减弱这种改变,答案B等内容,欢迎下载使用。
2024届高考化学一轮总复习第七章化学反应速率与化学平衡微专题六涉及化学反应速率和平衡图像的综合应用课件: 这是一份2024届高考化学一轮总复习第七章化学反应速率与化学平衡微专题六涉及化学反应速率和平衡图像的综合应用课件,共43页。PPT课件主要包含了答案C,答案B,答案D,1×0025,-1-1-1,=640D错误,COg,1x1-x,x2x等内容,欢迎下载使用。
2023高考化学总复习微专题大素养化学平衡原理中的图像分析题13课件: 这是一份2023高考化学总复习微专题大素养化学平衡原理中的图像分析题13课件,共47页。PPT课件主要包含了答案C,答案D,答案B,答案A,5×10-4等内容,欢迎下载使用。













