





高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用授课ppt课件
展开自主预习·新知导学
一、从海水中提取镁和从海带中提取碘1.从海水中提取镁。(1)提取流程:
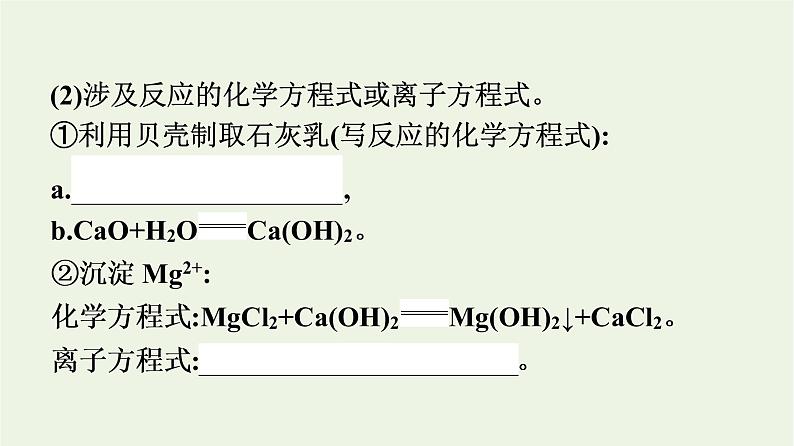
(2)涉及反应的化学方程式或离子方程式。①利用贝壳制取石灰乳(写反应的化学方程式):
③提取MgCl2:化学方程式:Mg(OH)2+2HCl══MgCl2+2H2O。离子方程式:Mg(OH)2+2H+══Mg2++2H2O。④制取金属镁:
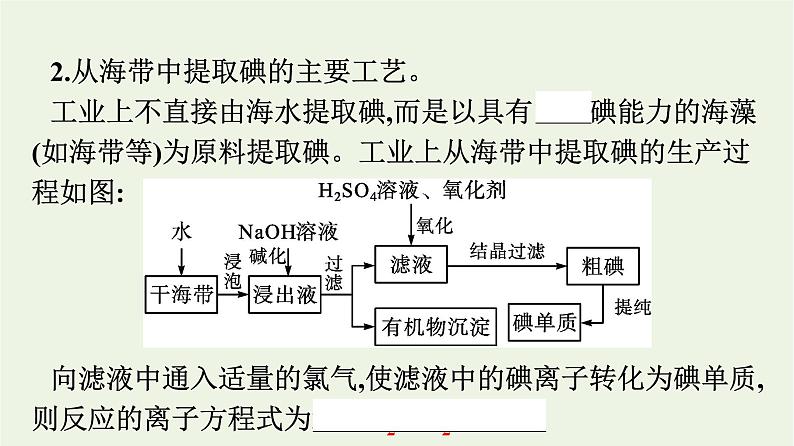
2.从海带中提取碘的主要工艺。工业上不直接由海水提取碘,而是以具有富集碘能力的海藻(如海带等)为原料提取碘。工业上从海带中提取碘的生产过程如图:
向滤液中通入适量的氯气,使滤液中的碘离子转化为碘单质,则反应的离子方程式为2I-+Cl2══ I2+2Cl-。
二、镁的原子结构与性质1.镁的存在。自然界中的镁主要以化合态的形式存在于地壳和海水中。2.镁的结构与性质。(1)镁的原子结构。镁的原子结构示意图为____________,镁原子最外层有2个电子,在化学反应中容易失去最外层电子,形成镁离子。(2)镁的物理性质。镁是银白色金属,密度小。镁合金硬度和强度都较大。
(3)镁的化学性质。镁是一种较活泼的金属,具有较强的还原性。可以与某些非金属单质、酸、盐以及某些氧化物反应。a.镁条在O2中燃烧,发出耀眼的强光,生成白色固体物质。反应的化学方程式为2Mg+O2 2MgO。b.镁条能与N2反应,反应的化学方程式为3Mg+N2 Mg3N2。c.镁与酸的反应:镁是活泼金属,能与盐酸、稀硫酸反应放出H2,反应的离子方程式为Mg+2H+══Mg2++H2↑。
d.镁能在CO2中燃烧,反应的化学方程式为2Mg+CO2 2MgO+C。3.镁的用途。(1)镁合金广泛用于制造火箭、导弹和飞机的部件等。(2)制造信号弹和焰火。(3)氧化镁是优质的耐高温材料。
【自主思考1】 工业上通过电解熔融MgCl2得到金属镁,工业上能不能通过电解熔融MgO来获得金属镁?提示:不能。因为MgO的熔点高,熔融时耗费更多能源,增加生产成本。【自主思考2】 电解MgCl2溶液是否可以得到金属镁?提示:不能。与电解NaCl溶液类似,发生的反应为MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑。【自主思考3】 镁着火能否用泡沫灭火器扑灭?提示:不能。因为Mg能在CO2中燃烧。
【效果自测】 1.已知MgO、MgCl2的熔点分别为2 800 ℃、604 ℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。从海水中提取金属镁,正确的方法是( )。
答案:D解析:从海水中提取镁时,首先用石灰乳将海水中的Mg2+沉淀出来,然后再用盐酸将其溶解得到MgCl2溶液,将MgCl2溶液蒸发结晶得到MgCl2·6H2O,将MgCl2·6H2O在一定条件下加热得到无水MgCl2,电解熔融的MgCl2可以得到金属Mg。
2.海带中含碘元素,有人设计了以下步骤来提取碘:①通足量氯气 ②将海带烧成灰,向灰中加水搅拌 ③加入CCl4,振荡 ④过滤 ⑤用分液漏斗分液。合理的操作顺序为( )。A.②④①③⑤B.②①③④⑤C.①③⑤②④D.③①②⑤④答案:A解析:向海带灰中加水后进行过滤,然后利用氧化还原反应的原理使滤液中的碘从化合态变成游离态,最后用有机溶剂萃取出碘单质并分液。
3.世界上60%的镁是从海水中提取的,其提取步骤如下:①把贝壳烧制成生石灰;②向海水中加入生石灰,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。下列说法正确的是( )。A.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净B.上述变化过程中包括了分解、化合、复分解、置换四种反应类型C.在氯化氢热气流中加热晶体发生的物理变化D.步骤⑤也可以采用电解该盐水溶液的方法
4.等质量的金属镁分别在下列气体中充分燃烧:①O2、②CO2、③N2、④空气,燃烧后固体的质量分别是W1 g、W2 g、W3 g、W4 g,试比较它们的大小: 。 答案:W2>W1>W4>W3
合作探究·释疑解惑
探究任务 Cl2、Br2、I2的性质比较
问题引领1.常温下氯气为气体,溴为液体,碘为固体,由此可得出什么结论?提示:按Cl→Br→I的顺序,其单质的熔、沸点逐渐升高,故常温下,Cl2、Br2、I2的状态变化为气态→液态→固态。
2.根据化学方程式Cl2+2KBr══2KCl+Br2,Cl2+2KI══ 2KCl+I2,Br2+2KI══2KBr+I2可得出什么结论?提示:三个反应均是氧化还原反应,可知,氧化性:Cl2>Br2>I2,还原性:I->Br->Cl-。
归纳提升Cl2、Br2、I2的性质比较1.Cl2、Br2、I2的物理性质。(1)相似性:①单质都有特殊颜色;②都能溶于水,但溶解度有差异;③都易溶于有机溶剂,在有机溶剂中都显示特殊颜色。
(2)递变性(按Cl→Br→I顺序):①单质的颜色逐渐加深;②熔、沸点逐渐升高,常温下的状态变化为气态→液态→固态;③密度逐渐增大。(3)特性:氯气易液化,溴易挥发,碘易升华。
(4)Cl2、Br2、I2在水及有机溶剂CCl4中的颜色
2.Cl2、Br2、I2的化学性质。(1)相似性:①都能与绝大多数的金属化合;②都能与H2反应生成HX(X=Cl、Br、I,下同),HX都易溶于水且都是强酸;③都能与水和碱液反应:X2+H2O══HX+HXO, X2+2NaOH══NaX+NaXO+H2O;④水溶液都有氧化性。
(2)递变性(按Cl→Br→I顺序):①氧化性依次减弱:Cl2>Br2>I2,如分别与Fe反应,产物分别为FeCl3、FeBr3、FeI2;还原性:Cl-
典型例题【例题】 (1)向溴化钠溶液中通入适量的氯气,产生的现象是 ,反应的化学方程式是 ;向碘化钾溶液中加入适量的溴水,产生的现象是 ,反应的化学方程式是 。
(2)由上述两个化学反应可知,Cl2、Br2、I2三种单质氧化性强弱的关系是 ;这样的化学反应原理,在海水的综合利用中的应用是 。 (3)下列海产品中可以考虑用于工业上大量地提取碘的是 。 ①贝壳 ②紫菜 ③鱼 ④海带
答案:(1)溶液由无色变为橙色 Cl2+2NaBr══Br2+2NaCl 溶液由无色变为棕黄色 Br2+2KI══I2+2KBr(2)Cl2>Br2>I2 从海水中提取溴和碘(3)②④
解析:(1)Cl2与NaBr反应的化学方程式是Cl2+2NaBr══Br2+2NaCl,Br2与KI反应的化学方程式是Br2+2KI══I2+2KBr。(2)Br2、I2在水溶液中分别呈橙色、棕黄色。在反应Cl2+2NaBr══Br2+2NaCl中Cl2是氧化剂,Br2是氧化产物,故氧化性Cl2>Br2;在反应Br2+2KI══I2+2KBr中Br2是氧化剂,I2是氧化产物,故氧化性Br2>I2。以适当的氧化剂将Br-、I-氧化的化学反应原理可以应用于从海水中提取溴和碘。(3)在四种海产品中,含碘相对较多的是紫菜和海带。
【变式训练1】 甲、乙、丙三溶液中各含有一种X-(X-为Cl-、Br-或I-),向甲溶液中加入淀粉溶液和氯水,溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙三种溶液中依次含有( )。A.Br-、I-、Cl-B.Br-、Cl-、I-C.I-、Br-、Cl-D.Cl-、I-、Br-答案:A
解析:向甲溶液中加入淀粉溶液和氯水,溶液变为橙色,应该是溴水的颜色,则甲中必含有Br-,Br-与Cl2发生置换反应生成Br2,由此否定C、D选项。再加丙溶液,颜色无明显变化,说明丙溶液中不含I-,否则加入后I-与Br2发生置换反应生成I2,溶液显蓝色,与题给条件不符,则丙溶液只能含有Cl-,I-必在乙溶液中。
【变式训练2】 已知常温下氯酸钾与浓盐酸反应放出氯气,现按图进行有关物质的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色的描述正确的是( )。
答案:A解析:氯气呈黄绿色,①处呈黄绿色;Cl2和NaBr反应生成Br2,溴水显橙色,②处呈橙色;Cl2和KI反应生成I2,淀粉溶液遇I2变蓝,③处呈蓝色;Cl2被NaOH溶液吸收后不呈现颜色,④处仍为白色棉花。
【变式训练3】 根据反应:①2Fe3++2I-══2Fe2++I2,②Br2+2Fe2+══2Fe3++2Br-,回答下列问题。(1)试判断离子的还原性由强到弱的顺序是 。 A.Br-、Fe2+、I-B.I-、Fe2+、Br-C.Br-、I-、Fe2+D.Fe2+、I-、Br-
(2)某溶液中含有Br-、Fe2+、I-,为了氧化I-而不影响Br-和Fe2+,选用的氧化剂是 ;为了氧化Fe2+、I-而不影响Br-,选用的氧化剂是 。试判断铁与单质溴反应的产物是 ,理由是 ;铁与单质碘反应的产物是 ,理由是 。 (3)I2与Br-能否发生反应? ,理由是 。
答案:(1)B (2)Fe3+ Br2 FeBr3 Br2的氧化性大于Fe3+ FeI2 Fe3+的氧化性大于I2 (3)不能 Br2的氧化性大于I2解析:(1)根据还原剂的还原性大于还原产物,可确定还原性强弱顺序应为I->Fe2+>Br-,氧化性强弱顺序应为Br2>Fe3+>I2。第(2)小题是对第(1)小题的深化和应用。根据氧化性、还原性的强弱顺序不仅可以判断一个反应能否发生,还可以确定氧化还原反应的产物。
高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用优质课课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用优质课课件ppt,共25页。PPT课件主要包含了学习目标,化合态,黑色固体,耀眼的白光,KIO3等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第三单元 海洋化学资源的综合应用多媒体教学ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第三单元 海洋化学资源的综合应用多媒体教学ppt课件,共37页。
2021学年第三单元 海洋化学资源的综合应用教案配套ppt课件: 这是一份2021学年第三单元 海洋化学资源的综合应用教案配套ppt课件,共42页。PPT课件主要包含了化合态,黑色固体,耀眼的白光,KIO3,×××等内容,欢迎下载使用。













