















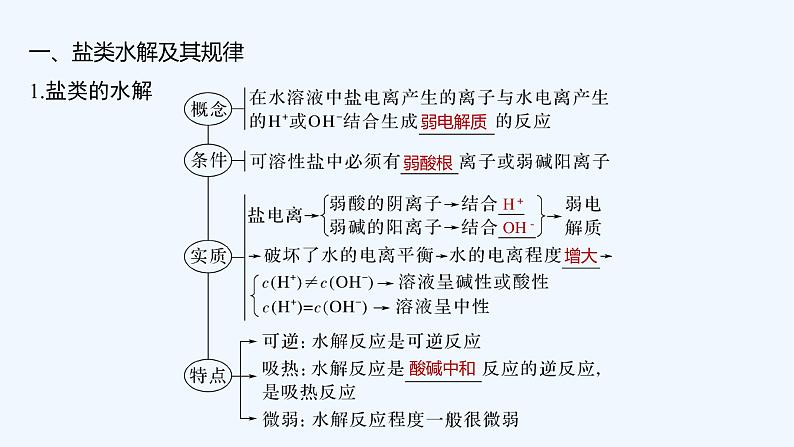
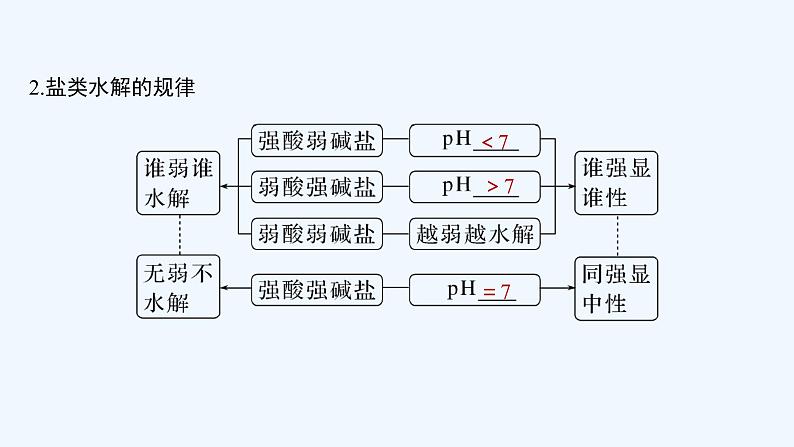

























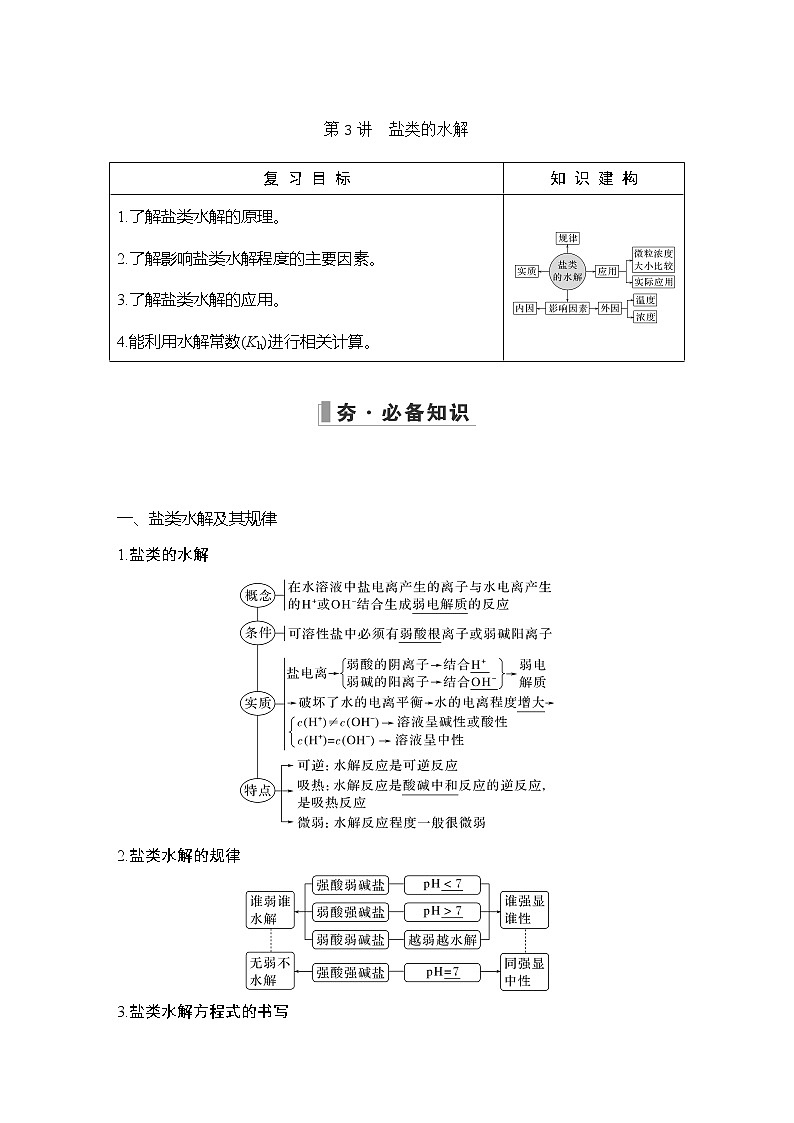

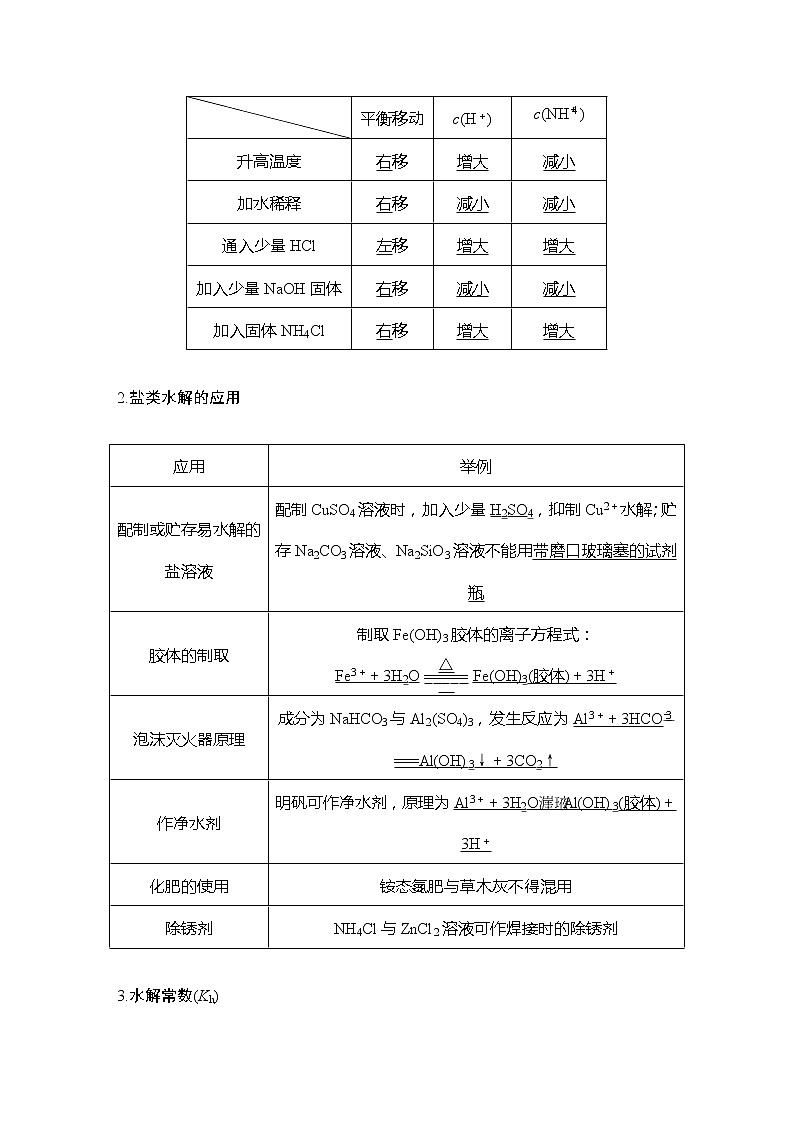
2023版 创新设计 高考总复习 化学 人教版第八章 水溶液中的离子平衡
展开本章笔答题答题语言规范强化练
1.在80 ℃时,纯水的pH小于7,为什么?
答案 室温时,纯水中的c(H+)=c(OH-)=10-7 mol·L-1,又因水的电离(H2OH++OH-)是吸热过程,故温度升高到80 ℃,电离程度增大,致使c(H+)=c(OH-)>10-7 mol·L-1,即pH<7。
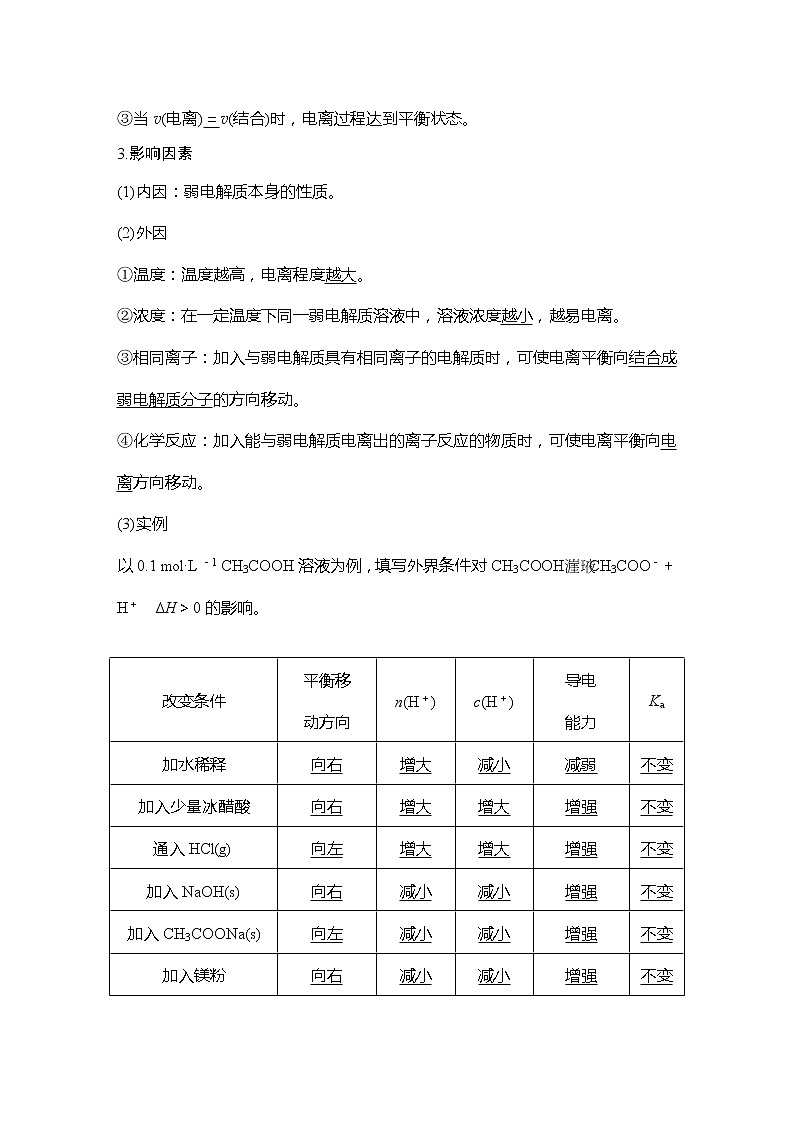
2.甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比小于(填“大于”“等于”或“小于”)10。请说明理由。甲瓶氨水浓度是乙瓶氨水浓度的10倍,故甲瓶NH3·H2O的电离程度比乙瓶NH3·H2O的电离程度小,所以甲、乙两瓶氨水中c(OH-)之比小于10。
3.利用浓氨水分解制备NH3,应加入NaOH固体,试用化学平衡原理分析NaOH的作用。
答案 NaOH固体溶于氨水后放热促使NH3挥发;增大OH-浓度,使平衡NH3+H2ONH3·H2ONH+OH-逆向移动,加快氨气逸出。
4.常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)>(填“>”“=”或“<”)c(CO),原因是:HCOCO+H+,HCO+H2OH2CO3+OH-,HCO的水解程度大于电离程度(用离子方程式和必要的文字说明)。
5.(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式:MgCl2·6H2OMg(OH)Cl+HCl↑+5H2O↑,MgCl2·6H2OMgO+2HCl↑+5H2O↑或Mg(OH)ClMgO+HCl↑。
(2)在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是:在干燥的HCl气流中,抑制了MgCl2的水解,且带走MgCl2·6H2O受热产生的水蒸气,故能得到无水MgCl2。
(3)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是:分解出HCl气体,抑制CeCl3水解。
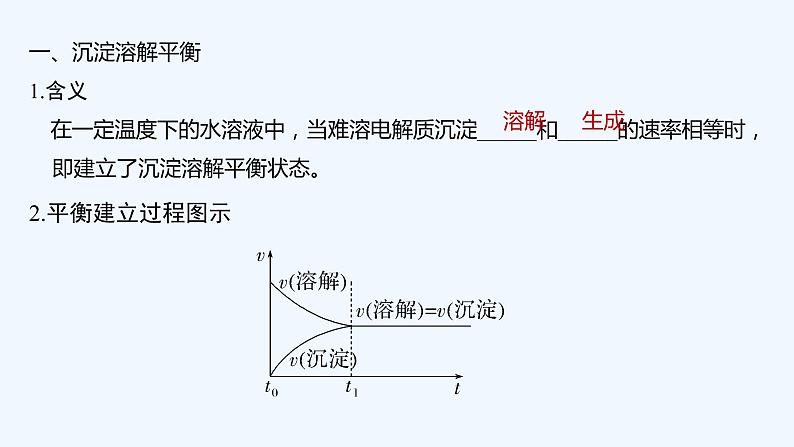
6.用沉淀溶解平衡解答下列问题。
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
答案 加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤。
(2)Ba2+有很强的毒性,胃酸酸性很强(pH约为1),医学上进行消化系统的X射线透视时,服用大量BaSO4仍然是安全的,其原因是:对于沉淀溶解平衡:BaSO4(s)Ba2+(aq)+SO(aq),H+不会影响Ba2+或SO的浓度,平衡不移动。
(3)有一种工艺流程是通过将AgCl沉淀溶于氨水,从含金、银、铜的金属废料中来提取银。已知在溶解后的溶液中测出含有[Ag(NH3)2]+,试从沉淀溶解平衡移动的角度解释AgCl沉淀溶解的原因:AgCl固体在溶液中存在沉淀溶解平衡AgCl(s)Ag+(aq)+Cl-(aq),由于Ag+和NH3·H2O结合成[Ag(NH3)2]+。使Ag+浓度降低,导致AgCl的沉淀溶解平衡向着溶解的方向移动。
(4)几种离子完全沉淀的pH
物质(25 ℃) | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
完全沉淀时的 pH范围 | ≥9.6 | ≥6.4 | ≥3 |
除去CuSO4酸性溶液中的FeSO4,方法是:首先滴加H2O2,将Fe2+完全转化为Fe3+,再慢慢加入CuO[或Cu2(OH)2CO3],调至pH>3,过滤。
7.用0.1 mol·L-1的NaOH溶液分别滴定体积均为10 mL浓度均为0.1 mol·L-1的HCl溶液和CH3COOH溶液,所得pH变化曲线如下:
图Ⅱ是NaOH滴定CH3COOH的pH变化曲线,判断的理由是:CH3COOH为弱电解质,0.1__mol·L-1的CH3COOH的pH大于1。
8.常考滴定终点的判断方法。
(1)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为Ti3++Fe3+===Ti4++Fe2+,达到滴定终点时的现象是:当滴入最后一滴标准液,溶液变成红色,且半分钟内不褪色。
(2)用标准酸性KMnO4溶液测定某补血口服液中Fe2+的含量时,酸性KMnO4溶液应放在酸式滴定管中,判断滴定终点的方法:滴入最后一滴酸性KMnO4溶液,溶液呈浅红色,且半分钟内不褪色。
(3)测定维生素C(C6H8O6)含量的方法:向其溶液中加入过量的碘水,发生反应:C6H8O6+I2―→C6H6O6+2HI,然后用已知浓度的Na2S2O3滴定过量的碘,发生反应:(I2+2S2O===S4O+2I-),可选用淀粉溶液作指示剂,滴定终点的现象是:滴入最后一滴Na2S2O3溶液,蓝色褪去,且半分钟不恢复。
(4)已知:Ag++SCN-===AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
①称取2.000 g硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有100__mL容量瓶、胶头滴管。
②准确量取25.00 mL溶液,酸化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为:溶液变为红色,且半分钟内不褪色。Cl2+H2OH++Cl-+HClO HCO+H2OH2CO3+OH-
2023版创新设计高考化学(新教材人教版)总复习一轮课件第八章 化学反应速率与化学平衡: 这是一份2023版创新设计高考化学(新教材人教版)总复习一轮课件第八章 化学反应速率与化学平衡,文件包含2023版创新设计高考化学新教材人教版总复习一轮课件第一讲化学反应速率pptx、2023版创新设计高考化学新教材人教版总复习一轮课件第三讲化学平衡常数化学反应的调控pptx、2023版创新设计高考化学新教材人教版总复习一轮课件第二讲化学平衡与化学反应的方向pptx等3份课件配套教学资源,其中PPT共180页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 人教版第十一章 有机化学基础(选考): 这是一份2023版 创新设计 高考总复习 化学 人教版第十一章 有机化学基础(选考),文件包含2023版创新设计高考总复习化学人教版最新版第1讲认识有机化合物pptx、2023版创新设计高考总复习化学人教版最新版第2讲烃和卤代烃pptx、2023版创新设计高考总复习化学人教版最新版第3讲烃的含氧衍生物pptx、2023版创新设计高考总复习化学人教版最新版第4讲基本营养物质有机高分子化合物pptx、2023版创新设计高考总复习化学人教版最新版第4讲基本营养物质有机高分子化合物doc、2023版创新设计高考总复习化学人教版最新版第1讲认识有机化合物doc、2023版创新设计高考总复习化学人教版最新版第3讲烃的含氧衍生物doc、2023版创新设计高考总复习化学人教版最新版第2讲烃和卤代烃doc、2023版创新设计高考总复习化学人教版最新版本章常考必备的重要有机转化关系及反应方程式书写强化练pptx、2023版创新设计高考总复习化学人教版最新版本章常考必备的重要有机转化关系及反应方程式书写强化练doc等10份课件配套教学资源,其中PPT共252页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 人教版第六章 化学反应与能量: 这是一份2023版 创新设计 高考总复习 化学 人教版第六章 化学反应与能量,文件包含2023版创新设计高考总复习化学人教版最新版第1讲化学能与热能pptx、2023版创新设计高考总复习化学人教版最新版第2讲原电池化学电源pptx、2023版创新设计高考总复习化学人教版最新版第3讲电解池金属的腐蚀与防护pptx、2023版创新设计高考总复习化学人教版最新版第3讲电解池金属的腐蚀与防护doc、2023版创新设计高考总复习化学人教版最新版第1讲化学能与热能doc、2023版创新设计高考总复习化学人教版最新版第2讲原电池化学电源doc、2023版创新设计高考总复习化学人教版最新版本章电池电极反应式或总反应式书写强化练pptx、2023版创新设计高考总复习化学人教版最新版本章电池电极反应式或总反应式书写强化练doc等8份课件配套教学资源,其中PPT共196页, 欢迎下载使用。












