
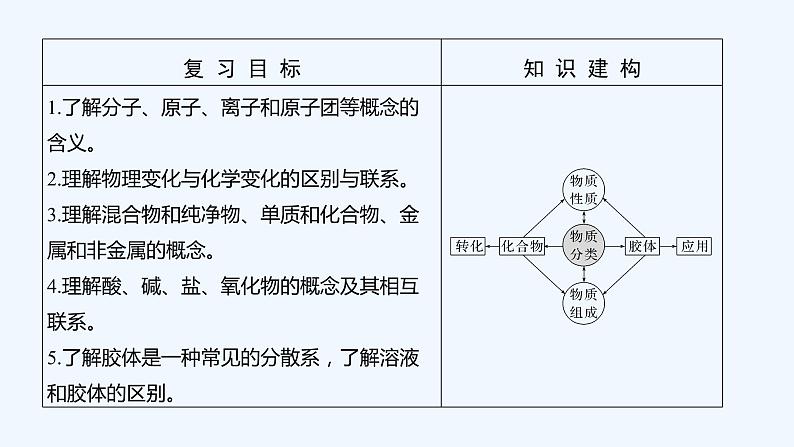







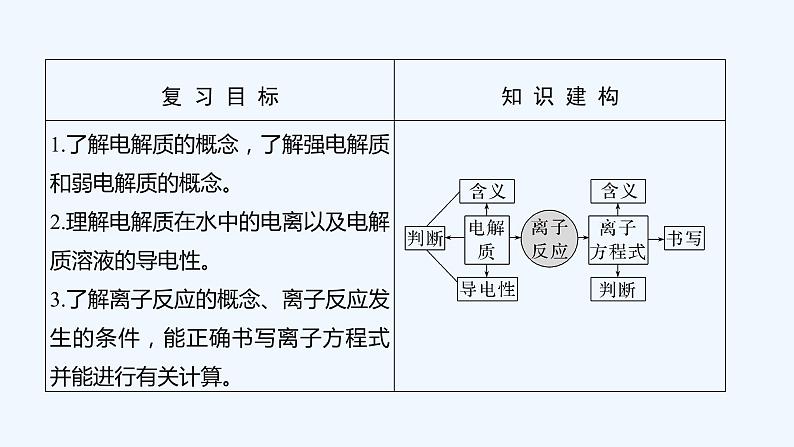





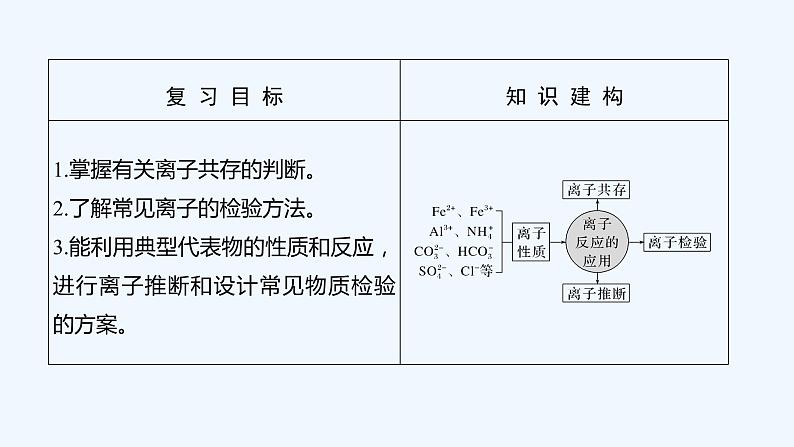




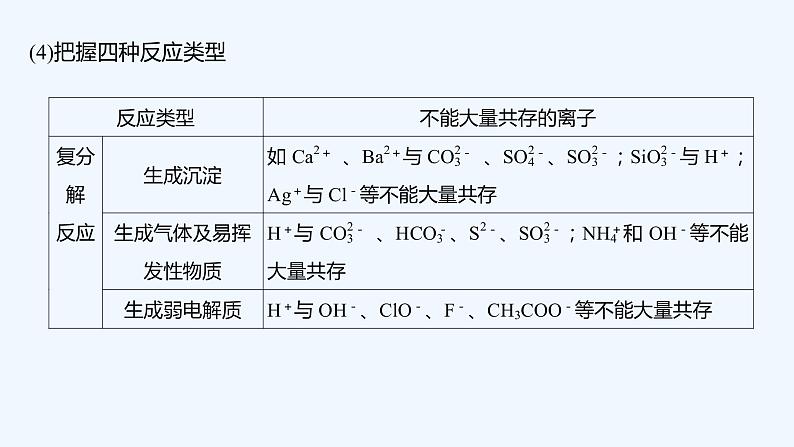






































2023版 创新设计 高考总复习 化学 人教版第二章 化学物质及其变化
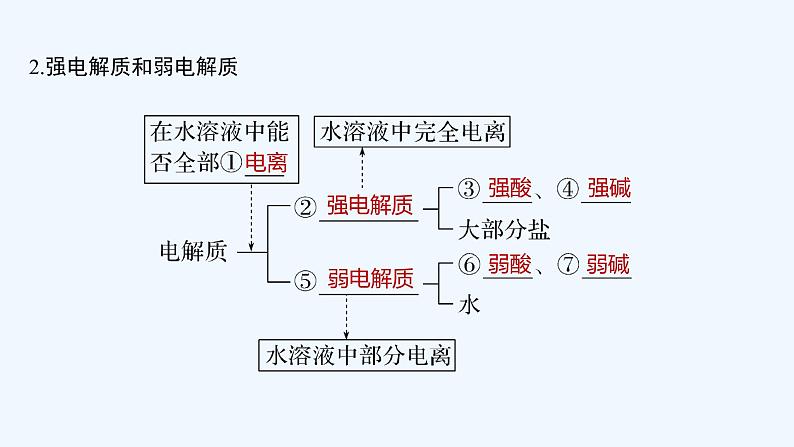
展开1.电解质和非电解质 (1)研究对象:均为__________。 (2)分类标准:_______导电的为电解质,________导电的是非电解质。 (3)导电条件:①水溶液 ②熔融状态。
2.强电解质和弱电解质
3.电解质的电离 (1)电解质的电离
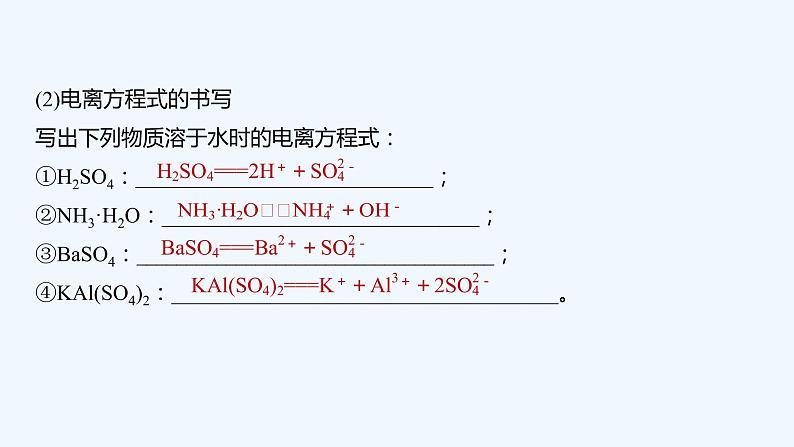
(2)电离方程式的书写写出下列物质溶于水时的电离方程式:①H2SO4:______________________________;②NH3·H2O:________________________________;③BaSO4:____________________________________;④KAl(SO4)2:_______________________________________。
(3)从电离的角度认识酸、碱、盐
金属阳离子(或铵根离子)
(1)NaCl溶液、Cu熔化都能导电,故NaCl溶液、Cu均为电解质( )(2)CO2、NH3溶于水能导电,所以二者均为电解质( )(3)HClO是弱酸,所以NaClO是弱电解质( )(4)NaCl溶液在电流的作用下电离成钠离子和氯离子( )(5)强电解质溶液的导电性比弱电解质溶液的导电性强( )答案 (1)× (2)× (3)× (4)× (5)×
【判一判】 判断下列说法是否正确,正确的打“√”,错误的打“×”。
1.离子反应 (1)概念:有离子参加的反应。 (2)本质:溶液中某些离子的种类或浓度_____________。 (3)离子反应发生的条件:
二、离子反应和离子方程式
(1)概念:用________参加反应的离子符号来表示化学反应的式子。(2)意义:离子方程式不仅可以表示某一个具体的化学反应,还可以表示_____________的离子反应。
(1)直接根据反应实质书写①明确物质在水溶液中的主要存在形式:碳酸钙难溶于水,不能以大量离子的形式而以____________形式存在于溶液中,盐酸中HCl以______和________的形式存在。②找出实际参加反应的微粒和生成的微粒,写在连接线两侧:CaCO3溶于盐酸的本质是____________与______反应生成________和________,即___________________________________________。③配平:利用______守恒、______守恒配平方程式:____________________________________________
3.书写离子方程式的基本方法(以CaCO3与盐酸反应为例)
CaCO3+H+——Ca2++CO2↑+H2O
CaCO3+2H+===Ca2++CO2↑+H2O
(2)根据化学方程式改写
CaCO3+2HCl===CaCl2+H2O+CO2↑
CaCO3+2H++2Cl-===Ca2++2Cl-+H2O+CO2↑
CaCO3+2H+===Ca2++H2O+CO2↑
答案 (1)× (2)× (3)× (4)× (5)× (6)×
考点二 离子方程式的书写
考点一 电解质的判断和溶液的导电性
考点三 离子方程式的正误判断
【典例1】 下列说法正确的是( )
A.某化合物的水溶液能导电,则该化合物为电解质B.BaSO4的饱和水溶液导电性很弱,故BaSO4是弱电解质C.强电解质都是离子化合物,弱电解质都为共价化合物D.等浓度的醋酸溶液的导电能力弱于NaOH溶液
解析 CO2、SO2的水溶液均能导电,但不是它们本身导电,而是反应生成的H2CO3和H2SO3导电,二者均为非电解质,A项错误;电解质的强弱与溶液的导电性没有必然的联系,BaSO4是盐,属于强电解质,B项错误;HCl是强电解质,但是共价化合物,C项错误;等浓度的醋酸溶液中自由移动的离子的浓度小于NaOH溶液,导电能力弱,D项正确。
规避判断电解质相关概念的误区❶单质和混合物既不是电解质也不是非电解质。❷电解质不一定能导电,如固态NaCl、液态HCl等;能导电的物质不一定是电解质,如铁、铝等金属单质。❸本身电离而导电的化合物才是电解质。如CO2、SO2、NH3的水溶液能导电,但均是非电解质。❹电解质的强弱与电解质溶液导电能力的强弱、溶解性的大小没有直接关系。如碳酸钙,其溶解性小,溶液导电性差,但其属于强电解质。
题组一 与电解质相关的判断1.下表中物质的分类组合完全正确的是( )
解析 KNO3为盐,属于强电解质。CH3COOH为弱酸,属于弱电解质。SO3为非金属氧化物,属于非电解质,A正确;Al为单质,既不是电解质也不是非电解质,B错误;H2O属于弱电解质,C错误;CH3COONH4为盐,属于强电解质,D错误。
题组二 电离方程式的书写2.写出下列过程的电离方程式。
①CH3COOH溶于水:________________________________________;②Ba(OH)2溶于水:________________________________________;③NaHSO4溶于水:______________________________________;④NaHSO4受热熔融:__________________________________;⑤NaHCO3溶于水:_______________________________,____________________;⑥NaHCO3受热熔融:__________________________________。
题组三 溶液的导电性3.向溶液中加入新物质时,其导电性(I)符合如图变化趋势的实验操作是( )
解析 乙酸溶液中通入氨气至过量,发生的是弱电解质醋酸与氨水反应生成了醋酸铵,醋酸铵是强电解质,所以导电能力会增强,故A错误;石灰水中通入CO2至过量,石灰水中的氢氧化钙是强电解质,随着二氧化碳的通入生成碳酸钙沉淀和水,离子浓度减小,导电能力减弱,恰好转化为碳酸钙和水时,导电能力最小,继续通入二氧化碳,会和水、碳酸钙反应生成碳酸氢钙,是强电解质,所以导电能力又增强,故B正确;亚硫酸中通入氯气至过量,亚硫酸是弱电解质,通入氯气会反应生成硫酸和盐酸,二者都是强电解质,所以导电能力随着氯气的通入增强,故C错误;氨水是弱电解质,导电能力弱,氨水中通入氯化氢气体,生成强电解质氯化铵,所以导电能力是增强的,故D错误。
常见的强电解质和弱电解质依据元素周期表,熟记常见的强电解质和弱电解质ⅠA:除LiOH外其余都是强碱。ⅡA:除Mg(OH)2、Be(OH)2外其余都是强碱。ⅢA:Al(OH)3是两性氢氧化物,即可看作弱碱,也可看作弱酸。ⅣA:H2CO3、H2SiO3均为弱酸。ⅤA:强酸:HNO3;中强酸:HNO2、H3PO4;NH3·H2O为弱碱。
ⅥA:强酸:H2SO4;弱酸:H2SO3、H2S。ⅦA:强酸:HCl、HBr、HI、HClO4等;弱酸:HF、HClO等。过渡元素中常见的弱碱:Fe(OH)3、Fe(OH)2、Cu(OH)2、Zn(OH)2等,它们也都难溶于水。注意:绝大多数盐都是强电解质,Pb(CH3COO)2、Fe(SCN)3等例外。
【典例2】 完成下列反应的离子方程式。
(1)澄清石灰水中加入稀盐酸_______________________________________;(2)石灰乳中加入盐酸_________________________________________;(3)向NaCl、Na2SO4的混合溶液中滴加足量AgNO3溶液____________,___________________________;(4)NH4Cl与NaOH两稀溶液混合__________________________________;(5)向NaHSO3溶液中加入过量NaHSO4溶液_____________________________;(6)过氧化钠溶于水____________________________。
❶一般规律①能拆分写成离子形式的物质:易溶的强电解质,包括强酸、强碱、大多数可溶性盐;②不能拆分写成化学式的物质:包括难溶电解质、弱电解质、气体、单质、氧化物。注意:浓盐酸、浓硝酸在离子方程式中可拆,浓硫酸不拆。❷微溶物的处理①微溶物作为产物视为沉淀,不拆分;②作反应物时,澄清溶液拆分为离子,浑浊液不拆分。
❸产物NH3·H2O的处理
题组一 简单反应离子方程式的书写1.写出下列反应的离子方程式。
(1)Na2SiO3溶液中滴加稀盐酸_______________________________________;(2)Cu(OH)2溶于稀硫酸_________________________________________;(3)Na2S溶液呈碱性______________________________________________;(4)Na投入FeCl3溶液中_____________________________________________。
题组二 多重反应离子方程式的书写2.完成下列反应的离子方程式。
(1)Ba(OH)2溶液与H2SO4溶液混合__________________________________;(2)Ba(OH)2溶液与(NH4)2SO4溶液混合________________________________;(3)CuSO4溶液与Ba(OH)2溶液混合_________________________________;(4)Ca(OH)2溶液与(NH4)2CO3溶液混合_______________________________;(5)Fe2O3溶于HI溶液中_____________________________________________。
题组三 信息给予题中离子方程式的书写3.按要求写出对应的离子方程式。
❶多重反应离子方程式书写的注意点多重反应是指电解质溶液混合产生的多种阴阳离子之间都能发生反应的现象,在书写这类反应的离子方程式时,要注意尝试多种离子结合可能发生的反应,书写时防止漏写其中的某一组反应。❷信息给予题中陌生离子方程式书写技巧(1)细读题干,找出反应物和生成物,判断该物质是否需要写成离子形式。(2)结合溶液环境配平离子方程式,注意质量守恒、电荷守恒、得失电子守恒。
【典例3】 (2021·贵州盘州一模)下列实验现象对应的离子方程式正确的是( )
❸“守恒”和“量比”陷阱离子方程式应符合质量守恒、电荷守恒和得失电子守恒,忽视某些守恒关系是命题者经常设置的“陷阱”。
题组一 化学式的合理拆分1.判断下列离子方程式是否正确。
答案 (1)× (2)× (3)× (4)× (5)×
题组二 离子方程式中的守恒关系2.判断下列离子方程式是否正确。
答案 (1)× (2)× (3)× (4)√ (5)× (6)√
题组三 综合判断3.(2021·重庆适应性考试)下列指定反应的离子方程式正确的是( )
4.(2022·福建泉州质检)下列离子方程式错误的是( )
离子方程式正误判断的四项要求
微专题4 与量有关的离子方程式的书写
类型一 连续反应型 连续反应型是指反应生成的离子又能跟剩余(过量)的反应物继续反应,跟用量有关。
连续反应型离子方程式的书写步骤❶判断反应物的用量,确定反应的产物;❷根据原子守恒、电荷守恒和得失电子守恒配平离子方程式。
【训练1】 写出符合下列要求的离子方程式:1.可溶性多元弱酸(或其酸酐)与碱溶液反应
如CO2通入NaOH溶液中:(1)碱过量:____________________________________;(2)碱不足:____________________________。
2.多元弱酸(或其酸酐)与更弱酸的盐溶液反应 如CO2通入NaAlO2溶液中: (1)NaAlO2过量:_________________________________________; (2)NaAlO2不足:____________________________________________。3.多元弱酸盐与强酸反应 如Na2CO3溶液与稀盐酸: (1)盐酸不足:________________________; (2)盐酸过量:____________________________________。
4.铝盐溶液与强碱溶液反应 如AlCl3与NaOH溶液的反应: (1)铝盐过量:_________________________________; (2)强碱过量:___________________________________。5.偏铝酸盐与强酸溶液反应 如NaAlO2与盐酸反应: (1)NaAlO2过量:_____________________________________; (2)强酸过量:________________________________________。
6.硝酸与变价金属的反应 如Fe与稀HNO3溶液反应 (1)Fe过量:__________________________________________________; (2)稀HNO3过量:____________________________________________。
类型二 反应先后型 一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应顺序不同而跟用量有关。又可称为竞争型。
反应先后型离子反应的一般顺序❶非氧化还原反应:一般是先H+与OH-反应生成H2O,然后生成沉淀,再生成弱酸、弱碱等弱电解质,最后是沉淀的溶解。❷氧化还原反应根据反应物氧化性、还原性的强弱,性质较强的优先反应。
【训练2】 写出下列反应的离子方程式:
(1)NH4HSO4溶液与NaOH溶液的反应NaOH不足:__________________________;NaOH过量:__________________________________________________。(2)向含有OH-、CO、AlO的溶液中,逐滴加入稀盐酸至过量,反应的离子方程式依次为__________________________;____________________________________________;________________________、____________________________________;________________________________________________。
(3)向含有H+、Al3+、 的溶液中,逐滴加入NaOH溶液至过量,反应的离子方程式依次为__________________________;__________________________________________;__________________________________;______________________________________________。(4)向含有Br-、I-的溶液中,逐滴加入氯水,反应的离子方程式依次为____________________________________;________________________________________。
类型三 组成配比型 当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足),因而跟用量有关。
“定一法”书写酸式盐与碱反应的离子方程式❶根据相对量将少量物质定为“1 ml ”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。❷依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。❸依据“先中和后沉淀”的思路正确书写离子方程式。
【训练3】 写出下列反应的离子方程式:
(1)Ca(HCO3)2溶液与NaOH溶液反应①NaOH不足:____________________________________________________;②NaOH过量:_____________________________________________________。(2)NaHCO3溶液与Ca(OH)2溶液反应①NaHCO3不足:____________________________________________________;②NaHCO3过量:_____________________________________________________。
(3)Ba(OH)2溶液与NaHSO4溶液反应①n[Ba(OH)2]∶n(NaHSO4)=1∶1___________________________________________________,此时溶液呈____性;②n[Ba(OH)2]∶n(NaHSO4)=1∶2______________________________________________,此时溶液呈_____性,若向该溶液中再加入Ba(OH)2溶液,离子方程式为__________________________。
(4)NH4Al(SO4)2与Ba(OH)2溶液反应①n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶1______________________________________________________________________;②n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶2________________________________________________________________________。
1.(2021·全国乙卷)下列过程中的化学反应,相应的离子方程式正确的是( )
解析 用碳酸钠溶液处理水垢中的硫酸钙,发生难溶电解质的转化,硫酸钙转化为碳酸钙,A正确;过量铁粉加入稀硝酸中,最终生成Fe2+,B错误;向硫酸铝溶液中滴加少量氢氧化钾溶液,反应的离子方程式为Al3++3OH-===Al(OH)3↓,C错误;氯化铜溶液中通入硫化氢,H2S是弱酸,应写化学式,反应的离子方程式为Cu2++H2S===CuS↓+2H+,D错误。
2.(2021·1月浙江选考)下列反应的方程式不正确的是( )
3.(2020·全国卷Ⅲ)对于下列实验,能正确描述其反应的离子方程式是( )
4.(2020·江苏卷)下列指定反应的离子方程式正确的是( )
1.下表中物质的分类组合完全正确的是( )
解析 HI为强电解质,盐酸和氨水均为混合物,不是电解质,Cl2不是化合物,NH3是非电解质不是电解质。
2.某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.氯化镁固体是非电解质B.氯化镁溶液是电解质C.氯化镁在水溶液中电离产生自由移动的离子D.氯化镁只有在溶液中才能导电
解析 A.MgCl2是强电解质,故A错误;B.MgCl2溶液属于混合物,不是电解质,也不是非电解质,故B错误;C.MgCl2在水溶液中电离出可以自由移动的镁离子和氯离子,故C正确;D.MgCl2在水溶液和熔融状态下都可以导电,故D错误。
4.下列说法正确的是( )
ml NaOH固体分别加入下列100 mL液体中,溶液导电性变化不大的是( ) A.自来水 ml·L-1稀硫酸 C.0.5 ml·L-1 NaCl溶液 D.0.5 ml·L-1 NaNO3溶液
解析 电解质溶液的导电性与离子浓度和离子所带电荷数成正比。若把0.05 ml NaOH固体加入100 mL液体中,溶液导电能力变化不大,则说明加入NaOH固体后离子浓度变化不大。A项,NaOH固体溶于自来水后,溶液中离子浓度变大,溶液导电能力变大;B项,加入0.25 ml·L-1的稀硫酸中,二者恰好完全反应,溶液变为0.25 ml·L-1的硫酸钠溶液,溶液导电能力变化不大;NaCl、NaNO3与NaOH不反应,加入NaOH固体后,离子浓度均增大1倍,溶液导电能力增强;故选B。
6.下列离子方程式正确的是( )
7.(2022·广东惠州一调)下列离子方程式书写不正确的是( )
8.(2021·江西吉安高三上学期期末)下列指定反应的离子方程式正确的是( )
10.下列离子方程式正确的是( )
11.根据有关信息,写出符合要求的离子方程式。
(1)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染。催化反硝化法中,H2能将NO还原为N2。上述反应的离子方程式为__________________________________________________________________________________________________________________________________。(2)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为__________________________________________________________________
(5)向菱镁矿(主要成分为MgCO3,含少量FeCO3)中,首先加入稀硫酸,过滤后,再加入H2O2。①MgCO3与稀硫酸反应的离子方程式为_____________________________。②加入H2O2氧化时,发生反应的化学方程式为_______________________。③硫与热的NaOH溶液反应,产物中元素的最高价态为+4价,写出该反应的离子方程式________________________________________________________。
12.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图1中的____________曲线表示(填字母)。(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图2所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将__________________________________________________。
13.下列指定反应的离子方程式正确的是( )
14.(2021·河南名校一模)对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是( )
15.按要求写出下列反应的离子方程式。
(1)(2019·全国卷Ⅰ)向MgSO4溶液中加入(NH4)2CO3溶液生成Mg(OH)2·MgCO3的离子方程式______________________________________________________;(2)(2019·全国卷Ⅱ)BaS溶液与硫酸锌溶液混合生成立德粉(ZnS·BaSO4)的离子方程式______________________________________________________;(3)(2019·全国卷Ⅲ)向MnF2溶液中加入NH4HCO3生成MnCO3的离子方程式__________________________________________________________________;(4)(2019·北京卷)Ag2SO3溶于氨水的离子方程式_______________________。
(5)(2017·全国卷Ⅰ)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
“酸浸”后,钛主要以TiOCl形式存在,写出相应反应的离子方程式__________________________________________________________________。
2023版创新设计高考化学(新教材人教版)总复习一轮课件第二章 物质的量: 这是一份2023版创新设计高考化学(新教材人教版)总复习一轮课件第二章 物质的量,文件包含2023版创新设计高考化学新教材人教版总复习一轮课件第二讲物质的量浓度pptx、2023版创新设计高考化学新教材人教版总复习一轮课件第一讲物质的量气体摩尔体积pptx、2023版创新设计高考化学新教材人教版总复习一轮课件本章易错题强化练pptx等3份课件配套教学资源,其中PPT共134页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 人教版第十一章 有机化学基础(选考): 这是一份2023版 创新设计 高考总复习 化学 人教版第十一章 有机化学基础(选考),文件包含2023版创新设计高考总复习化学人教版最新版第1讲认识有机化合物pptx、2023版创新设计高考总复习化学人教版最新版第2讲烃和卤代烃pptx、2023版创新设计高考总复习化学人教版最新版第3讲烃的含氧衍生物pptx、2023版创新设计高考总复习化学人教版最新版第4讲基本营养物质有机高分子化合物pptx、2023版创新设计高考总复习化学人教版最新版第4讲基本营养物质有机高分子化合物doc、2023版创新设计高考总复习化学人教版最新版第1讲认识有机化合物doc、2023版创新设计高考总复习化学人教版最新版第3讲烃的含氧衍生物doc、2023版创新设计高考总复习化学人教版最新版第2讲烃和卤代烃doc、2023版创新设计高考总复习化学人教版最新版本章常考必备的重要有机转化关系及反应方程式书写强化练pptx、2023版创新设计高考总复习化学人教版最新版本章常考必备的重要有机转化关系及反应方程式书写强化练doc等10份课件配套教学资源,其中PPT共252页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 人教版第八章 水溶液中的离子平衡: 这是一份2023版 创新设计 高考总复习 化学 人教版第八章 水溶液中的离子平衡,文件包含2023版创新设计高考总复习化学人教版最新版第4讲难溶电解质的溶解平衡doc、2023版创新设计高考总复习化学人教版最新版第1讲弱电解质的电离pptx、2023版创新设计高考总复习化学人教版最新版第2讲水的电离和溶液的酸碱性pptx、2023版创新设计高考总复习化学人教版最新版第3讲盐类的水解pptx、2023版创新设计高考总复习化学人教版最新版第4讲难溶电解质的溶解平衡pptx、2023版创新设计高考总复习化学人教版最新版第2讲水的电离和溶液的酸碱性doc、2023版创新设计高考总复习化学人教版最新版第1讲弱电解质的电离doc、2023版创新设计高考总复习化学人教版最新版第3讲盐类的水解doc、2023版创新设计高考总复习化学人教版最新版本章笔答题答题语言规范强化练pptx、2023版创新设计高考总复习化学人教版最新版本章笔答题答题语言规范强化练doc等10份课件配套教学资源,其中PPT共252页, 欢迎下载使用。












