

山西省绛县2023届高三(上)摸底检测化学试题(word版,含答案)
展开山西省绛县2023届高三(上)摸底检测
理科综合(化学试题)
注意事项:
1.答题前,考生务必将自己的学校、姓名、班级、准考证号填写在答题卡上相应的位置。
2.全部答案在答题卡上完成,答在本试卷上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5毫米及以上黑色笔迹签字笔写在答题卡上。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Ti-48 Zn-65
第Ⅰ卷(选择题 共42分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求.)
1. 宋应星在《天工开物》中述及铜的开采与冶炼:凡铜砂,……淘洗去土滓,然后入炉煎炼,其熏蒸旁溢者为自然铜……色似干银泥……凡铜质有数种:有与铅同体者,其煎炼炉法,傍通高低二孔,铅质先化,从上孔流出。下列有关说法正确的是
A. 淘洗去土滓属于原料的富集
B. 炼制所得自然铜为纯铜
C. 与铅分离过程是利用铅与铜的熔点不同
D. 下孔流出物可用热分解法得铜
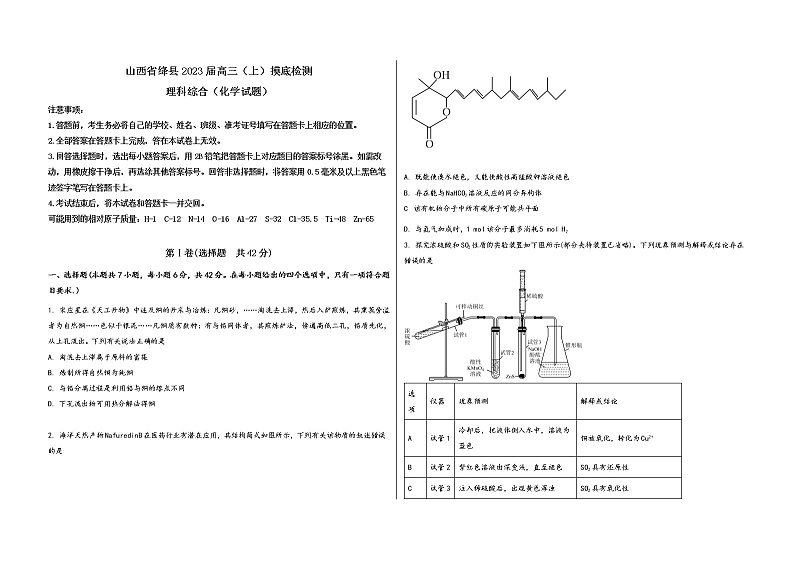
2. 海洋天然产物NafuredinB在医药行业有潜在应用,其结构简式如图所示,下列有关该物质的叙述错误的是
A. 既能使溴水褪色,又能使酸性高锰酸钾溶液褪色
B. 存在能与NaHCO3溶液反应的同分异构体
C 该有机物分子中所有碳原子可能共平面
D. 与氢气加成时,1 mol该分子最多消耗5 mol H2
3. 探究浓硫酸和SO2性质实验装置如下图所示(部分夹持装置已省略)。下列现象预测与解释或结论存在错误的是
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 冷却后,把液体倒入水中,溶液为蓝色 | 铜被氧化,转化为Cu2+ |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,出现黄色浑浊 | SO2具有氧化性 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液 |
A. A B. B
C. C D. D
4. 氨氮废水是造成河流湖泊富营养化的主要原因,处理氨氮废水(主要以和NH3·H2O的形式存在)的主要流程如图所示:
下列说法不正确的是
A. 过程I降低氮元素浓度的方法:加入NaOH溶液,调节pH为碱性,升高温度,再通入空气,赶出氨气
B. 过程II是在碱性条件下通入氧气实现:→→转化,被氧气氧微生物化为 ,总反应的离子方程式: +2O2 +H2O+2H+
C. 过程III中甲醇的作用是作还原剂,将还原为N2
D. 过程III的转化过程为→→N2,每生成1molN2转移10mol电子
5. 一种由原子序数依次增大的短周期主族元素W、X、Y、Z组成的化合物在化学和医药工业中常用作还原剂(如图所示,其中一表示化学键,可能为单键或双键),X最外层电子数为电子层数的3倍。下列叙述正确的是
A. 简单离子半径:Z>Y>X>W
B. Y与X、Y与W形成的化合物化学键类型一定相同
C. X与Z形成的化合物中各原子均满足8电子稳定结构
D. Z的最高价氧化物对应的水化物酸性强于碳酸
6. 为实现“双碳”目标,我国科学家研发了一种水系可逆Zn-CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH-,在外加电场作用下可透过相应的离子膜定向移动。当闭合K1时,Zn-CO2电池工作原理如图所示。下列说法不正确的是
A. 闭合K1时,OH-通过b膜向Zn电极方向移动
B. 闭合K1时,Zn表面的电极反应式为Zn+4OH--2e-=Zn(OH)
C. 闭合K2时,Zn电极与直流电源正极相连
D. 闭合K2时,在Pd电极上有2.24LCO2(标况下)生成,则析出Zn6.5g
7. 25℃时,用NaOH溶液分别滴定HX、CuSO4、FeSO4三种溶液,pM【p表示负对数,M表示、c(Cu2+)、c(Fe2+)等】随pH变化关系如图所示,已知Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列有关分析正确的是
A. ①代表滴定FeSO4溶液的变化关系
B. 调整溶液的pH=7,不可除去工业废水中的Cu2+
C. 滴定HX溶液至a点时,溶液中c(Na+)>c(X-)>c(OH-)>c(H+)
D. Fe(OH)2、Cu(OH)2固体均易溶解于HX溶液
第Ⅱ卷(非选择题)
二、非选择题(本题包括必考题和选考题两部分,共58分。第8题~第10题为必考题,每个试题考生都必须作答,第11题~第12题为选考题,考生根据要求作答)
(一)必考题
8. 金属钛(Ti)被誉为二十一世纪的金属,在高温下,它易与空气、氧气、氮气等反应,液体钛几乎能溶解所有的金属,与许多金属形成合金,是一种性能非常优越的金属,广泛用于军事、航天航空、医疗及石油化工等领域。工业上以钛铁矿(FeTiO3)为原料制备金属钛,同时得到副产品FeSO4·7H2O,其工艺流程如下:
回答下列问题:
(1)FeTiO3中铁元素的化合价为_______
(2)写出过程②中反应的化学方程式_______
(3)工业上在过程②中往往加入适量铁屑的目的是_______。
(4)将FeSO4·7H2O在隔绝空气条件下高温分解得Fe2O3、SO3、SO2、H2O等,则所得气体中n(SO2):n(SO3)=_______。
(5)过程④中发生反应的化学方程式为_______
(6)叙述过程⑤沉淀是否洗涤干净的方法_______
(7)科学家研究出了一种电解熔融盐制金属钛的新方法,该方法以熔融CaCl2为试剂,用石墨和合金丝串起的TiO2压片作两电极,进行电解时,TiO2压片与电源_______(“正”或“负”)极相接,阳极电极反应式为_______。
9. Co(III)盐溶液不能稳定存在,以氨为配位剂,可将Co(III)转化为稳定Co(III)配合物。实验室利用CoCl2、NH3·H2O、NH4Cl、H2O2制备三氯化六氨合钴[Co(NH3)6]Cl3,装置(夹持仪器已省略)如图所示:
实验步骤:
①将研细的6gCoCl2·6H2O晶体、4gNH4Cl固体、适量活性炭催化剂充分混合后加入c中,滴加13.5mL浓氨水使溶液颜色变为黑紫色;
②置于冰水浴中冷却至10℃以下,缓慢滴加13.5mL5%H2O2溶液并不断搅拌;
③转移至60℃热水浴中,恒温加热20min,同时缓慢搅拌;
④将反应后的混合物冷却到0℃左右,抽滤得到三氯化六氨合钴粗产品;
⑤粗产品需要经过热的盐酸溶解、趁热过滤、冷却到0℃左右并滴加浓盐酸洗涤、干燥等操作得到较纯的三氯化六氨合钴。
回答下列问题:
(1)使用仪器a代替分液漏斗滴加液体的优点是_______。
(2)步骤①中将固体药品研细,常在_______(填仪器名称)中进行。
(3)制取1mol[Co(NH3)6]Cl3,理论上需要H2O2的物质的量为_______,实际上消耗量比理论消耗量要多,其主要原因是_______。
(4)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是_______(结合必要的离子方程式说明)。
(5)沉淀滴定法测定产品中Cl-的质量分数:
i.准确称取ag步骤⑤中的产品,配制成100mL溶液,移取25mL溶液于锥形瓶中;
ii.滴加少量0.005mol·L-1的K2CrO4溶液作为指示剂,用cmol·L-1的AgNO3溶液滴定至终点;
iii.平行测定三次,消耗AgNO3溶液的体积的平均值为VmL。
已知Ag2CrO4为砖红色沉淀。
①ii中,滴定至终点的现象是_______。
②产品中C1-的质量分数是_______(列出计算式即可)。
10. 氮氧化物治理是环境学家研究的热点之一。回答下列问题:
(1)NH3还原法。
研究发现NH3还原NO的反应历程如图1。下列说法正确的是____(填标号)。
A.Fe3+能降低总反应的活化能,提高反应速率
B.总反应为6NO+4NH3=5N2+6H2O
C.该反应历程中形成了非极性键和极性键
(2)已知有关反应如下:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
③NO和CO反应的能量变化如图2所示。
2NO(g)=N2(g)+O2(g) ΔH=____kJ·mol-1。
(3)H2还原法。
已知催化剂Rh表面H2催化还原NO的反应机理如表所示,其他条件一定时,决定H2的催化还原NO反应速率的基元反应为____(填序号)。
序号 | 基元反应 | 活化能Ea/(kJ·mol-1) |
① | H2(g)+Rh(s)+Rh(s)=H(s)+H(s) | 12.6 |
② | 2NO(g)+Rh(s)=2NO(s) | 0.0 |
③ | NO(s)+Rh(s)=N(s)+O(s) | 97.5 |
④ | H(s)+O(s)=OH(s)+Rh(s) | 83.7 |
⑤ | HO(s)+H(s)=H2O(s)+Rh(s) | 33.5 |
⑥ | H2O(s)=H2O(g)+Rh(s) | 45.0 |
⑦ | N(s)+N(s)=N2(s)+Rh(s)+Rh(s) | 120.9 |
注明:N2(s)表示N2被吸附在Rh表面上。
(4)CO还原法。
一定温度下,在刚性密闭容器中充入1molNO(g)和1molCO(g)发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g)。达到平衡后,再充入amolNO(g)和amolCO(g),NO的平衡转化率____(“增大”、“减小”或“不变”,下同),气体总压强____。
(5)甲烷还原法。
一定温度下,在2.0L刚性密闭容器中充入1molCH4和2molNO2,发生反应:CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
p/(100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
达到平衡时,NO2的转化率为____。若起始时加入3molCH4和2molNO2,则在该温度下的压强平衡常数Kp=____(以分压表示的平衡常数为Kp,分压=总压×物质的量分数)kPa。
(6)电解氧化吸收法。电解0.1mol·L-1的NaCl溶液时,溶液中相关成分的质量浓度与电流强度的变化关系如图3。当电流强度为4A时,吸收NO的主要反应的离子方程式为____(NO最终转化为NO)
(二)选考题(.请考生从给出的2道题任选一题作答,并用2B铅笔在答题卡上把所选题目题号后的方框涂黑。注意所做题目的题号必修与所涂题目的题号一致,并且在解答过程中写清每问的小题号,在答题卡指定位置答题。如果多做,则每学科按所做的第一题计分。
【化学--选修3:物质结构与性质】
11. 完成下列问题。
(1)对于基态K原子,下列叙述正确的是_______(填标号)。
A.元素K的焰色反应呈紫红色,在可见光范围内辐射波长较短
B.K的核外电子排布式为[Ar]4s1
C.K和Cr位于同一周期,且价电子构型相同,第一电离能I1(K)>I1(Cr)
(2)g-C3N4是一种近似石墨烯的平面维片层结构,其中一种基本结构单元无限延伸形成网状结构如下图所示:
g-C3N4中N原子的杂化类型_______,片层之间通过_______(填作用力类型)结合,g-C3N4在光激发下能传递电子的原因是_______。
(3)NaCl的熔点为801℃,KCl的熔点为770℃,请分析原因_______。
(4)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引力或排斥力。设氯化钠晶胞参数为apm,钠离子和氯离子的半径分别为rNapm和rClpm,以钠离子为中心,距离最近的一层为第一层。
则第二层离子有_______个,与中心离子的距离为_______pm,它们是_______离子(填“钠”或“氯”),晶胞中的离子空间占有率为_______(列出计算表达式)。
【化学--选修5:有机化学基础】
12. 有机合成中成环及环的元素增减是合成路线设计的关键问题之一,由 合成 路线如下:
已知:①
②
回答下列问题:
(1)A的分子式为_______;B中所含官能团名称为_______。
(2)C的结构简式为_______;E→F反应类型是_______。
(3)写出D→E的化学方程式_______。
(4)E的芳香族化合物的同分异构体中,核磁共振氢谱有四组峰且峰面积之比为9∶6∶2∶1的所有同分异构体的结构简式为_______。
(5)以 为原料合成 ,其合成路线为_______。
参考答案
一.选择题
1. A 2. C 3. D 4. B 5. D 6. C 7. C
二. 非选择题
8. (1)+2
(2)FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
(3)防止Fe2+被氧化
(4)1:1 (5)TiO2+ 2Cl2+2C TiCl4+2CO
(6)取适量最后一次水洗液于试管中,滴加硝酸酸化的硝酸银溶液,若不出现浑浊,则氯离子已洗涤干净
(7)①. 负 ②. 2Cl--2e-=Cl2↑
9. (1)平衡压强,便于液体顺利滴下
(2)研钵 (3) ①. 0.5mol ②. 由于受热时H2O2分解导致H2O2有损失
(4)加入NH4Cl会使溶液中的浓度增大,抑制了NH3·H2O的电离(),使溶液中OH-浓度降低,避免生成Co(OH)2沉淀
(5) ①. 当滴入最后一滴AgNO3溶液时,溶液中出现砖红色沉淀,且半分钟内不消失 ②.
10. (1)AC
(2)-180.5
(3)⑦
(4)①. 增大 ②. 增大
(5) ①. 75% ②. 3240
(6)2NO+3ClO-+2OH-=2NO+3Cl-+H2O
11. (1)AB
(2)①. sp2杂化 ②. 范德华力 ③. 片层内形成了离域π键
(3)同为离子晶体,钠离子的半径小于钾离子的半径,NaCl晶格能大于KCl,所以NaCl的熔点高
(4)①. 12 ②. a ③. 钠 ④.
12. (1) ①. C12H20O3 ②. 羰基、酯基
(2)①. ②. 加聚反应
(3)+H2O
(4)、
(5)
山西省新绛县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份山西省新绛县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65,3mlNaOH, 常温下,向1L0等内容,欢迎下载使用。
山西省隰县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份山西省隰县2023届高三(上)摸底检测化学试题(word版,含答案),共7页。试卷主要包含了5 Ti-48 Zn-65, 苯硫酚是一种局部麻醉剂等内容,欢迎下载使用。
山西省盂县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份山西省盂县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65, 实验测得0,62,10ml/L等内容,欢迎下载使用。












