





2020-2021学年第2节 原子结构与元素周期表图文ppt课件
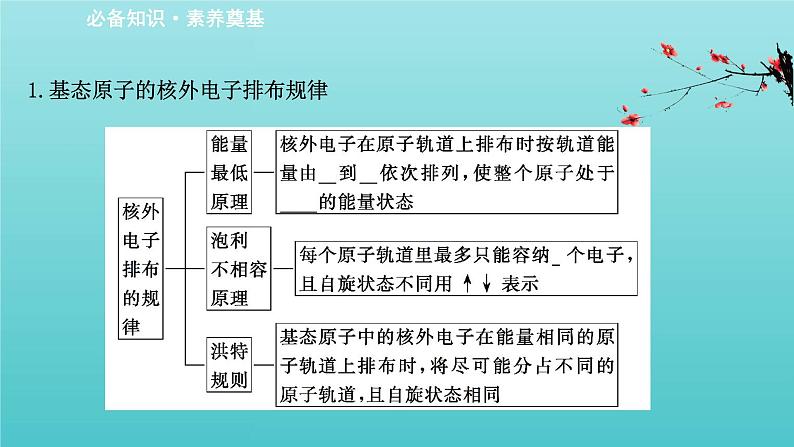
展开1.基态原子的核外电子排布规律
【微思考】根据基态原子核外电子排布原则思考:(1)为什么每个电子层最多容纳2n2个电子?提示:各电子层上的能级数目=电子层序数n,根据泡利不相容原理,每个原子轨道最多只能容纳2个电子,所以每个电子层最多容纳2n2个电子。(2)为什么原子核外最外层的电子不超过8个?次外层不超过18个电子?提示:由于E(nd)>E[(n+1)s],当ns和np轨道电子排满时,多余的电子不是填入nd轨道,而是首先填入(n+1)s轨道,因此最外层电子数不可能超过2+6=8。同理次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。
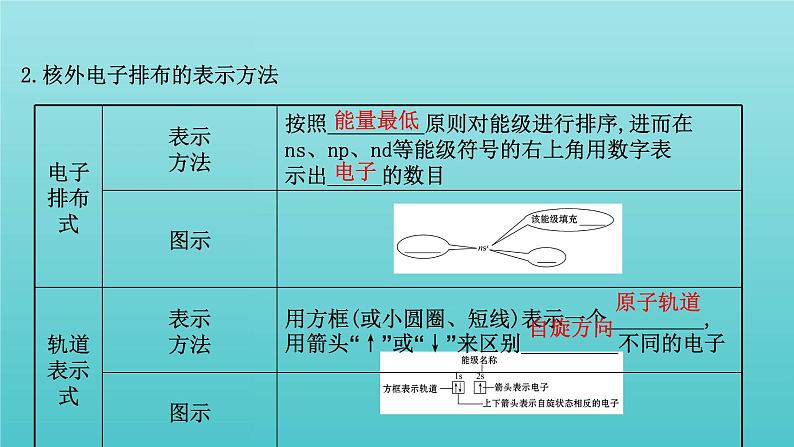
2.核外电子排布的表示方法
【巧判断】(1)电子进入原子轨道的顺序和电子排布式的书写顺序一致。( )提示:×。电子按能量由低到高顺序在原子轨道上排布,但书写电子排布式或轨道表示式时,应按电子层数由小到大的顺序书写。(2)碳原子的轨道表示式为 。( )提示:×。2p轨道上应该有一个空的原子轨道。
【情境·思考】喜爱漫威的同学都熟悉钢铁侠,钢铁侠在《复仇者联盟4》中拯救了世界,电影里早期的盔甲材料用的是军用卫星的金钛合金,而不是一般的钛合金。相较于普通钢材在高空容易结冰的缺点,金钛合金在低温下完全不惧怕结冰的问题。
铠甲中的合金的成分之一钛元素被称为“二十一世纪的金属”22Ti原子的核外电子排布式和轨道表示式分别如何表示?提示:核外电子排布式为1s22s22p63s23p63d24s2,轨道表示式为 。
3.19号~36号元素基态原子的核外电子排布(1)构造原理基态原子核外电子在原子轨道上的排列顺序
(2)洪特规则的特例能量相同的原子轨道在全充满(如d10)、半充满(如d5)和全空状态(如d0)状态时,体系能量较低。
【做一做】下列原子或离子的电子排布的表示方法中,正确的是____________,违反了能量最低原理的是____________,违反洪特规则的是____________,违反泡利不相容原理的是____________,违反洪特规则特例的是____________(填序号)。 ①Ca2+:1s22s22p63s23p6②F-:1s22s23p6③P:
④Cr:1s22s22p63s23p63d44s2⑤Fe:1s22s22p63s23p63d64s2⑥Mg2+:1s22s22p6⑦C: ⑧O原子:
提示:根据核外电子排布规律②中错误在于电子排完2s轨道后应排2p轨道而不是3p轨道,正确的应为1s22s22p6;③中没有遵循洪特规则——电子在能量相同的轨道上排布时,应尽可能分占不同的轨道并且自旋状态相同,最外层电子排布应为 ;④中忽略了能量相同的原子轨道在半充满状态时,体系的能量较低,原子较稳定,正确的应为1s22s22p63s23p63d54s1,违反了洪特规则的特例。⑤和⑥正确,⑦违反洪特规则,正确的应为 。⑧的轨道表示式为 违反了泡利不相容原理。
故核外电子排布表示正确的是①⑤⑥;违反能量最低原理的是②;违反洪特规则的是③⑦;违反泡利不相容原理的是⑧;违反洪特规则特例的是④。
知识点一 核外电子的排布规律【重点释疑】1.能量最低原则(1)基态原子核外电子在原子轨道上的排布顺序。
(2)排列规律:三层以上的电子层中出现能级交错现象,对核外电子排布的影响很大。①能量顺序按照1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s……,即按照ns (n-2)f (n-1)d np顺序排列。②能量高低:1s<2s<3s,2p<3p<4p,ns
3.洪特规则的特例当同一能级上的电子排布为全充满(如p6、d10、f14)、半充满(如p3、d5、f7)和全空状态(如p0、d0、f0)时,具有较低的能量和较大的稳定性,这称为洪特规则的特例。例如,铬(24Cr)的价电子排布式是3d54s1(3d、4s能级均为半充满)而不是3d44s2,铜(29Cu)的价电子排布式是3d104s1(3d全充满、4s半充满)而不是3d94s2等。
【易错提醒】核外电子排布原则应用的易错误区(1)应用时不能顾此失彼:核外电子在原子轨道上排布要遵循三个原则,即能量最低原则、泡利不相容原理和洪特规则。这三个原则并不是孤立的,而是相互联系、相互制约的,也就是说核外电子在原子轨道上排布要同时遵循这三个原则。其中能量最低原则可叙述为,在不违反泡利不相容原理的前提下,核外电子在各个原子轨道上的排布方式应使整个原子体系的能量最低。 (2)能级交错现象:核外电子的能量并不是完全按电子层序数的增加而升高的,不同电子层的能级之间的能量高低有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
【思考·讨论】(1)电子层数n值越大,原子轨道的能量越高吗?提示:n为1、2时,n值越大,原子轨道的能量越高,但是从第3层开始出现能级交错现象,比如E(3d)>E(4s)。(2)为什么三价铁离子的稳定性大于二价铁离子?提示:铁原子的电子排布式为1s22s22p63s23p63d64s2, 当失去4s轨道上的两个电子时变成二价铁离子,电子排布式为1s22s22p63s23p63d6,而如果形成三价铁离子时电子排布式为1s22s22p63s23p63d5,此时3d轨道处于半满状态,较为稳定。
【案例示范】【典例】(双选)(2020·菏泽高二检测)核外电子的排布遵循一定的规律,这些规律相辅相成,下列关于核外电子的排布规律说法错误的是( )A.同一原子,ns电子的能量不一定低于(n+1)p电子的能量B.6C的电子排布式1s22s22 违反了洪特规则C.24Cr的电子排布式1s22s22p63s23p63d54s1违反了能量最低原理D.22Ti的电子排布式1s22s22p63s23p10违反了泡利不相容原理
【解题指南】解答本题注意以下两点:(1)核外电子排布遵循能量最低原理、泡利不相容原理、洪特规则。(2)核外电子排布要注意洪特规则的特例。【解析】选A、C。同一原子,ns电子的能量一定低于(n+1)p电子的能量,A错误;对于6C原子来说,2p能级有3个能量相同的原子轨道,2p能级上的两个电子应以自旋状态相同的方式排布在两个不同的2p轨道上才符合洪特规则,B正确;根据构造原理可知E(4s)
【易错提醒】核外电子排布规律的注意事项原子的核外电子排布遵循构造原理能使整个原子的能量处于最低状态,构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。但需注意洪特规则特例。
【迁移·应用】1.(2020·日照高二检测)各电子层排布电子的总数要遵循以下规律:①每层最多容纳2n2个电子;②原子最外层电子数≤8;③原子次外层电子数≤18。决定这3条规律的电子排布规则是( )A.能量最低原理B.泡利不相容原理C.洪特规则D.能量最低原理和泡利不相容原理
【解析】选D。基态原子的电子排布遵循能量最低原理、泡利不相容原理和洪特规则,而洪特规则是讲电子优先单独占据一个轨道,而且自旋状态相同的,故不符合题意,由此可知本题选择D项。
2.若将P原子的电子排布式写成1s22s22p63s23 3 ,它违背了( )A.能量守恒原理 B.泡利不相容原理C.能量最低原理D.洪特规则【解析】选D。对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并自旋方向相同。若将P原子的电子排布式写成1s22s22p63s23 3 ,它违背了洪特规则。
3.(双选)(2020·菏泽高二检测)核外电子排布规律揭示的电子排布能级顺序,实质是各能级能量高低。若以E表示某能级的能量,以下各式中正确的是( )A.E(5s)>E(4f)>E(4s)>E(3d)B.E(3d)>E(4s)>E(3p)>E(3s)C.E(4s)>E(4p)>E(4d)>E(4f)D.E(4f)>E(5s)>E(3d)>E(4s)【解析】选B、D。A、D项,应为E(4f)>E(5s)>E(3d)>E(4s),A错误,D正确;C项应为E(4s)
2.某元素的原子序数为33,则该元素的基态原子中能量最高的电子应排布在( )A.3s能级 B.4p能级C.4s能级 D.3p能级【解析】选B。原子序数为33的元素是As,其核外电子排布式1s22s22p63s23p63d104s24p3。
【素养提升】特斯拉是美国电动汽车制造商,2019年1月7日,上海最大的外资制造业项目——特斯拉超级工厂正式开工建设。特斯拉使用宁德时代生产的磷酸铁锂电池。(1)若将铁元素原子的电子排布式表示为1s22s22p63s23p63d8,不符合核外电子排布的哪个原则?提示:不符合能量最低原理,由于3d大于4s所以应该先排4s再排3d轨道,因此电子排布式应该为1s22s22p63s23p63d64s2。(2)若锂原子的核外电子排布表示为 违背了哪一个原则?提示:违背了泡利不相容原理,s轨道上的两个电子的自旋方向应该相反。
知识点二 核外电子排布的表示方法【重点释疑】核外电子排布的表示方法比较
【误区警示】书写轨道表示式时的“五”注意(1)一个方框表示一个原子轨道,一个箭头表示一个电子。(2)不同能级中的 要相互分开,同一能级中的 要相互连接。(3)整个轨道表示式中各能级的排列顺序要与相应的电子排布式一致。(4)当 中有2个电子时,它们的自旋状态必须相反。(5)基态原子的电子排布遵循能量最低原理、泡利不相容原理和洪特规则。
【思考·讨论】(1)电子排布式和轨道表示式哪一个能更加具体反映电子在核外运动状态?提示:电子排布式能够表示出每一个能级上的电子排布情况,轨道表示式除了能够表示出在每一个能级上电子的排布情况外,还能表示出电子在该能级的原子轨道上的排布情况,因此比电子排布式更加具体形象。(2)如何书写铁元素的电子排布式?提示:复杂原子的电子排布式的书写。先按能量最低原理从低到高排列,然后将同一层的电子移到一起。先按能量从低到高排列为1s22s22p63s23p64s23d6,然后将同一层的排列在一起,即该原子的电子排布式为1s22s22p63s23p63d64s2。
【案例示范】【典例】(2020·海口高二检测)A、B、C、D、E代表前四周期的五种元素,原子序数依次增大。请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其轨道表示式为__。 (2)B元素的负一价离子的电子层结构与氩相同,B的离子的结构示意图为___。 (3)C元素的正三价离子的3d能级为半充满,C的元素符号为________,其基态原子的电子排布式为____________。
(4)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,D的元素符号为________。其基态原子的电子排布式为________________。 (5)E元素基态原子中没有未成对电子,E的电子排布式是_________________。
【解题指南】解答本题时应该先根据元素原子的结构特点推测元素,然后再根据核外电子排布的原则表示出核外电子的排布式。
【解析】(1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素为氮元素,其轨道表示式为 。(2)因为B-的电子层结构与氩相同,即核外电子数相同,所以B元素的质子数为18-1=17,则B-为Cl-,其结构示意图为 。
(3)C元素的正三价离子的3d能级为半充满,C的元素符号为Fe,其基态原子的电子排布式:1s22s22p63s23p63d64s2。(4)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则D为Cu,其基态原子电子排布式为1s22s22p63s23p63d104s1。(5)E元素基态原子中没有未成对电子,且E的原子序数在五种元素中最大,因此E元素为30号元素Zn或36号元素Kr,其电子排布式为1s22s22p63s23p63d104s2或1s22s22p63s23p63d104s24p6。
答案:(1) (2) (3)Fe 1s22s22p63s23p63d64s2(4)Cu 1s22s22p63s23p63d104s1(5)1s22s22p63s23p63d104s2或1s22s22p63s23p63d104s24p6
【规律方法】离子的电子排布式的书写流程离子的电子排布式在书写时应以原子的电子排布式为基础,首先根据构造原理,写出相应原子的电子排布式,再根据原子得失电子的情况作出相应的调整,写出相应的离子的电子排布式。比如,钠原子的电子排布式为1s22s22p63s1当它失去一个电子时就变成钠离子其电子排布式就变为1s22s22p6。
【迁移·应用】1.(2020·天津高二检测)下列有关核外电子排布的式子不正确的是 ( )A.24Cr的电子排布式:1s22s22p63s23p63d54s1B.K的最外层电子排布式:4s1C.N原子的轨道表示式为 D.S原子的轨道表示式为
2.下列原子中未成对电子数最多的是( )A.C B.O C.N D.Cl【解析】选C。A项,C的核外电子排布式为1s22s22p2,p能级有3个原子轨道,因此未成对电子数为2;B项,O的核外电子排布式为1s22s22p4,p能级有3个原子轨道,因此未成对电子数为2;C项,N的核外电子排布式为1s22s22p3,p能级有3个原子轨道,因此未成对电子数为3;D项,Cl的核外电子排布式为1s22s22p63s23p5,p能级有3个原子轨道,因此未成对电子数为1。
3.下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
(1)写出下列元素基态原子的核外电子排布式:Sc__________________________________。 Ti__________________________________。 V___________________________________。 Mn__________________________________。 (2)已知基态铬原子的电子排布式是1s22s22p63s23p63d54s1,并不符合构造原理,为什么核外电子这样排布呢? ________________________。 (3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是____________;出现这一现象的原因是________________________。
【解析】(1)根据原子序数和构造原理可以写出4种元素原子的核外电子排布式。(2)由洪特规则,可知等价轨道全充满、半充满或全空的状态一般比较稳定。(3)由化合价数值与对应的核外电子排布式,可以得出最高正化合价数值等于各元素基态原子的最外电子层s电子和次外电子层d电子数目之和;并且d电子也参与了化学反应。答案:(1)1s22s22p63s23p63d14s21s22s22p63s23p63d24s2 1s22s22p63s23p63d34s2 1s22s22p63s23p63d54s2(2)由洪特规则,可知能量相同的轨道半充满状态一般比较稳定(3)五种元素的最高正化合价数值等于各元素基态原子的最外电子层s电子和次外电子层d电子数目之和 d电子也参与了化学反应
【补偿训练】以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )A. B. C.1s2 D. 【解析】选D。A项只能表示最外层电子数;B项只表示核外的电子分层排布情况;C项具体到各能级的电子数;而D项包含了电子层数、能级数以及轨道内电子的自旋方向,故该项正确。
【素养提升】(2020·菏泽高二检测)砷是33号元素,其单质具有灰、黄、黑色三种同素异形体,其中灰砷具有金属性,质脆而硬。砷在常温下缓慢氧化,加热则迅速氧化生成三氧化二砷。三氧化二砷又名亚砷酐,俗称砒霜、白砒、砒石、信石,为白色粉末,微溶于水,易升华。(1)该元素原子质子数和电子数有怎么样的关系?(2)该元素原子核外的电子层数、能级数和原子轨道数目分别是多少?(3)该元素的核外电子排布式及最外层电子排布式和最外层电子的轨道表示式分别如何表示?
提示:(1)根据元素原子的核外电子数=质子数=原子序数,可得出其质子数和核外电子数均为33。(2)先利用能级顺序和排布原则排出其电子排布式:1s22s22p63s23p63d104s24p3,得出该元素原子核外有4个电子层,8个能级,共1+1+3+1+3+5+1+3=18个原子轨道(s:1个轨道;p:3个轨道;d:5个轨道)。(3)核外电子排布式为1s22s22p63s23p63d104s24p3,最外层电子排布式为4s24p3,最外层电子轨道表示式为 。
1.(教材习题改编)原子序数为24的基态铬原子的电子排布式为1s22s22p63s23p63d54s1而不是1s22s22p63s23p63d44s2的原因是( )A.能量最低原理 B.泡利不相容原理C.洪特规则 D.洪特规则的特例【解析】选D。根据洪特规则的特例,1s22s22p63s23p63d54s1。
【补偿训练】在2p能级上最多只能排布6个电子,其依据的规律是( )A.能量最低原理B.泡利不相容原理C.洪特规则D.能量最低原理和泡利不相容原理【解析】选B。A中能量最低原理主要是电子排布先后顺序,洪特规则指的是相同能级电子尽量占据不同轨道,只有B选项泡利不相容原理说明一个轨道上最多容纳2个电子且自旋方向相反,2p能级共有3个轨道,最多容纳6个电子。
2.(2020·淄博高二检测)基态碳原子的最外电子层的各能级中,电子排布的方式正确的是( )A. B. C. D. 【解析】选C。A项中,E2s
4.(双选)下列元素中,基态原子的最外层电子排布式不正确的是( )A.As 4s24p3 B.Cr 3d44s2C.Ar 3s23p6 D.Cu 3d94s2【解析】选B、D。能量相同的原子轨道在全充满(p6和d10)、半充满(p3和d5)和全空(p0和d0)状态时,体系能量较低,原子较稳定。故B项中Cr原子的最外层电子排布式应为3d54s1;D项应为3d104s1。
5.(2020·潍坊高二检测)某元素基态原子3d轨道上有5个电子,则该原子最外层电子的排布可能是( )A.4s1 B.4s24p1 C.4s24p3 D.3s23p63d5【解析】选A。3d轨道上有5个电子,属于半充满稳定状态,又根据构造原理可知电子先填充4s轨道再填充3d轨道,待3d轨道填满后再填充4p轨道,故题给原子的价层电子排布为3d54s1或3d54s2,最外层电子排布为4s1或4s2,故A正确。
6.(新思维·新考向)雄黄与雌黄是共生矿物,有“矿物鸳鸯”的说法 。化学式为As2S2、As2S3。我国古代有端午节饮雄黄酒的习俗,雌黄不仅仅是作为药物的存在,更有一个意想不到的特异功能——修改错字。在中国古代,雌黄经常用来修改错字。因此,在汉语环境中,雌黄有篡改文章的意思,并且有着“胡说八道”的引申义,如成语“信口雌黄”。结合核外电子排布规律完成表格,结合S的主要化合价,并根据最外层电子的电子排布式预测As元素的主要化合价。
As的最高正价为________,最低负价为 ________。 【解析】根据核外电子排布的规律可以得到,两种元素的核外电子排布式分别为1s22s22p63s23p4和1s22s22p63s23p63d104s24p3。由于As元素的最外层有5个电子,其最高正价为+5价,最低负价为-3价。
化学第2节 原子结构与元素周期表教课课件ppt: 这是一份化学第2节 原子结构与元素周期表教课课件ppt,共14页。
鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教学课件ppt: 这是一份鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教学课件ppt,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表图文课件ppt: 这是一份鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表图文课件ppt,共47页。PPT课件主要包含了内容索引,知识铺垫,自主梳理,能量最低状态,自我检测,问题探究,归纳拓展,应用体验,答案D,答案A等内容,欢迎下载使用。













