
高中鲁科版 (2019)微项目 甲醛的危害与去除——利用电负性分析与预测物质性质课后练习题
展开分子的空间结构的判断
1.(2020·厦门高二检测)合成某种滴眼液的原料为4-二甲氨基吡啶。下列叙述错误的是 ( )
A.该分子中C原子的杂化类型有sp2、sp3
B.该分子中N原子的杂化类型有sp2、sp3
C.1 mol该分子所含的σ键为15 NA
D.该分子中含有大π键
【解析】选C。由结构简式得出,甲基(—CH3)上的碳为sp3杂化,双键C原子的杂化为sp2杂化,该分子中C原子的杂化类型有sp2、sp3,故A正确;单键N原子杂化为sp3杂化,双键N原子杂化类型为sp2杂化,该分子中N原子的杂化类型有sp2、sp3,故B正确;1个分子中有3+3+3+6+4=19个σ键,1 mol该分子所含的σ键为19NA,故C错误;该分子中有6个原子各提供1个电子构成大π键,故D正确。
2.二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟利昂”产品,用作空调、冰箱和冷冻库等中的致冷剂。下列关于二氟甲烷的说法正确的是 ( )
A.二氟甲烷是正四面体结构
B.二氟甲烷中两个氢原子性质相同
C.二氟甲烷溶于水得F-
D.二氟甲烷极易与O3反应
【解析】选B。甲烷是正四面体结构,当甲烷分子上的2个氢原子被氟原子取代后,原子之间的相互影响,键长、键角都发生了变化,不是正四面体结构,故A错误;二氟甲烷分子中2个氢原子是等效的,故B正确;二氟甲烷是分子晶体,是非电解质,难溶于水,不电离,故C错误;二氟甲烷属于卤代烃,与O3不反应,不能燃烧,也不支持燃烧,故D错误。
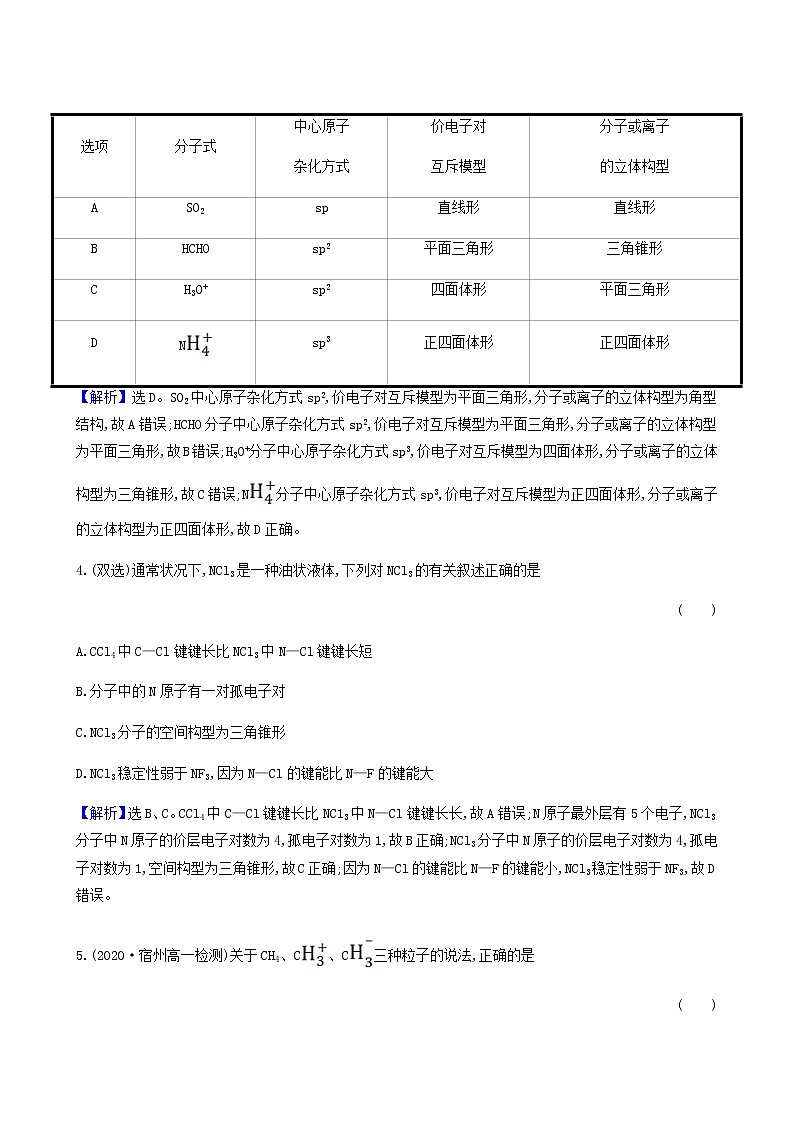
3.(2020·郑州高二检测)根据杂化轨道理论和价电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子 杂化方式 | 价电子对 互斥模型 | 分子或离子 的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | HCHO | sp2 | 平面三角形 | 三角锥形 |
C | H3O+ | sp2 | 四面体形 | 平面三角形 |
D | N | sp3 | 正四面体形 | 正四面体形 |
【解析】选D。SO2中心原子杂化方式sp2,价电子对互斥模型为平面三角形,分子或离子的立体构型为角型结构,故A错误;HCHO分子中心原子杂化方式sp2,价电子对互斥模型为平面三角形,分子或离子的立体构型为平面三角形,故B错误;H3O+分子中心原子杂化方式sp3,价电子对互斥模型为四面体形,分子或离子的立体构型为三角锥形,故C错误;N分子中心原子杂化方式sp3,价电子对互斥模型为正四面体形,分子或离子的立体构型为正四面体形,故D正确。
4.(双选)通常状况下,NCl3是一种油状液体,下列对NCl3的有关叙述正确的是
( )
A.CCl4中C—Cl键键长比NCl3中N—Cl键键长短
B.分子中的N原子有一对孤电子对
C.NCl3分子的空间构型为三角锥形
D.NCl3稳定性弱于NF3,因为N—Cl的键能比N—F的键能大
【解析】选B、C。CCl4中C—Cl键键长比NC13中N—Cl键键长长,故A错误;N原子最外层有5个电子,NCl3分子中N原子的价层电子对数为4,孤电子对数为1,故B正确;NCl3分子中N原子的价层电子对数为4,孤电子对数为1,空间构型为三角锥形,故C正确;因为N—Cl的键能比N—F的键能小,NCl3稳定性弱于NF3,故D错误。
5.(2020·宿州高一检测)关于CH4、C、C三种粒子的说法,正确的是
( )
A.C原子的杂化类型都相同
B.C是三角锥形
C.C与BCl3构型相同
D.CH4与N互为等电子体
【解析】选D。甲烷中的C原子价电子对个数=4+(4-4×1)/2=4,所以其中心碳原子采用sp3杂化,碳正离子中的C原子价电子对个数=3+(4-1-3×1)/2=3,所以其中心碳原子采用sp2杂化,碳负离子中的C原子价电子对个数=3+(4+1-3×1)/2=4,所以其中心碳原子采用sp3杂化,三种微粒中碳原子的杂化方式不同,A错误;碳正离子其中心碳原子采用sp2杂化,不含孤电子对,空间构型为平面三角形结构,B错误;碳负离子其中心碳原子采用sp3杂化,含有一对孤电子对为三角锥形,BCl3中B原子价电子对个数=3+(3-3×1)/2=3,不含孤电子对,空间构型为平面三角形结构,C错误;原子数和价电子数分别都相等的互为等电子体,则CH4与N互为等电子体,D正确。
6.如图是O3分子的空间结构示意图。请回答:
(1) O3分子中非极性共价键是________键,特殊的化学键是________键。
(2)臭氧与氧气的关系是______________________-_。
(3)下列物质的分子与O3分子的结构最相似的是________。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)分子中某一原子有一对没有跟其他原子共用的电子对叫孤电子对。那么,O3分子中有________对孤电子对。
(5)指出下列原子的杂化轨道类型及分子的空间构型。
①SiF4中的Si________杂化,空间构型____________;
②N中的N____________杂化,空间构型____________。
【解析】 (1) 根据图示O3分子中非极性共价键是σ键,特殊的化学键是π键;
(2)臭氧与氧气都是氧元素的单质,互为同素异形体;
(3)根据O3分子的结构,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子呈角形。A.H2O中含有2对σ键,2对孤电子对,O原子sp3杂化,空间结构为角形,故A错误;B.CO2为含有4个σ键,没有孤电子对,为sp杂化,空间结构为直线形,故B错误;C.SO2 中S原子sp2杂化,S原子和两侧的氧原子除以σ键结合以外,还形成一个三中心四电子的大π键,分子呈“角”形结构,其成键方式与O3类似,故C正确;D.BeCl2含有2个σ键,没有孤电子对,为sp杂化,空间结构为直线形;
(4)每个O原子最外层有6个电子,由臭氧的结构图可知中心O原子有4个电子成键,则还有1对孤电子对,两端的O原子各有2个电子成键,则两端的O原子各含有2对孤电子对,所以臭氧分子中总共5对孤电子对;
(5)①SiF4分子中Si原子和F原子形成四个σ键,其价层电子对个数是4,所以Si原子杂化类型是sp3,空间构型为正四面体,②N中N原子价层电子对个数=2+×(5+1-2×2)=3,且含有一个孤电子对,其空间构型为角形,N原子杂化方式为sp2。
答案:(1)σ π (2)同素异形体 (3)C (4)5
(5)①sp3 正四面体 ②sp2 角形
【补偿训练】
(2020·南京高二检测)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_____________________________。
(2)根据等电子原理,写出CO分子的结构式_________________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_________________________;
甲醛分子中碳原子轨道的杂化类型为_________________________。
②甲醛分子的空间构型是______________;1 mol甲醛分子中σ键的数目为______________。
【解析】(1)基态Zn原子的核外电子排布式为
[Ar]3d104s2。
(2)根据等电子原理,与CO分子等电子的分子可以是N2,CO的结构式与N2相似,为C≡O。
(3)①甲醇的沸点比甲醛的高,其主要原因是甲醇分子之间存在氢键;甲醛分子中碳原子价电子对是3,其轨道的杂化类型为sp2。
②甲醛分子的空间构型是平面三角形;1 mol甲醛分子中σ键的数目为3NA。
答案: (1)[Ar]3d104s2 (2)C≡O (3)①甲醇分子间含有氢键 sp2 ②平面三角形 3NA
高中化学鲁科版 (2019)选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质当堂检测题: 这是一份高中化学鲁科版 (2019)选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质当堂检测题,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
化学选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用练习题: 这是一份化学选择性必修2微项目 青蒿素分子的结构测定——晶体在分子结构测定中的应用练习题,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
化学选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质同步练习题: 这是一份化学选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质同步练习题,共15页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。













