


高中化学人教版 (2019)选择性必修2第一节 共价键教学ppt课件
展开分子或晶体中相邻原子之间强烈的相互作用。
(这里的原子是指广义原子,包括原子和离子)
(以共价键形成的分子为共价分子)
按照共用电子对是否偏移
如何用原子轨道的概念来进一步理解共价键的形成?
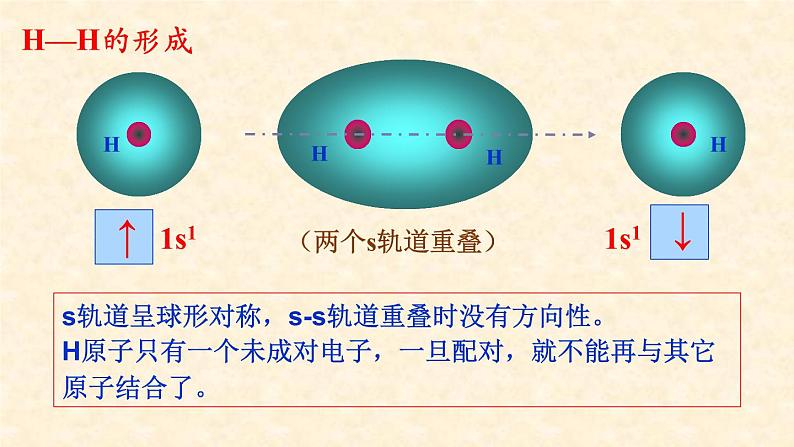
用原子轨道描述氢原子形成氢分子的过程
s轨道呈球形对称,s-s轨道重叠时没有方向性。H原子只有一个未成对电子,一旦配对,就不能再与其它原子结合了。
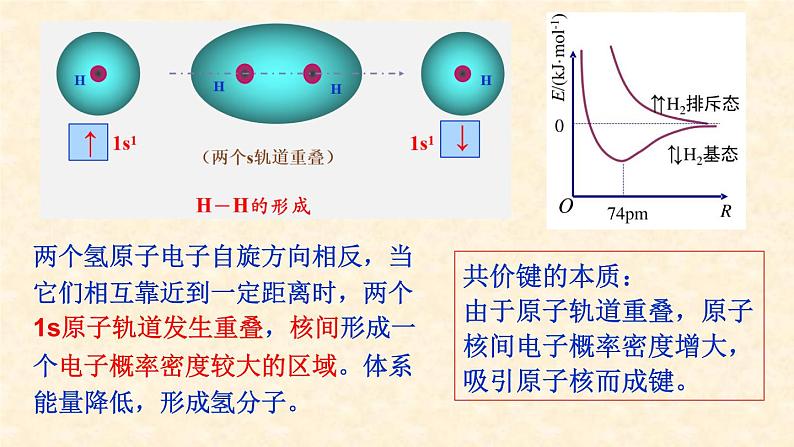
两个氢原子电子自旋方向相反,当它们相互靠近到一定距离时,两个1s原子轨道发生重叠,核间形成一个电子概率密度较大的区域。体系能量降低,形成氢分子。
共价键的本质:由于原子轨道重叠,原子核间电子概率密度增大,吸引原子核而成键。
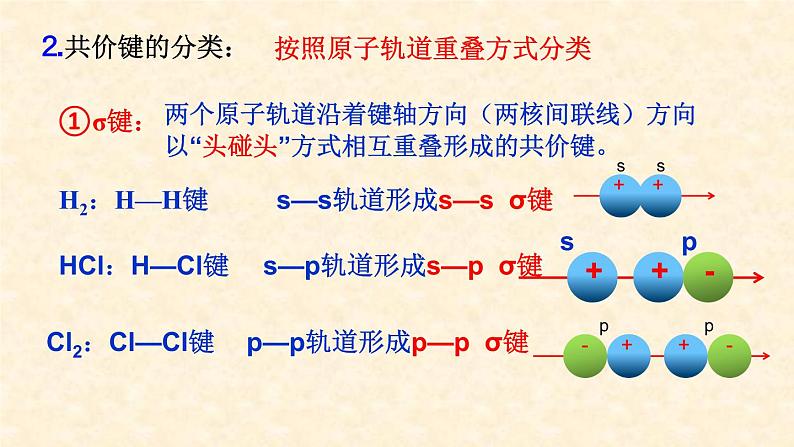
两个原子轨道沿着键轴方向(两核间联线)方向以“头碰头”方式相互重叠形成的共价键。
s—p轨道形成s—p σ键
p—p轨道形成p—p σ键
按照原子轨道重叠方式分类
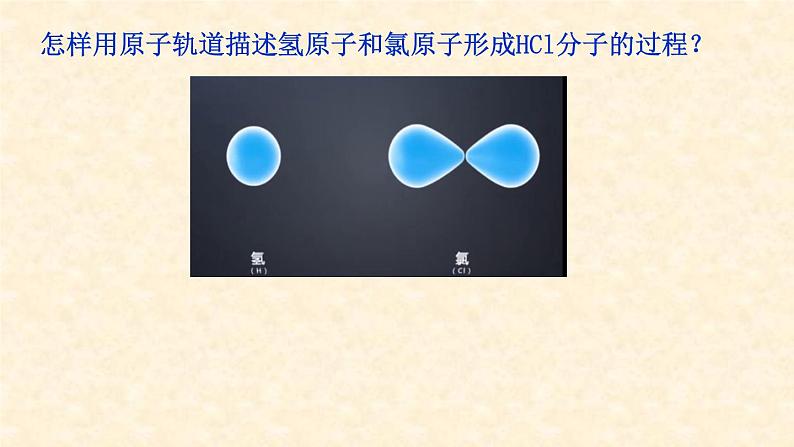
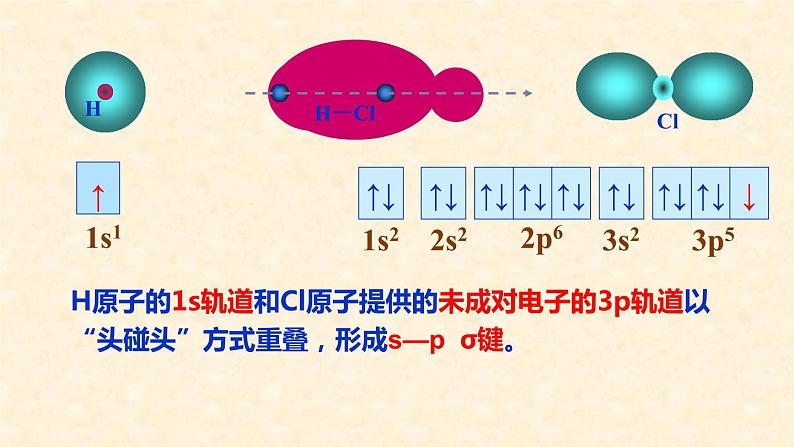
怎样用原子轨道描述氢原子和氯原子形成HCl分子的过程?
H原子的1s轨道和Cl原子提供的未成对电子的3p轨道以“头碰头”方式重叠,形成s—p σ键。
s轨道呈球形对称,p轨道呈哑铃形,只有当沿着键轴方向以“头碰头”方式重叠,才能实现原子轨道最大重叠。
H原子和Cl原子都只有一个未成对电子,一旦配对,就不能再与其它原子结合了。
两个3p轨道沿着键轴方向以“头碰头”方式重叠,形成p—p σ键
用原子轨道描述2个氯原子形成Cl2分子的过程。
1.轨道的重叠部分沿键轴呈圆柱形对称分布(轴对称)。
因此,通过σ键连接的原子绕键轴旋转而不会破坏化学键。
2.“头碰头”重叠符合原子轨道最大重叠原理:轨道重叠越多,两核间电子云密度越大,共价键越牢固,键能越大。
3.共价单键都是σ键。
两个原子轨道垂直于两核间联线方向以“肩并肩”方式相互重叠形成的共价键。
如p-p π键的形成的过程:
1.轨道重叠部分垂直于键轴呈镜面对称。
通过π键连接的原子不能绕键轴旋转,否则会导致π键的破坏。
2.“肩并肩”重叠:轨道重叠程度小于σ键,π键没有σ键稳定,比较容易断裂而发生化学反应。
除s轨道外,p,d,f轨道在空间都有一定的伸展方向,在形成共价键时,只有沿着一定方向才符合最大重叠原理。
一般,一个原子的未成对电子与其他原子中自旋方向相反的未成对电子配对成键后,就不能再与其它原子的未成对电子配对。也即,一个原子有几个未成对电子,就能形成几个共价键。这就是共价键的饱和性。
N2中氮氮三键形成过程
用电子式表示N2的形成过程:
在形成N2分子过程中,若2个N原子沿x方向接近时,px与px轨道以头碰头方式重叠形成σ键,那么py与py , pz与pz就只能以肩并肩方式重叠形成两个相互垂直的π键。
单键都是σ键,双键含一个σ键和一个π键,三键含一个σ键和二个π键
【练习】1.判断下列说法的正误,正确的画“√”,错误的画“×”。(1)所有共价键都有饱和性( )(2)N2分子中σ键与π键的个数比是2∶1( )(3)CO2分子中有一个σ键和一个π键( )(4)一般来说,σ键比π键强度大,更稳定( )(5)形成Cl2分子时,p轨道的重叠方式可以为 ( )(6)σ键和π键都只存在于共价化合物中( )
(1)1 ml HCHO含σ键的数目为 (NA为阿伏加德罗常数)。 (2)CS2分子中的共价键的类型有 。
(3)Ni(CO)4是正四面体化合物,1 ml Ni(CO)4中含有 ml σ键。 (4)石墨烯是由单层碳原子构成的平面结构新型材料,下图中1号C与相邻C形成σ键的个数为 。
3.下图表示氢原子的电子云重叠示意图。以下各种说法错误的是( )A.图中电子云重叠表示电子在核间出现的概率大B.是两个氢原子核外的1s原子轨道发生重叠形成共价键C.氢原子的核外电子呈云雾状,在两核间分布得密一些,将两核吸引D.氢原子之间形成σ键,s-s σ键没有方向性
高中化学人教版 (2019)选择性必修2第一节 共价键图文课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一节 共价键图文课件ppt,共40页。
人教版 (2019)选择性必修2第一节 共价键完美版ppt课件: 这是一份人教版 (2019)选择性必修2第一节 共价键完美版ppt课件,文件包含第一节第1课时共价键pptx、课时分层作业五docx等2份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
化学选择性必修2第一节 共价键教学ppt课件: 这是一份化学选择性必修2第一节 共价键教学ppt课件,共39页。PPT课件主要包含了理查德·费曼,氯化钠晶体结构,氯化钠晶体,HCl气体,HCl分子结构模型,H2分子结构模型,NaCl晶体,微粒间的相互作用,共价键,离子键等内容,欢迎下载使用。













