






北京课改版九年级下册第9章 溶液综合与测试复习课件ppt
展开定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶夜。
均一性:指溶液任一部分的组成和性质相同稳定性:在外界条件不变时,溶液稳定存在混合物:凡是溶液都属于混合物
:(1)均一性(2)稳定性(3)混合物
均一、透明、稳定的液体不一定是溶液,如水.
溶液不一定是无色的:如硫酸铜溶液(蓝色)—— Cu2+氯化铁溶液(黄色)——Fe3+氯化亚铁、硫酸亚铁溶液(浅绿色)——Fe2+高锰酸钾溶液(紫红色)—— MnO4-
例、1、下列说法正确的是:
A、溶液一定是液体B、空气也是溶液C、50mL酒精和50mL水混合得到100mL溶液D、盐水和糖水都是溶液,两者混合在一起,则不是溶液了
2、花生油、盐、酱、醋是厨房中常用的调味品,将它们分别与足量水充分混合后,形成的混合物属于溶液的是( )①花生油 ②食盐 ③面酱 ④白醋A.①③ B.②③ C.①④ D.②④
3、下列物质属于溶液的是( )A.石灰浆 B.生理盐水 C.菜汁 D.牛奶
溶液、溶质与溶剂之间的量的关系1、m溶液 m质+m剂2、V溶液 V质+ V剂
命名:某溶质的某溶剂溶液(如:氯化钠的水溶液)
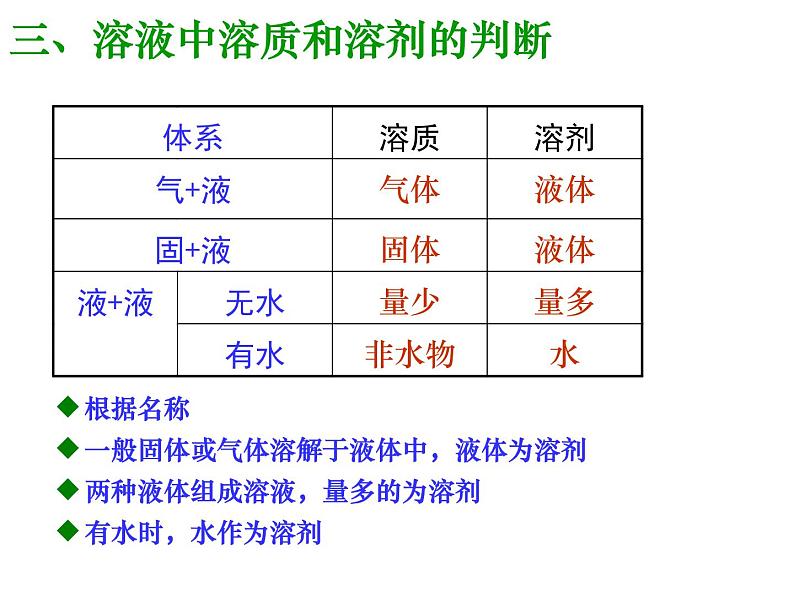
三、溶液中溶质和溶剂的判断
根据名称一般固体或气体溶解于液体中,液体为溶剂两种液体组成溶液,量多的为溶剂有水时,水作为溶剂
说明: 1、水是最常用的溶剂,最常见的溶液就是水溶液2、汽油也可能做溶剂,它可以溶解油脂——用汽油洗油污.3、酒精也可做溶剂,如溶解碘形成碘酒。
4、物质在溶解过程中发生了化学变化,在形成的溶液中,溶质是反应后的生成物,如:蓝矾(胆矾)溶于水时,形成的溶液中溶质是硫酸铜,而不是胆矾.
1、把下列物质混合,能得到溶液的是 ( ) A.冰加到水中 B.植物油加到水中 C.碘加入酒精中 D.面粉加到水中
Zn+H2SO4=ZnSO4+H2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
碘几乎不溶,溶液略显棕黄色
高锰酸钾溶解,溶液呈紫色
高锰酸钾几乎不溶,溶液为无色
不同溶质在不同的溶剂中的溶解
相同的溶质在不同的溶剂中溶解性不同不同的溶质在相同的溶剂中溶解性不同
①许多化学反应在溶液中进行,可以加快反应的速率。 ②溶液对动植物和人的生理活动有很重要的意义。动物摄取食物里的养料必须经过消化,变成溶液后才能吸收;
定义:小液滴分散到液体里形成的混合物叫做乳浊液(或乳状液)
乳浊液的特征:不均一、不稳定
定义:固体小颗粒悬浮于液体里形成的混合物叫做悬浊液(或悬浮液)
用洗涤剂去油污:洗涤剂是乳化剂,能使油分散成无数细小的液滴而不聚成大的油珠。这些小液滴能随水流走达到洗净衣物的目的。
四、溶解时的吸热或放热现象
探究:NaCl、NH4NO3、 NaOH 三种物质溶于水后溶液的温度改变.
物质溶解过程中常常伴随着吸热或放热现象.
溶质的分子向水中扩散,这一过程吸收热量,溶质的分子和水分子作用,生成水合分子,这一过程放出热量。吸收或放出热量不同,就产生温度的变化.
如右图向试管里的水中加入某种物质后,原来U型管内两臂在同一水平上的红墨水,右边液面降低了些,左边的液面上升了些,则加入的物质是 A、活性炭 B、生石灰C、硝酸铵 D、氢氧化钠
(二)饱和溶液 不饱和溶液
1.概念(1)饱和溶液和不饱和溶液 : 在一定温度下,一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液.
讲溶液饱和或不饱和,一定要指明温度和溶剂质量.讲饱和溶液或不饱和溶液一定要强调溶质
(2)浓溶液和稀溶液---粗略地表示溶液里溶质含量的多少
2、饱和溶液和不饱和溶液的相互转化关系
一般规律:不饱和溶液 饱和溶液
升温、蒸发溶剂、加溶质 特殊溶质Ca(OH)2不饱和溶液 饱和溶液 降温、加溶剂
降温、蒸发溶剂、加溶质
1、在某一瓶某溶质的饱和溶液中,加入一些该溶质的 晶体,则( ) A 晶体质量减少 B 溶液中溶质质量增大 C 晶体质量不变 D溶液质量增大2、将40℃时的KCl饱和溶液降温至10℃,然后将析出的晶体过滤出去;再将滤液恢复到 40℃,则该溶液与原溶液相比 ( ) A.还是饱和溶液 B.溶质的质量分数不变 C. 溶质的质量没变 D.溶剂的质量不变
1.物质的溶解性 一种物质溶解在另一种物质里的能力叫做溶解性,溶解性的大小跟溶质和溶剂的性质有关.同一种物质在不同溶剂里的溶解性不相同,不同种物质在同一种溶剂里的溶解性也不相同
2.固体物质的溶解度(1)抓住的四个要点: ①“在一定温度下” ②“在100克溶剂” ③“饱和状态” ④“所溶解的克数”
(3)溶解性粗略地、定性地表示物质的溶解能力.而溶解度精确地、定量地衡量溶解性的大小.如20℃时溶解度与溶解性的关系见下表(S表示溶解度)
(4)影响溶解度的因素 ①溶质的性质;②溶剂的性质(见溶解性部分) ③温度
(5)溶解度的表示方法 ——溶解度随温度变化有两种表示方法:①列表法;②溶解度曲线。
(1)溶解度曲线的意义 :同一种物质在不同温度时的溶解度;不同物质在同一温度时的溶解度,交点温度下两种物质的溶解度相等;可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;能进行有关的计算
4、气体物质的溶解度气体物体溶解度是指该气体在压强为101kPa,一定温度时溶解在1体积水里达到饱和状态时的气体体积.
气体的溶解度与温度和压强有关,随温度升高而减小,随压强增大而增大
三.混合物的分离 把混合物里的几种物质分开,得到较纯净的物质,叫做混合物的分离。 过滤和结晶是常用的混合物分离的方法
过滤是分离固体和液体,或说除去液体中混有的固体物质. ①过滤使用的仪器和用品:铁架台(附铁圈)、漏斗、烧杯、玻璃棒、滤纸.过滤必须做到“一贴”、“二低”、“三靠”
结晶是溶液中的溶质形成晶体的过程.从溶液中结晶析出晶体的方法主要有:①蒸发溶剂法——— 适用于溶解度受温度影响较小的固体溶质.如蒸发海水获得食盐晶体。②冷却热饱和溶液法——— 适用于溶解度受温度影响较大的固体溶质.如冷却热的硝酸钾饱和溶液获得硝酸钾晶体.
注意:①固体溶质结晶后往往还需要过滤来取得这些晶体.②采用结晶的方法可以分离提纯两种固体溶质.如分离NaCl和KNO3的固体混合物
4.粗盐提纯的步骤(1)溶解;(2)过滤;(3)蒸发;(4)转移
〖例1〗在粗盐提纯实验中,蒸发溶液时,下列操作正确的是( ) A.把浑浊的液体倒人蒸发皿内加热 B.开始析出结晶时,停止用玻璃棒搅拌 C.蒸发皿中出现较多量固体时,停止加热 D.待液体彻底蒸发后停止加热
〖例2〗欲使硝酸钾从其饱和溶液中快点分离出来,可采用的方法是( )A.冷却饱和硝酸钾溶液 B.在该温度时蒸发水份C.升高饱和溶液的温度 D先加热蒸发一部份水再降温
四、溶液组成的表示方法
1、溶液中溶质的质量分数 溶质的质量分数 = ×100%
2、溶质的质量分数与溶液体积、密度有关的换算 计算依据:溶液质量[M(溶液)]=溶液体积(V)×溶液密度(ρ)溶液体积(V) M(溶液质量) (溶质质量)
3、溶液的稀释与浓缩的计算
溶液加浓有两种方法:一种是补充溶质,另一种是蒸发剂,后者又称“浓缩”,溶液稀释的方法是补充溶剂。m1×w1%=m2×w2%在上式的四个量中,若已知其中一个量即可求出另一个量
(1) 溶质的质量分数,溶解度与化学方程式的综合计算。准确找到溶液的质量,计算时应先统一 单位。
溶质的质量分数和溶解度比较表
100克 不一定
一定饱和 不一定饱和
克 是比值用%表示
溶解度与饱和溶液中溶质质量分数互算关系
强调:(1)计算溶质质量分数,用概念中所列关系式进行计算.(2)浓溶液的稀释计算,用有关关系式计算 (3)有关溶质的质量分数与化学方程式相结合的计算,各物质在化学方程式计算中的质量须是纯净物的质量.
关键是记住溶质的表示方法
溶液的稀释、配制、混合问题
化学北京课改版第9章 溶液综合与测试复习课件ppt: 这是一份化学北京课改版第9章 溶液综合与测试复习课件ppt,共25页。PPT课件主要包含了针对训练,有关溶液的计算,溶质的质量分数,溶质质量等内容,欢迎下载使用。
初中化学北京课改版九年级下册第10章 金属综合与测试复习ppt课件: 这是一份初中化学北京课改版九年级下册第10章 金属综合与测试复习ppt课件,共25页。PPT课件主要包含了金属的化学性质,稀硫酸,化合反应,置换反应,二除杂,方法一,方法二,方法三,哪个方法更好,足量Fe等内容,欢迎下载使用。
初中化学第9章 溶液综合与测试复习ppt课件: 这是一份初中化学第9章 溶液综合与测试复习ppt课件,共37页。PPT课件主要包含了考点一溶解度,一定温度,g溶剂,饱和状态,NaCl,KNO3,CaOH2,随温度的升的而增大,受温度影响较小,随温度升高而减小等内容,欢迎下载使用。














