





2022年江西省中考化学二轮复习专题突破课件化学计算
展开这是一份2022年江西省中考化学二轮复习专题突破课件化学计算,共60页。PPT课件主要包含了氢气或H2,二氧化碳或CO2,氯化银或AgCl,87g,氧气或O2,四或三,碳酸钙CaCO3,硫酸或H2SO4,g×98%,t×80%等内容,欢迎下载使用。
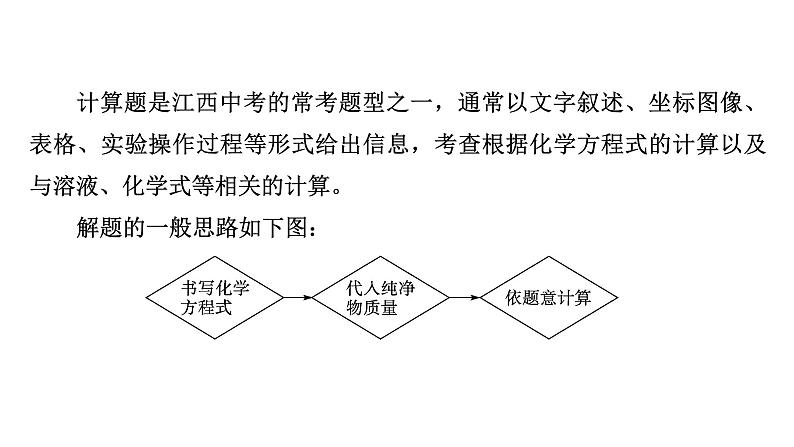
计算题是江西中考的常考题型之一,通常以文字叙述、坐标图像、表格、实验操作过程等形式给出信息,考查根据化学方程式的计算以及与溶液、化学式等相关的计算。解题的一般思路如下图:
一、寻找可以代入化学方程式的纯净物质量方法1 直接读取纯净物质量方法指导根据化学方程式进行计算时,带入的纯净物(反应物、生成的沉淀或气体)的质量由题干直接给出或从坐标曲线、实物图等中直接读取。
考向1 直接代入纯净物质量[例1] 为测定某铁粉和炭粉混合物中铁粉的含量,称取10 g该混合物样品于烧杯中,加入足量的稀盐酸充分反应,测得生成氢气的质量为0.2 g。计算该混合物样品中铁粉的含量时需代入化学方程式中的纯净物为____________,质量为__________。
考向2 分析坐标曲线读出纯净物质量[例2] 为测定某石灰石矿中碳酸钙的含量,现称取12.5 g石灰石样品于烧杯中,向其中逐滴加入稀盐酸(杂质不溶于水,也不参与反应),产生CO2气体的质量与加入稀盐酸的质量关系如图所示(假设生成的气体全部逸出)。计算该石灰石样品中碳酸钙的含量时需代入化学方程式中的纯净物为________________,质量为__________。
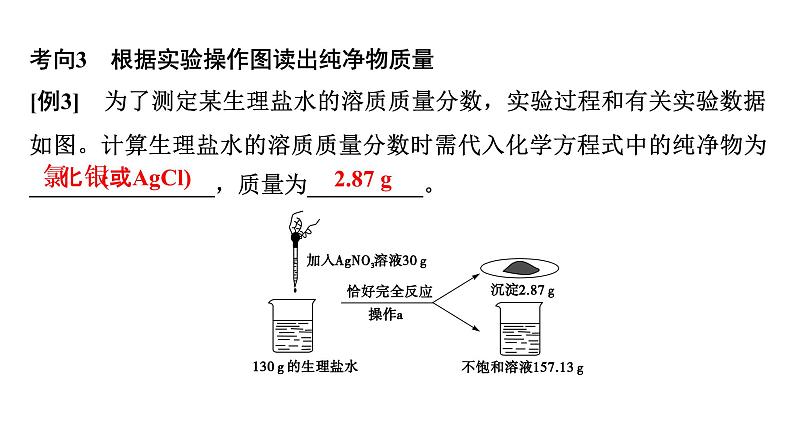
考向3 根据实验操作图读出纯净物质量[例3] 为了测定某生理盐水的溶质质量分数,实验过程和有关实验数据如图。计算生理盐水的溶质质量分数时需代入化学方程式中的纯净物为________________,质量为__________。
方法2 利用质量差计算纯净物质量方法指导1.根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,结合题干给出的反应前后物质的质量,利用质量差计算相关的量(常为生成气体或沉淀的质量)。2.计算公式:生成沉淀(或气体)的质量=反应前物质的总质量-反应后剩余物质的总质量。
考向1 根据题干数据计算纯净物质量[例4] 实验室中发现一瓶因长期放置而被氧化的铝粉。取6.0 g铝粉样品,将100.0 g稀硫酸逐滴加入,待完全反应后,称得剩余物的质量为105.9 g。计算样品中铝单质的质量时需代入化学方程式中的纯净物为__________,质量为____________________(写出计算式即可,下同)。
100.0 g+6.0 g-105.9 g
考向2 根据坐标曲线计算纯净物质量[例5] 实验室用68 g过氧化氢溶液和2 g二氧化锰制取氧气,实验的相关数据如图所示,计算该过氧化氢溶液中溶质的质量分数时需代入化学方程式中的纯净物为__________,质量为_____________。
70 g-68.4 g
考向3 根据实验操作图计算纯净物质量[例6] 草木灰的主要成分是碳酸钾。某化学兴趣小组进行如下实验(假设杂质不与稀盐酸反应,生成的气体全部逸出)。计算碳酸钾的质量分数时需代入化学方程式中的纯净物为_______________,质量为__________________。
30 g+100 g-121.2 g
考向4 根据表格数据计算纯净物的质量[例7] 实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100 g碳酸钠溶液,将150 g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
计算碳酸钠溶液中溶质的质量分数时,应用第________次实验的数据代入计算,需代入化学方程式中的纯净物为________________,质量为________________________________________________。
100 g+150 g-232 g(或100 g+120 g-202 g)
方法3 根据质量分数计算纯净物质量方法指导1.分析参加反应的物质质量,根据参与反应的某种溶液或不纯物质的质量及相应的质量分数计算纯净物质量。2.计算公式:纯净物的质量=溶液(或不纯物)质量×质量分数(或纯度)。
考向1 根据溶质质量分数计算纯净物质量[例8] 某同学对实验室中一瓶氢氧化钠溶液的溶质质量分数进行测定,取20 g该氢氧化钠溶液于烧杯中,滴入几滴无色酚酞溶液,然后缓慢滴加9.8%稀硫酸至10 g时,恰好完全反应。计算该氢氧化钠溶液中溶质的质量分数时需代入化学方程式中的纯净物为_________________,质量为______________。
考向2 根据不纯物质质量分数计算纯净物质量[例9] 工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁。现有400 t含氧化铁80%的赤铁矿石。求该矿石理论上能冶炼得到铁的质量时代入化学方程式中的纯净物为___________________,其质量为________________。
氧化铁(或Fe2O3)
类型1 文字叙述类1.(2020·江西第24题)“二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。(杂质不参加反应)(1)实验时需配制50 g 5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制,则需称量氢氧化钠固体的质量为________g。解析:(1)氢氧化钠质量为50 g×5%=2.5 g。
(2)取20 g废液样品于烧杯中,向其中逐滴加入5%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液16 g。计算废液中盐酸的溶质质量分数。(写出计算过程)答案:(2)3.65%(计算过程见解析)
(3)恰好完全反应时烧杯中的溶液所含粒子数目关系:Na+______(填“>”“<”或“=”)Cl-。解析:(3)实验室用稀盐酸和石灰石或大理石制取二氧化碳,废液中还有氯化钙,故氯离子数目大于钠离子数目。
2.(2017·江西中考,24题)学习小组测定某工业废水(含有H2SO4、HNO3,不含固体杂质)中H2SO4的含量。取100 g废水于烧杯中,加入100 g BaCl2溶液,恰好完全反应,经过滤得到176.7 g溶液。(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)(1)充分反应后生成沉淀的质量为________ g;(2)该工业废水中硫酸的质量分数为多少?(写出计算过程)
(3)为避免工业废水污染环境,排放前应对废水进行中和处理,需加入的物质是________________________。
氢氧化钙[或Ca(OH)2等]
3.(2020·天津中考)为测定某石灰石样品中碳酸钙的质量分数,取25 g该样品(杂质不参加反应也不溶于水),加入盛有146 g稀盐酸的烧杯中,恰好完全反应,气体全部逸出,反应后烧杯内物质的总质量为162.2 g。计算:(1)生成二氧化碳的质量;答案:(1)8.8 g解析:(1)根据质量守恒定律可知:生成二氧化碳的质量为25 g+146 g-162.2 g=8.8 g;(1)生成二氧化碳质量是8.8 g。
(2)石灰石样品中碳酸钙的质量分数;答案:(2)80%
(3)反应后所得溶液中溶质的质量分数(结果精确至0.1%)。答案:(3)14.1%
4.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100 g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120 g,反应结束后溶液的总质量是215.6 g。试回答下列问题:【知识卡片】洁厕灵有效成分是HCl,洁厕灵中其他成分均不跟NaHCO3反应。
(1)产生的二氧化碳质量为________g。(2)该品牌洁厕灵中HCl的质量分数是多少?(写出计算过程)
(3)分析可知,洁厕灵和炉具清洁剂(主要成分为NaOH)不能混合使用,原因是_____________________________________________。
洁厕灵和炉具清洁剂会发生化学反应(合理即可)
5.现有一含NaCl杂质的Na2CO3样品,取13.9 g样品溶于水,配成104.4 g溶液,此溶液与100 g某浓度的盐酸恰好完全反应,得到200 g溶液。请计算:(1)生成的二氧化碳的质量为________g;
(2)样品中Na2CO3的质量分数。(写出计算过程,结果精确到0.1%)
(3)所得溶液中溶质为________(写化学式)。
类型2 坐标曲线类6.(2013·江西中考)某厂排放的废水中含有碳酸钠,易造成环境污染。化学兴趣小组为该厂设计废水处理和利用的方案,进行了如下实验:取过滤后的水样200 g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示。请回答下列问题(不考虑水样中杂质的影响):
(1)反应生成CO2气体的质量是________g。
(2)反应后生成氯化钠的质量是多少?(写出计算过程)
(3)农业上常用10%~20%的氯化钠溶液来选种。请通过列式计算判断:上述实验反应后所得溶液能否直接用于农业上选种?
7.市售某浓盐酸试剂瓶标签上的有关数据如图甲所示。小张同学取5 mL该浓盐酸加入锥形瓶中,加水稀释后,再逐滴滴加溶质质量分数为50%的NaOH溶液,反应过程中溶液的pH变化如图乙所示。
(1)小张同学所取的5 mL浓盐酸的质量为________g。
(2)通过计算,判断该浓盐酸中HCl的质量分数是否与试剂瓶标签上的数据相符。(写出计算过程,计算结果精确到0.1%)答案:(2)解:盐酸完全反应时消耗氢氧化钠的质量为4.8 g×50%=2.4 g,设5 mL该浓盐酸中HCl的质量为x。NaOH+HCl===NaCl+H2O 40 36.5 2.4 g x
(3)若取5 mL该浓盐酸稀释成3.65%的稀盐酸,需加入水的质量为________g。
8.(2020·江西南昌中考一模)钙是人体中的常量元素,缺钙时可通过食用补钙药剂来增加摄入量,现将20片该药剂制成粉末(主要成分为碳酸钙,每片1 g,其他成分不与盐酸反应且不含钙元素),并与50 g盐酸混合,充分反应后得到如图所示的图像,请根据有关信息回答问题。(1)反应结束共生成二氧化碳的质量为________g。
(2)计算每片药剂中所含碳酸钙的质量分数。(写出计算过程)
(3)反应结束后,溶液中的阳离子主要为_____________(写离子符号)。
9.(2021·江西二模)氯化铜是重要的化工原料,可用作催化剂、杀虫剂等。为测定某氯化铜溶液中溶质的质量分数,小组同学取100 g氯化铜溶液于烧杯中,逐滴加入溶质质量分数为16%的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。请回答下列问题:
(1)若实验室现有溶质质量分数为32%的氢氧化钠溶液100 g,欲配制成溶质质量分数为16%的氢氧化钠溶液,需加入水的质量是__________ g。解析:(1)设需加入水的质量为m100 g×32%=(100 g+m)×16%解得:m=100 g。
(2)将配制好的溶液装瓶保存,应装在__________(填“广口瓶”或“细口瓶”)中。解析:(2)将配制好的溶液装瓶保存,应装在细口瓶中;(3)恰好完全反应时消耗氢氧化钠的质量是____________ g。解析:(3)由图像可知,恰好完全反应时消耗氢氧化钠溶液的质量为100 g,氢氧化钠的质量是100 g×16%=16 g;
(4)计算氯化铜溶液中溶质的质量分数。(写出计算过程)答案:(4)27%
10.(2020·江西九江三模)为测定某纯碱样品中(含有氯化钠杂质)碳酸钠的质量分数,现称取10.0 g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5 g时,烧杯内溶液的总质量为44.3 g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:(1)A点产生气体的质量为__________。
(2)试样中碳酸钠的质量分数。(写出计算过程)
(3)B点时,烧杯内溶液中溶质的化学式为_______________。
11.(2020·江西赣州章贡模拟)化学兴趣小组的同学探究稀盐酸与石灰石反应的混合溶液成分(含有HCl和CaCl2),进行了如下实验:
(1)取混合溶液40 g于烧杯中,加入溶质质量分数为5.3%的Na2CO3溶液,产生沉淀的质量与加入Na2CO3溶液的质量关系如图所示。从图中可知,生成沉淀的质量是________g。
(2)计算原混合溶液中CaCl2的溶质质量分数。(写出计算过程)
(3)若要将混合溶液完全转化为氯化钙溶液,可加入______________。
类型3 表格数据类12.(2018·江西中考)为测定某黄铜(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取20 g黄铜粉末于烧杯中,将80 g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
(1)黄铜粉末完全反应生成氢气的总质量为________g。
(2)该黄铜中铜的质量分数为多少?(写出计算过程)
(3)第三次实验后所得溶液中的溶质是__________________(写化学式)。
ZnSO4和H2SO4
13.(2021·江西南昌市南昌县中考质检)普通黄铜是由铜和锌组成的二元黄铜,该金属材料具有强度高、耐腐蚀性强、可塑性强、耐磨性强等特点。其中,含锌量在36%~46%之间的黄铜性能最为优越,称为两相(α+β)黄铜。某研究小组用14.6%稀盐酸测定黄铜的组成(所有计算结果精确到小数点后1位)(1)用36.5%浓盐酸配制100 g 14.6 %稀盐酸。①计算:需要浓盐酸的质量为__________ g(体积33.6 mL),需要水的体积为__________ mL。
②量取浓盐酸和水:量取36.5%的浓盐酸时如果俯视读数,会导致所配溶液溶质质量分数__________ 14.6%(填“大于”“小于”或“等于”)。解析:(1)①需要浓盐酸的质量为:100 g×14.6%÷36.5 %=40 g;需要水的质量为:100 g-40 g=60 g;需要水的体积为:60 g÷1 g/mL=60 mL;②量取36.5%的浓盐酸时如果俯视读数,会使量取的液体体积偏小,即使溶质的质量偏小,会导致所配溶液溶质质量分数偏小;
(2)测定黄铜样品中铜的质量分数。称取黄铜样品20 g,用100 g 14.6%的稀盐酸分4次加入样品中,测得数据记录如下表。
试通过计算回答:①该黄铜是否符合两相黄铜标准?答案:(2)①符合
②锌完全反应时所得溶液中溶质的质量分数(计算结果精确到0.1%)。答案:②24.2%
14.(2020·江西吉安吉州一模)熙熙有一只银手镯(银锌合金),他想用实验探究手镯中银含量。先用电子秤称得手镯的质量是25.00 g,再用50 g稀盐酸分多次与此手镯充分反应,实验数据如下表:
根据上表中数据分析,回答下列问题:(1)手镯中银的质量是__________g。
(2)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
(3)向第5次反应后的溶液中加入足量AgNO3溶液,能生成AgCl的质量是________g。
15.将氯化钠和氯化铁的固体混合物40 g完全溶于101.4 g水中形成溶液,再将100 g一定溶质质量分数的氢氧化钠溶液分5次加入该溶液中,充分反应后,测得的实验数据如下表所示:求:(1)表中m的值为________。
(2)第________次恰好完全反应。
(3)原混合物中氯化铁的质量分数为多少?(写出计算过程)
16.为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20 g固体混合物置于烧杯中,将100 g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
回答下列问题:(1)原固体混合物中,氧化铜的质量分数为________。(2)上表中,a的值为________,实验③所得溶液中的溶质是__________________(填化学式)。
CuSO4和H2SO4
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)答案:(3)解:根据题目中数据可知,25 g稀硫酸反应消耗的氧化铜的质量为4 g,设25 g稀硫酸中溶质的质量为x。CuO+H2SO4===CuSO4+H2O80 984 g x
类型4 流程图、实物图类17.(2020·江西南昌调研三模)为测定碳酸钙粉末与稀盐酸反应生成二氧化碳的质量(假设二氧化碳全部从溶液中逸出,不考虑试剂的挥发),进行如下实验:首先称量两个烧杯的质量(如图甲),然后向小烧杯中加入过量的稀盐酸,向大烧杯中加入一定量的碳酸钙粉末,称量总质量(如图乙),将小烧杯中过量的稀盐酸全部倒入盛有一定量碳酸钙粉末的大烧杯中,并记录天平的示数,直到充分反应,天平示数与反应时间的关系如图丙所示。请计算:
(1)充分反应后生成的二氧化碳气体的质量为________g。
(2)充分反应后溶液中氯化钙的质量分数。(写出计算过程)
(3)为避免环境污染,反应后的废液中加入____________________进行处理。
18.(2021·江西赣州市经开区中考摸底)镁合金也是一种航天材料,最常见的有镁铝合金和镁锌合金。某化学小组在航空展中获得一块12 g的航天镁合金,大家想判断它是何种合金,于是用1瓶98%的浓硫酸,正确稀释后,进行如图实验:
(1)生成氢气的总质量为__________________________________________ g。
生成氢气的质量为205.6 g+10 g-215.4 g=0.2 g
(2)计算该稀硫酸中溶质的质量分数。(写出计算过程)
(3)稀释浓硫酸时应注意_________________________________________________________,取50 g浓硫酸稀释成实验中所用溶质质量分数的稀硫酸需要加水__________ g。(4)小组成员取样品于烧杯中缓慢滴加稀盐酸,充分反应后向反应后溶液中放入__________,由此可判断该合金为镁铝合金。
将浓硫酸沿烧杯器壁慢慢注入水里,并用玻璃
19.安多夫是一种嫩肉粉,其主要成分是碳酸氢钠(NaHCO3)和氯化钠。小张发现将安多夫粉充分加热可以得到一种白色固体混合物,成分为碳酸钠和氯化钠,于是设计实验方案(如下图),探究其成分含量。请回答下列问题:(1)操作①为________。
(2)白色固体混合物中的Na2CO3的质量是多少?(写出计算过程,结果精确到0.1 g)
(3)该安多夫样品中NaHCO3的质量分数为________。
20.小科为测定某石灰石样品(主要成分为碳酸钙,其他成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6 g,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图像如图乙(碱石灰能吸收二氧化碳和水)。
(1)在反应过程中生成二氧化碳的质量为________g。
(2)计算该石灰石样品中碳酸钙的质量分数。(写出计算过程 ,结果精确到0.1%)
(3)下列情况中,会导致测得的碳酸钙的质量分数偏大的是________(填序号)。①去掉装置A,将空气直接鼓入装置B②去掉装置C,将B与D装置直接相连③当气泡停止产生时,立即停止鼓入空气
21.(2021·江西中考)国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了下图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)(1)溶解时玻璃棒的作用是_________________。解析:(1)溶解时玻璃棒的作用是搅拌,加速溶解。
(2)实验中加入过量CaCl2溶液的目的是____________________________。解析:(2)实验中需要通过生成碳酸钙沉淀的质量计算碳酸钠的质量,加入过量CaCl2溶液的目的是使碳酸钠全部转化为沉淀。
使碳酸钠全部转化为沉淀
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)
(4)实验过程中个别同学出现了以下问题。①过滤时得到的滤液浑浊,原因可能是___________________________________;(任写一种)②过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该样品中碳酸钠的质量分数计算结果__________。(选填“偏大”“不变”或“偏小”)
滤纸破损或液面高于滤纸边缘等
相关课件
这是一份中考化学二轮复习专项突破(课件)专项七 化学计算(含答案),共57页。PPT课件主要包含了24∶3∶40,1∶2,95mL,类型二坐标图象型,氯化钠,类型三表格数据型等内容,欢迎下载使用。
这是一份中考化学复习专题突破五计算题教学课件,共49页。PPT课件主要包含了O2或氧气,NaCl,CaCl2,ACD,有气泡产生,增加气体的溶解度等内容,欢迎下载使用。
这是一份中考化学复习专题突破五计算题分层作业课件,共53页。PPT课件主要包含了类型二表格数据类,类型三坐标图像类,类型四综合类,CO2或二氧化碳,N或钾和氮,降温结晶,NH4Cl,标准比色卡等内容,欢迎下载使用。












