

化学科粤版第六章 金属6.2 金属的化学性质学案
展开6.2金属的化学性质
学习目标
1.知道铁、镁、铜等常见金属与氧气的反应。
2.通过不同金属与盐酸、稀硫酸等发生反应实验探究,探究金属与酸的反应规律。
3.对金属能否在金属化合物溶液中发生反应的实验探究,探究金属的活动性顺序。
学习过程
一、金属与氧气的反应
1.常温下金属镁 __易________ 与空气中的氧气反应。
2.纯铁在常温下不能与氧气反应,纯铁与氧气反应的条件是__点燃_____________。
3.铜与氧气反应的条件是__加热______,反应的化学方程式为__2_Cu+O2_
4.不能与氧气反应生成氧化物的金属是___金________。
说明:1. “真金不怕火炼”说明金在高温时能否与氧气反应? 不反应
2.为什么铝具有优良的抗腐蚀性能?【结合课本的知识回答】
常温下, 铝易与空气中氧气反应生成一层致密的氧化膜起到保护作用。
3.综合镁、铝、铁、铜、金等金属与氧气反应的条件和现象等信息,可知:
①大多数金属都能与_氧气______反应,反应剧烈程度__不同_____(选“相同”或“不同”)
② 镁 、 铝 在常温下就能与氧气反应; 铜 、 汞 在常温下不能与氧气反应, 但在高温时能与氧气反应; 金 即使在高温时不能与氧气反应。
说明金属的活动性: __镁__、_铝__ 较活泼,__铜__、__汞__次之, __金____最不活泼。
二、金属与盐酸、稀硫酸的反应
镁与稀硫酸能反应,锌与稀盐酸能反应,那镁与稀盐酸、锌与稀硫酸能反应吗? 铁和铜等金属呢?…
1、分别在放有少量镁条、锌粒、铁丝和铜丝的试管中加入稀盐酸,观察现象,比较反应的剧烈程度,并记录在下表中。再用稀硫酸代替稀盐酸进行实验。
| 稀盐酸 | 稀硫酸 | ||
实验现象 | 有关化学方程式 | 实验现象 | 有关化学方程式 | |
镁 | 有气泡产生 | Mg+2HCl=MgCl2+H2↑ | 同前 | Mg+H2SO4=MgSO4+H2↑ |
锌 | 有气泡产生 | Zn+2HCl=ZnCl2+H2↑ | 同前 | Zn+H2SO4=ZnSO4+H2↑ |
铁 | 有气泡产生,溶液变成浅绿色 | Fe+2HCl=FeCl2+H2↑ | 同前 | Fe+H2SO4=FeSO4+H2↑ |
铜 | 无现象 |
| 同前 |
|
2、讨论:
①根据反应时是否有H2产生将金属分两类:能与盐酸、稀硫酸反应生成H2的
金属有_镁锌铁_ ___ ;不能与盐酸、稀硫酸反应生成H2的金属有__铜 _;
②铁、镁、锌和稀盐酸或稀硫酸反应时剧烈程度不同:__ 镁 __反应最剧烈,
其次是 __锌 __,然后是__铁 _, 由此推出金属活动性顺序__镁锌铁铜_ _______
③观察上表中镁、锌、铁与盐酸和稀硫酸反应的化学方程式,对于能发生的反应,若从反应物和生成物的物质类别(指单质或化合物)的角度去分析,比较它们与化合反应、分解反应的不同:它们都是由一种__单质_____与一种__化合物_____反应,生成另一种___单质____与另一种__化合物______,这类反应叫做__置换 ____反应。
④下列反应属于置换反应的有( CD )
A、CH4+2O2 = CO2+2H2O B、CuO+CO=Cu+CO2
C、C+2CuO = 2Cu+CO2↑ D、Fe+CuSO4=FeSO4+Cu
⑤由铁与盐酸、稀硫酸和硫酸铜溶液的反应,我们知道铁单质与盐酸、稀硫酸或某些化合物溶液发生置换反应后,铁元素的化合价变为 +2 价。
解题通法:活泼金属与稀盐酸或稀硫酸反应的相关计算规律
1.等质量的同种稀盐酸或稀硫酸与足量的较活泼金属充分反应,生成H2的质量 相等 。
2.等质量的稀盐酸和稀硫酸分别与足量的较活泼金属充分反应, 稀盐酸 生成H2的质量多。
3.等质量的不同活泼金属与足量的稀盐酸或稀硫酸反应,产生H2质量的多少与 化合价 和 相对原子质量 有关。产生H2的质量=(金属反应后金属元素的化合价×金属的质量)/该金属的相对原子质量. 同价态的金属相对原子质量越大,产生H2的质量越 多 。
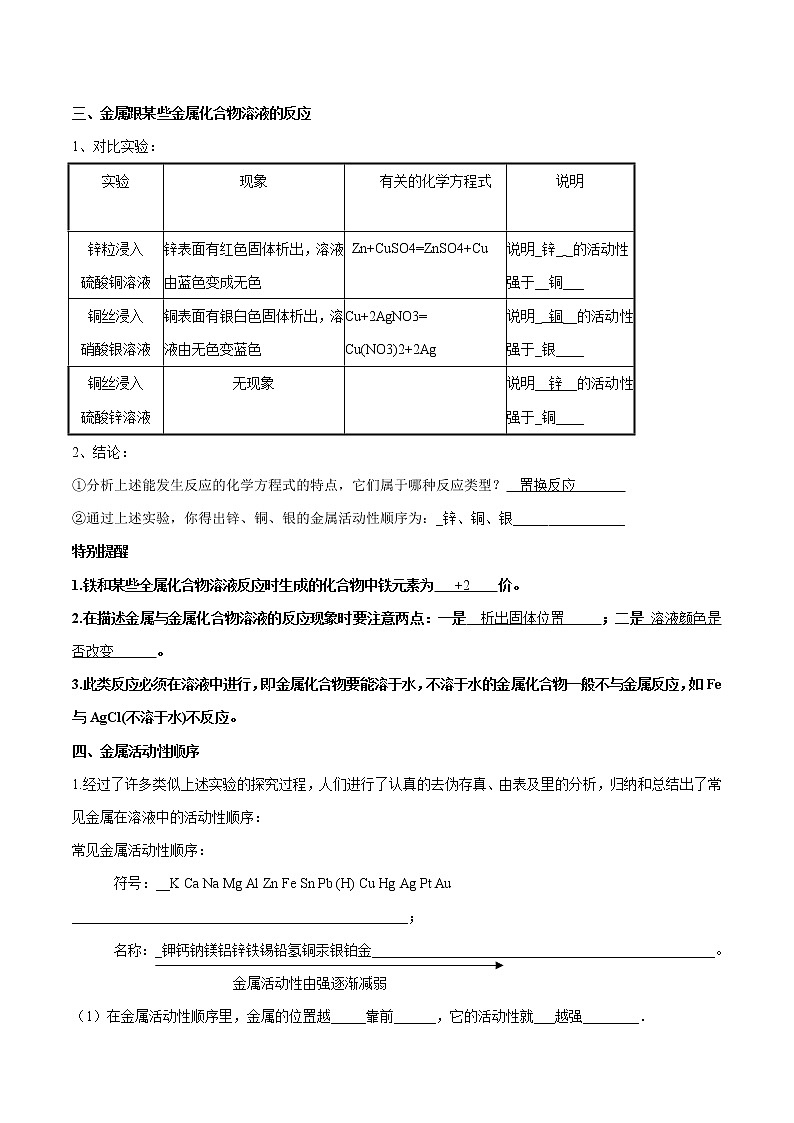
三、金属跟某些金属化合物溶液的反应
1、对比实验:
实验 | 现象 | 有关的化学方程式 | 说明
|
锌粒浸入 硫酸铜溶液 | 锌表面有红色固体析出,溶液由蓝色变成无色 | Zn+CuSO4=ZnSO4+Cu | 说明_锌_ _的活动性 强于__铜___ |
铜丝浸入 硝酸银溶液 | 铜表面有银白色固体析出,溶液由无色变蓝色 | Cu+2AgNO3= Cu(NO3)2+2Ag | 说明_ 铜__的活动性强于_银____ |
铜丝浸入 硫酸锌溶液 | 无现象 |
| 说明_ 锌__的活动性强于_铜____ |
2、结论:
①分析上述能发生反应的化学方程式的特点,它们属于哪种反应类型? 置换反应
②通过上述实验,你得出锌、铜、银的金属活动性顺序为:_锌、铜、银_____ _
特别提醒
1.铁和某些全属化合物溶液反应时生成的化合物中铁元素为 +2 价。
2.在描述金属与金属化合物溶液的反应现象时要注意两点:一是 析出固体位置 ;二是 溶液颜色是否改变 。
3.此类反应必须在溶液中进行,即金属化合物要能溶于水,不溶于水的金属化合物一般不与金属反应,如Fe与AgCl(不溶于水)不反应。
四、金属活动性顺序
1.经过了许多类似上述实验的探究过程,人们进行了认真的去伪存真、由表及里的分析,归纳和总结出了常见金属在溶液中的活动性顺序:
常见金属活动性顺序:
符号:__K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au ________________________________________________;
名称:_钾钙钠镁铝锌铁锡铅氢铜汞银铂金_________________________________________________。
金属活动性由强逐渐减弱
(1)在金属活动性顺序里,金属的位置越_____靠前______,它的活动性就___越强________.
(2)在金属活动性顺序里,位于氢___前__的金属能置换出盐酸、__硫酸____中的___氢__.
(3)在金属活动性顺序里,位于__前面___的金属能把位于_后面____的金属从它们化合物的_溶液中___置换出来.
归/纳/总/结:
判断金属活动性强弱的方法
1.通过金属与0,反应的难易程度进行判断:金属越活泼,越易与02反应,一般地,反应条件越容易达到说明金属的活动性越强。
2.相同条件下,通过金属与稀盐酸(或稀硫酸)能否反应以及反应的剧烈程度进行判断:金属越活泼,与酸反应越剧烈。
3.相同条件下,通过金属与另一种金属的化合物溶液的反应情况进行判断:若能反应,则说明该金属的活动性比另一种金属的活动性强;若不能反应,则说明该金属的活动性比另一种金属的活动性弱。
金属与盐溶液发生置换反应解题通法:
1.一种金属与多种金属化合物溶液反应时,首先要清楚反应的先后顺序,较活泼金属优先置换出活动性最弱的金属,再置换出活动性较弱的金属。
2.多种金属与一种金属化合物溶液反应时,活动性最强的金属优先反应,然后是活动性较强的金属反应。
3.根据反应物量的不同,反应分三种情况:部分反应、恰好完全反应、过量。据此分析滤液、滤渣的成分。
学习检测
1.下列物质在氧气中燃烧,能生成黑色固体的一组是( D )
①Mg ②Al ③Fe ④P ⑤Cu ⑥C
A.①④⑥ B.②③⑥ C .③⑤⑥ D.③⑤
2.如图是X、Y、Z、W四种金属与稀盐酸反应状况的示意图,据此判断四种金属中活动性最弱的是( B )
A. X B.Y C.Z D.W
3.金属与酸反应生成氢气与对应的化合物,下列化合物能由金属与酸发生置换反应直接制取的是( B )
A.Fe2(SO4)3 B.MgCl2 C.FeCl3 D.CuSO4
4.下列反应中,不属于置换反应的是( D )
A.Cl2+2NaBr=2NaCl+Br2 B.2Mg+CO2MgO+C
C.2Na+2H2O=2NaOH+H2↑ D.2Na2O2+2H2O=4NaOH+O2↑
5.将适量的铁粉投入到盐酸中,下列现象不会出现的是( D )
A.溶液变成浅绿色 B.有无色气体产生 C.铁粉不断减少 D.有棕色沉淀生成
6.在CuCl2和ZnCl2的混合溶液中,加入过量的铁粉,反应后过滤,滤纸上的物质是( C )
A.Cu B.Fe C.Cu、Fe D.Cu、Fe、Zn
7、现有X、Y、Z三种金属,若将X、Y、Z分别放入稀硫酸中,只有X溶解并产生气泡;若将Y、Z分别放入AgNO,溶液中,Y表面析出银白色固体,而Z表面无变化,则三种金属活动性由强到弱的顺序是( D )
A.Z>X>Y B.Y>Z>X C.X>Z>Y D.X>Y>Z
8、某同学为验证铁、铜、银三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的是D
A.将铁丝、铜丝分别放入AgNOg溶液中 B.将铁丝、铜丝、银丝分别放入稀盐酸中
C.将铁丝分别放入CuSOa溶液、AgNO,溶液中 D.将铁丝、银丝分别放入CuSOa溶液中
9、在AgNOg、Mg(NO3)2和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应后,过滤,洗涤,将滤渣放入盐酸中有气泡产生,滤液中存在的阳离子是( D )
A.Cu2+ B.只有Fe2+ C.Fe2+和Fe3+ D.Mg2+和Fe2+
10.除去下列物质中的杂质,选用的方法或试剂正确的是( D )
选项 | 物质 | 含少量杂质 | 除去杂质所用的试剂和方法 |
A | 铁粉 | 硫酸铜粉末 | 加水溶解后过滤、将滤渣洗涤干燥 |
B | 一氧化碳 | 二氧化碳 | 通过灼热的氧化铜 |
C | 氧化钙 | 碳酸钙 | 高温煅烧后加入水中 |
D | 氯化钠固体 | 泥沙 | 加适量水溶解后过滤,蒸发滤液 |
11.室温下,等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是( C )
A. B. C. D.
初中化学科粤版九年级下册8.4 常用的盐学案: 这是一份初中化学科粤版九年级下册8.4 常用的盐学案,共7页。学案主要包含了常见的盐,盐的组成和分类,推断题,简答题,计算题等内容,欢迎下载使用。
科粤版九年级下册第八章 常见的酸、碱、盐8.3 酸和碱的反应学案: 这是一份科粤版九年级下册第八章 常见的酸、碱、盐8.3 酸和碱的反应学案,共5页。学案主要包含了酸和碱之间会不会发生反应?,中和反应,复分解反应,中和反应的应用等内容,欢迎下载使用。
科粤版九年级下册7.1 溶解与乳化学案: 这是一份科粤版九年级下册7.1 溶解与乳化学案,共4页。学案主要包含了溶液的形成等内容,欢迎下载使用。













