






科粤版九年级下册6.2 金属的化学性质优秀课件ppt
展开1.知道铁、铝、铜等常见金属与氧气的反应。2.初步认识常见金属与盐酸、硫酸的置换反应,以及与盐溶液的置换反应。3.能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。
1、金属材料在人类活动中已得到越来越广泛的应用。下列属于金属共性的是 ( )A.很高的熔点 B.良好的导电性C.很大的硬度 D.银白色的光泽2、下列有关合金的说法正确的是( )A.合金属于化合物B.合金不能导电、传热C.合金没有延展性D.合金的很多性能与组成他们的纯金属不同
通过上节课的学习,我们已经了解了 金属的物理性质。
那么,金属有哪些化学性质呢?
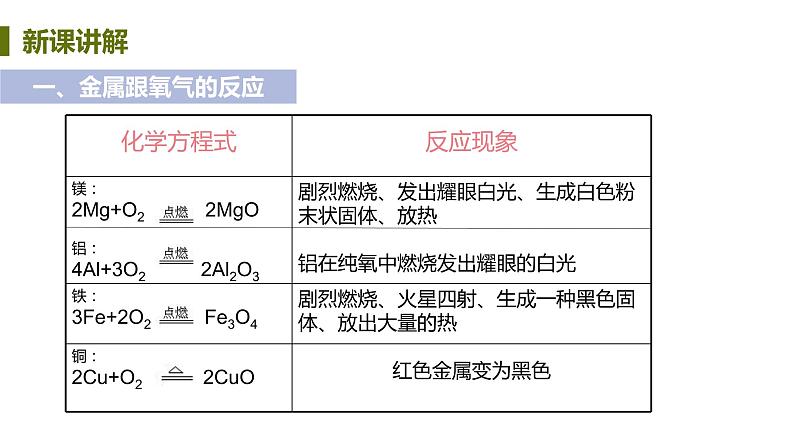
我们学过的镁、铁、铜与氧气反应现象及化学方程式。
(2)铝的化学性质很活泼,而铝制品却很难腐蚀为什么? 能否用钢刷、沙等来擦洗铝制品?
(1)“真金不怕火炼”是金在高温下也不与_______ 反应,说明金的 (填“物理”、“化学”)性质非常稳定。
常温下铝与空气中的氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化。因此,铝制品具有耐腐蚀性。
二、与稀盐酸或稀硫酸的反应
产生气泡快速反应放大量热
Mg + 2HCl == MgCl2 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
产生气泡速率较慢,溶液无色变为浅绿色
Fe + 2HCl == FeCl2 + H2↑
结论:许多金属都能与稀盐酸或稀硫酸反应产生氢气。
三、金属与某些金属化合物溶液的反应
铝丝表面覆盖一层红色的铜,溶液由蓝色变成无色
铜丝表面覆盖一层银白色的银,溶液由无色逐渐变成蓝色
2Al + 3 CuSO4 == Al2( SO4)3 + 3Cu
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
现象:铁条上有红色物质生成,溶液由蓝色变为浅绿色
铁钉与硫酸铜溶液的反应
我国古代人民智慧的体现之一:湿法冶金。
1.定义:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。2.通式:A + BC = AC + B
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au 钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
1.越靠前活动性越强,钾最活泼,金最不活泼。2.氢前金属能从酸(稀盐酸、稀硫酸)中置换出氢,氢后金属则不行。(浓硫酸、硝酸除外)
3.排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。4.相同条件下,位置越前的金属,与酸反应越剧烈。
注意:K 、Ca、Na 金属性特强,其反应在初中不作要求。
下列金属中,金属活动性最强的是( )
解析:根据常见的金属活动性顺序表分析判断。常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。
A.钙B.铁C.铜D.银
小东同学向盛有硝酸锌和硝酸银混合液的烧杯中加入一定量的镁粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生,下列说法正确的是( )A.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸锌B.滤液中一定含有硝酸镁,可能含有硝酸银C.滤渣中一定含有银和锌,可能有镁D.反应后滤液的质量大于反应前溶液的质量
解析:根据镁的金属活动性比银和锌都强;向盛有硝酸锌和硝酸银混合液的烧杯中加入一定量的镁粉,镁先能与AgNO3溶液反应生成硝酸亚铁溶液和银,硝酸银反应完后,随后镁与硝酸锌反应生成锌和硝酸镁,向滤渣中加入稀盐酸,有气泡产生,说明滤渣中含有能与稀盐酸反应的金属,该金属应为镁或锌。
能用金属和盐酸直接反应制得的物质是( )①FeCl3;②ZnCl2;③CuCl2;④AlCl3A.①②B.②④C.③④D.①③
解析:利用金属活动性顺序回答,排在氢前面的金属能与酸反应生成盐和氢气,氢后面的金属不与酸反应,铁和酸反应生成亚铁盐,不能生成正三价的铁盐。
大多数金属都能与氧气反应生成金属氧化物,但反应的难易与剧烈程度不同 通式:金属 +氧气→金属氧化物(_______反应,填基本反应类型)
举例(用化学方程式表示)
铝:_______________________(铝具有良好的抗腐蚀性的原因) 镁:_______________________铁:_______________________铜:_______________________现象:生成_____色物质 金:金的化学性质很稳定,高温时也不与氧气反应
4Al+3O2=== 2Al2O3
化学方程式:________________________________现象:有_______产生,溶液颜色由______色变 _____色
通式:金属 +可溶性盐→新金属 +新盐(______反应,填基本反应类型) 反应条件:参加反应的金属活动性顺序排在生成的新金属之前(K、Ca、Na除外)
化学方程式:_________________________现象:有_________产生,溶液由___色逐渐变_______色
Fe+CuSO4=== FeSO4+Cu
Cu+2AgNO3=== Cu(NO3)2+2Ag
通式:金属单质 +酸→盐 +氢气(酸为稀盐酸和稀硫酸) 反应条件:金属活动性顺序排在氢(H)之前
【特别提醒】铁单质与稀盐酸、稀硫酸或盐溶液发生置换反应,只能生成亚铁离子(Fe2+), 不能生成铁离子(Fe3 +)
1、收藏家收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )A.铝不易被氧化 B.铝的金属活动性比较弱C.铝不易发生化学反应 D.铝表面的氧化膜具有保护作用2、下列各组金属中,按金属活动性由强到弱顺序排列的是 ( ) A.Na、Fe、Mg B.K、Cu、Fe C.Ca、Ag、Zn D.Al、Zn、Hg
科粤版九年级下册6.2 金属的化学性质课文配套ppt课件: 这是一份科粤版九年级下册<a href="/hx/tb_c94341_t3/?tag_id=26" target="_blank">6.2 金属的化学性质课文配套ppt课件</a>,共15页。PPT课件主要包含了学习目标,新知学习,铝和硫酸铜溶液,铁和硫酸铜溶液,铜和硫酸铝溶液,交流讨论,金属活动性顺序,药品操作判断,当堂检测等内容,欢迎下载使用。
化学第六章 金属6.2 金属的化学性质背景图课件ppt: 这是一份化学第六章 金属6.2 金属的化学性质背景图课件ppt,共31页。PPT课件主要包含了MgFe,MgCu,置换反应,学完本课题你应该知道,化学方程式,课堂练习等内容,欢迎下载使用。
科粤版九年级下册6.2 金属的化学性质背景图课件ppt: 这是一份科粤版九年级下册6.2 金属的化学性质背景图课件ppt,共30页。PPT课件主要包含了铁与氧气反应,铜与氧气反应,人民电影院,金与氧气不反应,常温和高温下都不反应,置换反应,金属活动性由强减弱,反应现象无变化,金属活动性顺序表,课堂小结等内容,欢迎下载使用。













