



















高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体教学ppt课件
展开你已经知道,冰容易融化,干冰容易气化,碘晶体容易升华。那么,你知道这些晶体为什么具有上述的特殊性质吗?它们的结构是怎样的呢?科学研究揭示,30亿年前,在地壳下200 km左右的地幔中处在高温、高压岩浆中的碳元素,逐渐形成了具有正四面体结构的金刚石。火山爆发时,金刚石夹在岩浆中上升到接近地表时冷却,形成含有少量金刚石的原生矿床。金刚石具有诸多不同凡响的优良性质:熔点高(3 350 ℃),不导电,硬度极高。这些性质显然是由金刚石的结构决定的。那么,金刚石具有怎样的结构呢?
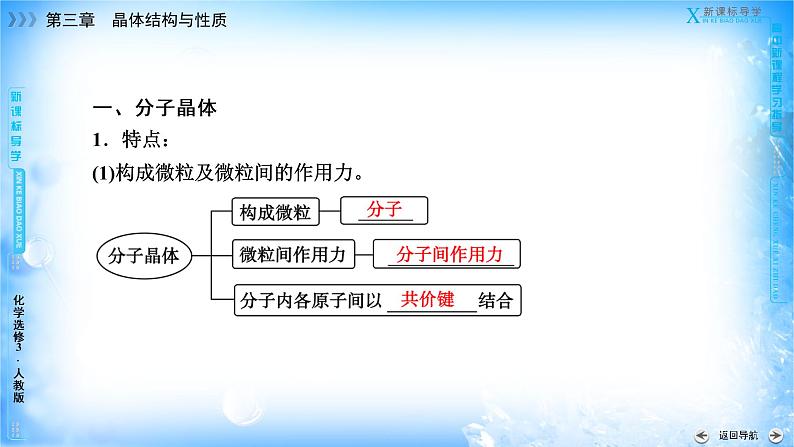
一、分子晶体1.特点:(1)构成微粒及微粒间的作用力。
(2)微粒堆积方式。①若分子间作用力只有____________,则分子晶体有______________特征,即每个分子周围有______个紧邻的分子。②分子间还含有其他作用力,如________,则每个分子周围紧邻的分子要少于12个。如冰中每个水分子周围只有_____个紧邻的水分子。
2.分子晶体与物质的类别:
3.两种典型的分子晶体的组成和结构:
(1)干冰。①每个晶胞中有_____个CO2分子,______个原子。②每个CO2分子周围等距离紧邻的CO2分子数为______个。(2)冰。①水分子之间的作用力有____________,但主要是________。②由于________的方向性,使四面体中心的每个水分子与四面体顶点的_____个相邻的水分子相互吸引。
二、原子晶体1.结构特点:(1)构成微粒及作用力。
(2)空间构型:整块晶体是一个三维的共价键________结构,不存在________的小分子,是一个“巨分子”,又称________晶体。(3)常见的原子晶体:①常见的非金属单质,如金刚石(C),硼(B)、__________(Si)等;②某些非金属化合物,如__________(SiC)、氮化硼(BN)、二氧化硅(SiO2)等。
2.典型原子晶体的结构:(1)金刚石晶体的结构特点:①在晶体中每个碳原子以4个____________对称地与相邻的4个碳原子相结合,形成____________结构。
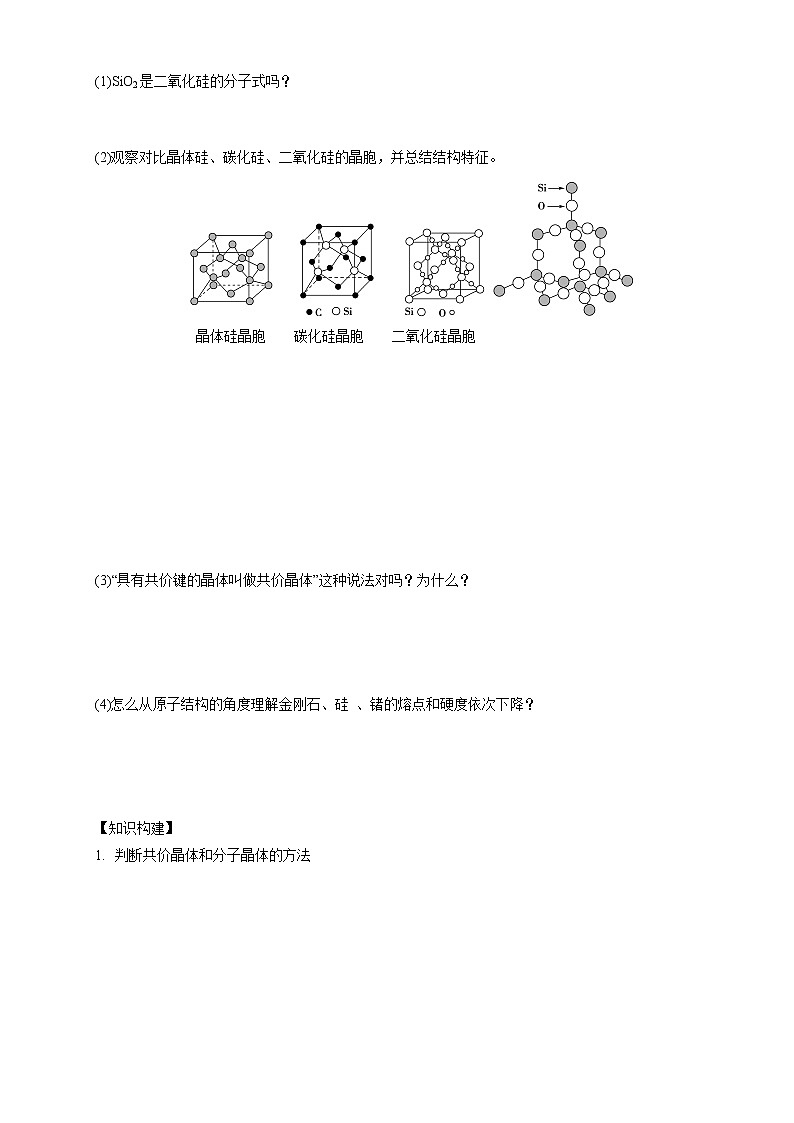
②晶体中碳碳键之间的夹角为_____________,碳原子采取了_______杂化。③最小环上有_____个碳原子。(2)SiO2的结构特点:把金刚石晶体中的______原子换为______原子,每两个硅原子之间增加一个______原子,即形成SiO2的晶体结构。
1.思考辨析:(1)分子晶体中一定存在共价键。( )(2)干冰升华的过程中破坏了共价键。( )(3)二氧化硅和干冰虽然是同一主族的氧化物,但属于不同的晶体类型。( )(4)分子晶体的熔、沸点比较低,原子晶体的熔、沸点比较高。( )(5)含有共价键的晶体都是原子晶体。( )(6)SiO2是二氧化硅的分子式。( )
2.下列晶体由原子直接构成,且属于分子晶体的是( )A.二氧化硅B.固态氖C.白磷D.三氧化硫解析:二氧化硅是由硅、氧原子构成的原子晶体,A错;固态氖由原子构成的分子晶体,B正确;白磷是由P4分子构成的分子晶体,C错;三氧化硫是由SO3分子构成的分子晶体,D错。
3.当SO3晶体熔化时,下列各项中发生变化的是( )A.化学键 B.硫与氧的原子个数之比C.分子构型D.分子间作用力解析:当SO3晶体熔化时,分子间作用力被破坏,故选D项。
4.分子晶体具有某些特征的本质原因是( )A.组成晶体的基本微粒是分子B.熔融时不导电C.基本构成微粒间以分子间作用力相结合D.熔点一般比较低解析:分子晶体相对于其他晶体来说,熔、沸点较低,硬度较小,本质原因是其基本构成微粒间的相互作用——范德华力及氢键相对于化学键来说比较弱。
5.氮化铝(AlN)是一种熔点很高、硬度大、不导电、难溶于水和其他溶剂的晶体,将下列各组物质加热熔化或气化,所克服微粒间作用力与AlN相同的是( )A.水晶、金刚石B.食盐、硫酸钾C.碘、硫D.硅、干冰解析:根据AlN熔点高、硬度大、不导电、难溶于水和其他溶剂可知AlN晶体是原子晶体,熔化时共价键被破坏,A、B、C、D四个选项中属于原子晶体的有水晶(SiO2)、金刚石、晶体硅,故A项正确。
6.金刚石和金刚砂(SiC)具有相似的晶体结构,在金刚砂的空间网状结构中,碳原子、硅原子交替以单键相结合。试回答下列问题。(1)金刚砂属于________晶体。金刚砂熔点比金刚石熔点______。(2)在金刚砂的结构中,一个硅原子周围结合_____个碳原子,键角是_____________。(3)金刚砂的结构中含有由共价键形成的原子环,其中最小的环上有_____个硅原子。
解析:根据题意可知金刚砂属于原子晶体,由于Si—C键的键长大于C—C键的键长,故Si—C键的键能小,金刚砂的熔点比金刚石的熔点低。硅原子与碳原子交替以共价单键相结合,且Si、C原子都形成四个单键,故一个碳原子周围结合4个硅原子,同时一个硅原子周围结合4个碳原子。由于硅原子周围的四个碳原子在空间呈正四面体形排列,故键角为109°28′。类比金刚石中最小的原子环中有6个碳,则在金刚砂中,最小的环上应有3个硅原子和3个碳原子。
1.分子晶体的构成粒子是什么?该粒子间的作用力是什么?各分子内的各原子间(稀有气体除外)的作用力是什么?2.分子晶体有哪些物理性质?3.原子晶体的构成微粒是什么?粒子间的作用力是什么?其堆积方式是什么结构?又被称作什么?4.常见的原子晶体有哪些?5.金刚石最小环上有几个碳原子?SiO2的最小环是由几个硅原子和几个氧原子构成的十二元环?
知识点一 原子晶体与分子晶体比较与判断
1.提示 分子晶体的构成粒子是分子,相邻分子间存在分子间作用力;分子内的各原子间以共价键结合。2.提示 一般熔点较低,硬度较小。3.提示 原子晶体的构成微粒是原子,所有原子都以共价键相互结合,其堆积方式是三维的共价键网状结构,又称共价晶体。4.提示 (1)某些单质,如硼、硅等;(2)某些非金属化合物,如SiC、BN等。5.提示 金刚石最小环上有6个碳原子,SiO2的最小环是由6个硅原子和6个氧原子构成的十二元环。
1.原子晶体和分子晶体的比较
2.判断分子晶体和原子晶体的方法(1)依据构成晶体的微粒和微粒间的作用力判断。构成原子晶体的微粒是原子,微粒间的作用力是共价键;构成分子晶体的微粒是分子,微粒间的作用力是分子间作用力。(2)依据晶体的熔点判断。原子晶体的熔点高,常在1 000 ℃以上,而分子晶体熔点低,常在数百度以下甚至温度更低。
(3)还可以依据晶体的硬度与机械性能判断。原子晶体硬度大,分子晶体硬度小且较脆。(4)依据导电性判断。分子晶体为非导体,但部分溶于水后能导电;原子晶体多数为非导体,但晶体硅、锗是半导体。(5)记忆常见的、典型的原子晶体。常见的原子晶体有:①单质:金刚石、晶体硅、晶体硼、晶体锗等;②化合物:SiO2、SiC、BN、AlN、Si3N4等。除原子晶体外的绝大多数非金属单质、气态氢化物、非金属氧化物、酸、绝大多数有机物(有机盐除外)都属于分子晶体。
硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。(1)基态硅原子的核外电子排布式为___________________。(2)晶体硅的微观结构与金刚石相似,晶体硅中Si—Si键之间的夹角大小约为_____________。
1s22s22p63s23p2
(3)请在框图中补充完成SiO2晶体的结构示意图(部分原子已画出),并进行必要的标注。___________________________
(4)下表列有三种物质(晶体)的熔点:简要解释熔点产生差异的原因:①SiO2和SiCl4:___________________________________________________ _____________________________________________________。②SiCl4和SiF4:__________________________________________________ __________________________________________________________________。
SiO2是原子晶体,微粒间作用力为共价键;SiCl4是分子
晶体,微粒间作用力为范德华力,故SiO2熔点高于SiCl4的
SiCl4和SiF4均为分子晶体,微粒间作用力为范德华力,
结构相似时相对分子质量越大,范德华力越大,故SiCl4熔点高于SiF4的
解析:(2)晶体硅以一个硅原子为中心,与另外4个硅原子形成正四面体结构,所以Si—Si键之间的夹角大小约为109°28′。(3)图中给出的是硅晶体的结构,SiO2晶体相当于在硅晶体结构中的每个Si—Si键中“插入”一个氧原子,所以只要在上述每两个硅原子之间“画”一个半径比硅原子小的原子,再用实线连起来即可。(4)晶体类型不同,其熔点具有很大的差别,一般原子晶体的熔点高,而分子晶体的熔点低。规律方法指导:原子晶体是一个三维的共价键网状结构,是一个“巨分子”;原子晶体的化学式不表示实际组成,只表示组成原子的个数比;由原子构成的晶体不一定是原子晶体,如由稀有气体组成的晶体属于分子晶体;原子晶体中不存在范德华力。
1.有下列几种晶体:A.水晶;B.冰醋酸;C.白磷;D.金刚石;E.晶体氩;F.干冰。(1)属于分子晶体的是______________,直接由原子构成的分子晶体是_____。(2)属于原子晶体的化合物是_____。(3)直接由原子构成的晶体是___________。(4)受热熔化时,需克服共价键的是________。
解析:根据构成晶体的微粒不同,分子晶体仅由分子构成,原子晶体中无分子。分子晶体有B、C、E、F,注意晶体氩是单原子分子晶体;原子晶体和单原子分子晶体都是由原子直接构成的,原子晶体有A、D,但属于化合物的只有A;分子晶体熔化时,一般不破坏化学键;原子晶体熔化时,破坏共价键。
1.观察下列结构,回答下列问题。
知识点二 分子晶体和原子晶体熔沸点高低的比较
(1)CO2晶体与SiO2晶体的构成微粒是什么?熔融SiO2晶体需破坏的作用力是什么?(2)CO2晶体中有哪些作用力?干冰升华时破坏的是什么作用力?2.从金刚石、晶体硅性质数据表分析原子晶体熔点、硬度与什么有关?金刚石、晶体硅性质数据表
1.(1)提示 CO2晶体是由CO2分子构成的,SiO2晶体是由Si原子与O原子构成的;熔融SiO2晶体需破坏共价键。(2)提示 CO2晶体中有共价键和范德华力。干冰升华时破坏范德华力。2.提示 在原子晶体里,所有原子都以共价键相结合。金刚石中C—C键键长比晶体硅中Si—Si键键长短,C—C键键能大,故金刚石熔点比晶体硅的高,硬度比晶体硅的大。
1.对于不同类型的晶体来说,熔沸点的高低顺序为原子晶体>分子晶体。2.对于同属于分子晶体的不同晶体:(1)分子间作用力越大,物质的熔沸点越高;非金属氢化物分子间含有氢键的分子晶体,熔沸点比同族元素的氢化物反常得高。如H2O>H2Te>H2Se>H2S。(2)组成和结构相似的分子晶体,相对分子质量越大,熔沸点越高。如SnH4>GeH4>SiH4>CH4。(3)组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔沸点越高。如CO>N2,CH3OH>CH3CH3。
3.对于同属于原子晶体的不同晶体:(1)晶体的熔沸点高低取决于共价键的键长和键能。键长越短,键能越大,共价键越稳定,物质的熔沸点越高。(2)若没有告知键长或键能数据时,可比较原子半径的大小。一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。原子半径越小,则化学键的键长越短,化学键就越强,键就越牢固,破坏化学键需要的能量就越大,故晶体的熔点就越高。如比较金刚石、碳化硅、晶体硅的熔点高低。原子半径:C
碳化硅(SiC)是一种晶体,具有类似于金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体:①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( )A.①③② B.②③①C.③①②D.②①③
解析:C与Si同为第ⅣA族元素,它们的相似性表现在金刚石是原子晶体,晶体硅、碳化硅也是原子晶体。从碳到硅原子半径逐渐增大,形成共价键的键能逐渐减弱。可推断碳化硅的熔点应在Si与C之间。三种原子晶体空间结构相似,熔点取决于它们的键长与键能,故熔点从高到低分别是金刚石、碳化硅、晶体硅,故正确答案为A。规律方法指导:比较晶体的熔点高低,首先弄清晶体属于哪种类型,然后根据不同晶体的规律进行判断。分子晶体的熔点由分子间作用力决定,同时注意含氢键物质的反常;原子晶体则比较共价键的强弱。
2.下列说法中,正确的是( )A.冰融化时,分子中H—O键发生断裂B.原子晶体中,共价键越强,熔点越高C.分子晶体中,共价键键能越大,该分子晶体的熔点一定越高D.分子晶体中,分子间作用力越大,该物质越稳定解析:冰为分子晶体,融化时破坏的是分子间作用力,故A项错误;原子晶体熔点的高低取决于共价键的强弱,共价键越强,熔点越高,故B项正确;分子晶体熔点的高低取决于分子间作用力的大小,而共价键的强弱决定了分子的稳定性大小,所以C项和D项错误。
混合键型晶体——石墨实验测定,石墨的熔点高达3 850 ℃,高于金刚石的熔点,这说明石墨晶体具有原子晶体的特点;但是,石墨很软并且能导电,它是非常好的润滑剂,这又不同于原子晶体。那么,石墨究竟属于哪种类型的晶体呢?
研究发现,石墨的晶体具有层状结构,每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键相结合,形成无限的六边形平面网状结构;共价键的键长为0.142 nm,键角为120°。每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道,并含有一个未成对电子,因此能够形成遍及整个平面的大π键。正是由于电子可以在整个六边形网状平面上运动,因此石墨的大π键具有金属键的性质,这就是石墨沿层的平行方向导电性强的原因。这些网络状的平面结构再以范德华力结合形成层状结构,层与层之间的距离为0.335 nm。这样,石墨晶体中既有共价键,又有范德华力,同时还有金属键的特性。我们将这种晶体称为混合键型晶体。这种特殊的结构决定了石墨具有某些独特的性质,并用于制造电极、润滑剂、铅笔芯、原子反应堆中的中子减速剂等。
石墨晶体为层状结构,每一层均为碳原子与周围其他3个碳原子相结合而成的平面片层,同层相邻碳原子间距为142 pm、相邻片层间距为335 pm。如图是其晶体结构片层俯视图。下列说法不正确的是( )A.碳原子采用sp2杂化 B.每个碳原子形成3个σ键C.碳原子数与σ键键数之比为2∶3 D.片层之间的碳形成共价键
高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第三节 金属晶体与离子晶体教学课件ppt
人教版 (2019)选择性必修2第二节 分子晶体与共价晶体教学ppt课件: 这是一份人教版 (2019)选择性必修2第二节 分子晶体与共价晶体教学ppt课件,文件包含321分子晶体pptx、321分子晶体-练习解析版docx、321分子晶体-练习原卷版docx、321分子晶体-学案解析版docx、321分子晶体-教学设计docx、321分子晶体-学案原卷版docx等6份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
化学选择性必修2第三节 金属晶体与离子晶体教学ppt课件: 这是一份化学选择性必修2第三节 金属晶体与离子晶体教学ppt课件,文件包含332离子晶体过渡晶体与混合型晶体pptx、332离子晶体过渡晶体与混合型晶体-练习解析版docx、332离子晶体过渡晶体与混合型晶体-学案解析版docx、332离子晶体过渡晶体与混合型晶体-教学设计docx、332离子晶体过渡晶体与混合型晶体-练习原卷版docx、332离子晶体过渡晶体与混合型晶体-学案原卷版docx等6份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













