
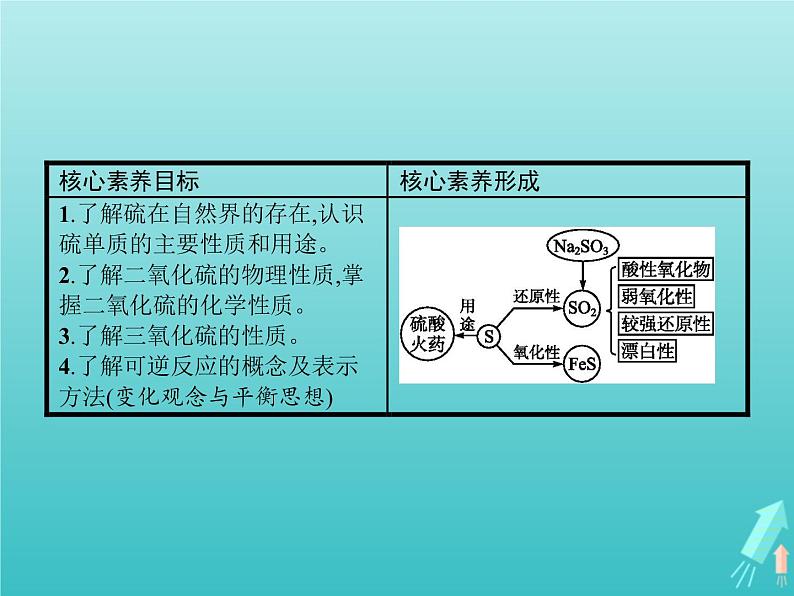




- 2021_2022学年高中化学第3章自然界中的元素第2节第2课时氨与铵态氮肥课件鲁科版必修1 课件 1 次下载
- 2021_2022学年高中化学第3章自然界中的元素第2节第3课时硝酸人类活动对氮循环的影响课件鲁科版必修1 课件 1 次下载
- 2021_2022学年高中化学第3章自然界中的元素第3节第2课时不同价态硫元素间的转化酸雨及其防治课件鲁科版必修1 课件 1 次下载
- 2021_2022学年高中化学第3章自然界中的元素第4节第1课时海水中的元素及海水提镁课件鲁科版必修1 课件 1 次下载
- 2021_2022学年高中化学第3章自然界中的元素第4节第2课时溴与海水提溴课件鲁科版必修1 课件 1 次下载
化学必修1第3节 硫的转化图片课件ppt
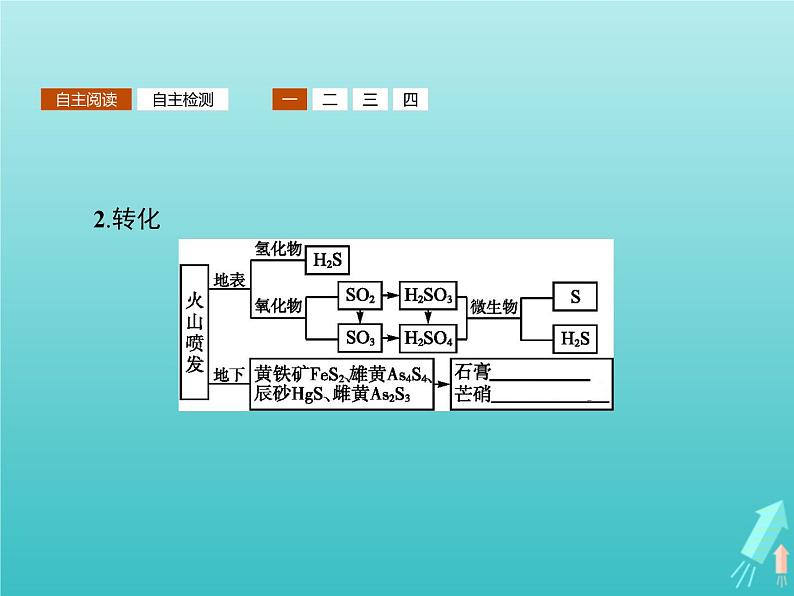
展开一、自然界中的硫1.存在(1)游离态的硫存在于火山喷口附近或地壳的岩层里。(2)化合态:①主要以硫化物和硫酸盐的形式存在。②重要的化合物。
二、认识硫单质硫单质俗称硫黄,常见的同素异形体有斜方硫和单斜硫。1.物理性质
3.用途主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造火药、烟花爆竹等。
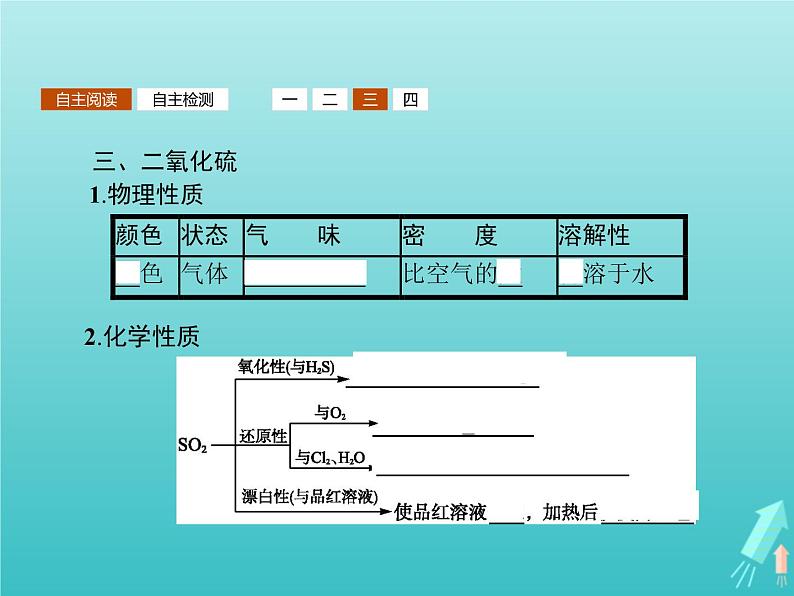
三、二氧化硫1.物理性质
3.实验室制法写出反应的化学方程式:Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O。4.用途:制硫酸、漂白剂、消毒剂和防腐剂。
四、三氧化硫三氧化硫具有酸性氧化物的通性,主要反应如下:
1.下列说法不正确的是( )A.硫是一种淡黄色的不溶于水的晶体B.硫的化合物常存在于火山喷发的气体中C.单斜硫和斜方硫都是硫单质D.硫在空气中燃烧的产物是SO2,在纯氧中燃烧的产物是SO3解析:S在纯氧气和在空气中燃烧时产物都是SO2。答案:D
2.下列有关说法正确的是( )A.因为硫单质具有氧化性,故铁粉与硫粉共热可以生成Fe2S3B.硫单质可以在空气中燃烧,其燃烧的化学方程式有两种:S+O2C.做过硫的燃烧实验的试管内壁附着有一些固体物质,可以采用酒精清洗D.硫的化合物常存在于火山喷出的气体中和矿泉水中
解析:硫单质的氧化性较弱,与变价金属反应只能生成低价金属盐,因此A项错误;B选项中考查了硫的燃烧,当硫在氧气中燃烧时,只能生成SO2,不能得到SO3,SO2只有在催化剂、加热条件下才可以与O2反应生成SO3,所以B项错误;C项考查了硫单质的溶解性,硫燃烧后试管内壁剩余的固体是硫单质,不溶于水,微溶于酒精,易溶于CS2,所以应用CS2除去,也可以用热的碱液清洗。答案:D
3.4.8 g硫与0.2 ml O2充分反应后的气体总体积在标准状况下为( ) L L L解析:S+O2 SO2,反应前后气体的体积没有变化,V=V(O2)=0.2 ml×22.4 L·ml-1=4.48 L。答案:D
4.下列现象说明SO2具有氧化性的是( )A.SO2通入酸性高锰酸钾溶液使之退色B.SO2通入石蕊溶液中使之变为红色C.SO2通入氯水中使之退色D.SO2通入饱和H2S溶液中析出浅黄色沉淀解析:SO2具有氧化性,则S元素在反应中的化合价应降低。酸性高锰酸钾溶液、氯水都是常见的氧化剂,SO2与它们反应显示还原性,S的化合价升高。石蕊溶液是用来检验物质的酸碱性的,与物质的氧化性、还原性无关。答案:D
各类漂白剂的漂白原理
将SO2通入品红溶液中,品红溶液为什么会退色?加热时又显红色说明了什么?探究提示因为SO2具有漂白作用,能使品红溶液退色,其作用机理是SO2与有色物质结合生成了不稳定的无色物质;加热时又显红色,这是无色物质又分解为原物质的缘故,说明生成的无色物质不稳定。
具有漂白性质的物质归纳比较氯水(HClO)、Na2O2、SO2、活性炭都具有漂白作用,但漂白过程发生的变化不尽相同,比较如下:HClO、Na2O2的漂白作用是由于它们的强氧化性,使有色物质被氧化成无色物质,这一过程发生了氧化还原反应,且是不可逆的,即退色后的物质无论放置多久都不能恢复其原来的颜色。SO2的漂白作用是由于SO2与有色物质结合,生成一种不稳定的无色物质,这一过程类似于无机化合反应生成了不稳定的化合物,因而是可逆的,放置久了或加热时又会分解并释放出二氧化硫而恢复其原来的颜色。活性炭的漂白为物理性吸附,属于物理变化。
【例题1】 将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条。则布条的颜色( ) A.变色 B.不变C.先退色后又复原 D.变为无色解析:二氧化硫和氯气虽然都能使湿润的红色布条退色,但等物质的量的二氧化硫和氯气同时作用于湿润的有色布条时则发生反应SO2+Cl2+2H2O H2SO4+2HCl,不再具有漂白作用,布条的颜色保持不变。答案:B
规律方法点拨Cl2能使湿润的红色布条退色是因为发生反应Cl2+H2O HCl+HClO,生成的HClO具有漂白性。
跟踪训练1下列物质都具有漂白性,其中漂白原理与其他几种不同的是( )A.SO2 B.H2O2C.O3 D.HClO解析:SO2的漂白是由于它能与某些有色物质生成不稳定的无色物质,其他均为氧化漂白。答案:A
二氧化硫与二氧化碳性质的异同
如何检验SO2气体中是否混有CO2气体?探究提示将气体先通过酸性KMnO4溶液,再通入品红溶液中,最后通入澄清石灰水,若有白色沉淀产生,说明混有CO2。
二氧化硫与二氧化碳的性质比较
【例题2】下图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题:(1)B中加入试剂是 ,作用是 。 (2)C中加入试剂是 ,作用是 。 (3)D中加入试剂是 ,作用是 。 (4)实验时,C中应观察到的实验现象是 。
解析:检验二氧化硫用品红溶液,吸收二氧化硫用酸性KMnO4溶液,检验二氧化碳用澄清石灰水;在检验二氧化碳之前,必须除尽二氧化硫,因为二氧化硫也能使澄清石灰水变浑浊。C装置的作用是除去SO2并检验SO2是否除尽,所以酸性高锰酸钾溶液颜色变浅,但不能变成无色,若变成无色不能证明二氧化硫已除尽。答案:(1)品红溶液 检验SO2(2)酸性KMnO4溶液 除去SO2并检验SO2是否除尽(3)澄清石灰水 检验CO2(4)酸性KMnO4溶液的颜色变浅
规律方法点拨由于SO2和CO2都能使澄清石灰水变浑浊,生成白色难溶物CaSO3和CaCO3,所以区别SO2和CO2不能用澄清石灰水。
跟踪训练2下列溶液能够区别SO2和CO2气体的是( )①澄清石灰水 ②H2S溶液 ③酸性KMnO4溶液 ④氯水 ⑤品红溶液A.①②③B.②③④C.②③④⑤D.①②④⑤解析:SO2和CO2都属于酸性氧化物,它们都能与澄清石灰水反应生成不溶性的盐,所以不能利用这一性质来区别SO2和CO2。SO2具有氧化性,能将H2S氧化生成单质硫(有淡黄色沉淀生成);SO2也具有还原性,能被酸性KMnO4溶液和氯水氧化(溶液退色);SO2还具有漂白性,能使品红溶液退色。而CO2没有这些性质。所以可以用②③④⑤来区别SO2和CO2。答案:C
1.下列化合物不能由单质之间直接化合得到的是( )A.FeSD.FeCl3解析:Fe与S、H2与S在加热条件下可以直接化合,分别生成FeS和H2S;铁丝能在Cl2中燃烧生成FeCl3;而S与O2反应只能生成SO2。答案:C
2.实验室常用热的NaOH溶液洗去试管壁上沾有的硫黄,该反应的化学方程式为6NaOH+3S 2Na2S+Na2SO3+3H2O,此反应中硫表现的性质是( )A.氧化性B.还原性C.既无氧化性又无还原性D.既有氧化性又有还原性解析:在该反应中,一部分S化合价降低生成Na2S,表现氧化性;另一部分S化合价升高生成Na2SO3,表现还原性。答案:D
3.下列化合物中,不能由组成该化合物的两种元素的单质直接化合而成的是( )A.CuSB.SO2C.FeSD.Na2S解析:S的氧化性比Cl2的弱,因此多价态的金属与S反应生成其低价态硫化物,与Cl2反应生成其高价态氯化物。S与Cu、Fe和Na反应分别生成Cu2S、FeS和Na2S,S与O2直接化合只能生成SO2。答案:A
4.下列实验报告记录的实验现象正确的是( )
5.已知盐酸加到品红溶液中,能使品红溶液的红色加深。试推测:(1)向品红溶液中通入过量SO2的过程中的现象为 ;加热后的现象为 。 (2)向品红溶液中通入过量Cl2的过程中,观察到的现象为 ;加热后的现象为 。 (3)向品红溶液中通入物质的量之比为1∶1且足量的SO2和Cl2后现象为 。
高中化学鲁科版必修1第4节 海水中的化学元素备课课件ppt: 这是一份高中化学鲁科版必修1第4节 海水中的化学元素备课课件ppt,共33页。PPT课件主要包含了自主阅读,自主检测,3碘的特性,问题探究,知识点拨,典例引领,探究一,探究二,例题1,答案A等内容,欢迎下载使用。
高中化学鲁科版必修1第4节 海水中的化学元素评课课件ppt: 这是一份高中化学鲁科版必修1第4节 海水中的化学元素评课课件ppt,共33页。PPT课件主要包含了自主阅读,自主检测,2化学性质,问题探究,知识点拨,典例引领,探究一,探究二,海水提镁,海水提镁的方法等内容,欢迎下载使用。
高中化学鲁科版必修1第3节 硫的转化课堂教学ppt课件: 这是一份高中化学鲁科版必修1第3节 硫的转化课堂教学ppt课件,共36页。PPT课件主要包含了自主阅读,自主检测,问题探究,知识点拨,典例引领,探究一,探究二,答案C,探究提示等内容,欢迎下载使用。














