
人教版 (新课标)必修2第二节 元素周期律当堂达标检测题
展开目标导航] 1.了解原子的核外电子能量高低与分层排布的关系。2.了解核外电子分层排布的规律。3.了解元素的原子结构和元素性质的周期性变化。4.理解元素周期律的内容和实质。
一、原子核外电子的排布
1.核外电子的分层排布
在多电子的原子里,电子的能量并不相同。能量低的,通常在离核近的区域运动;能量高的,通常在离核远的区域运动。核外电子的分层运动,又叫核外电子的分层排布。其关系如下:
2.原子核外电子的排布规律
3.(1)原子(离子)结构的表示方法,如下所示:
(2)原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者则不相等。如:
Na+;Cl-。
阳离子:核外电子数小于核电荷数。
阴离子:核外电子数大于核电荷数。
点拨 (1)电子层实质上是一个“区域”,或者说是一个“空间范围”,它与宏观上层的含义完全不同。
(2)核外电子排布的规律是互相联系的,不能孤立地理解。如钙原子由于受最外层电子数不超过8个的限制。其原子结构示意图为而不应该是。
议一议
判断正误,正确的打“√”,错误的打“×”
(1)锂的原子结构示意图是( )
(2)某原子M层电子数为L层电子数的4倍( )
(3)某离子M层和L层电子数均为K层的4倍( )
(4)离子的核电荷数一定等于其核外电子数( )
答案 (1)× (2)× (3)√ (4)×
二、元素周期律
1.原子结构的周期性变化
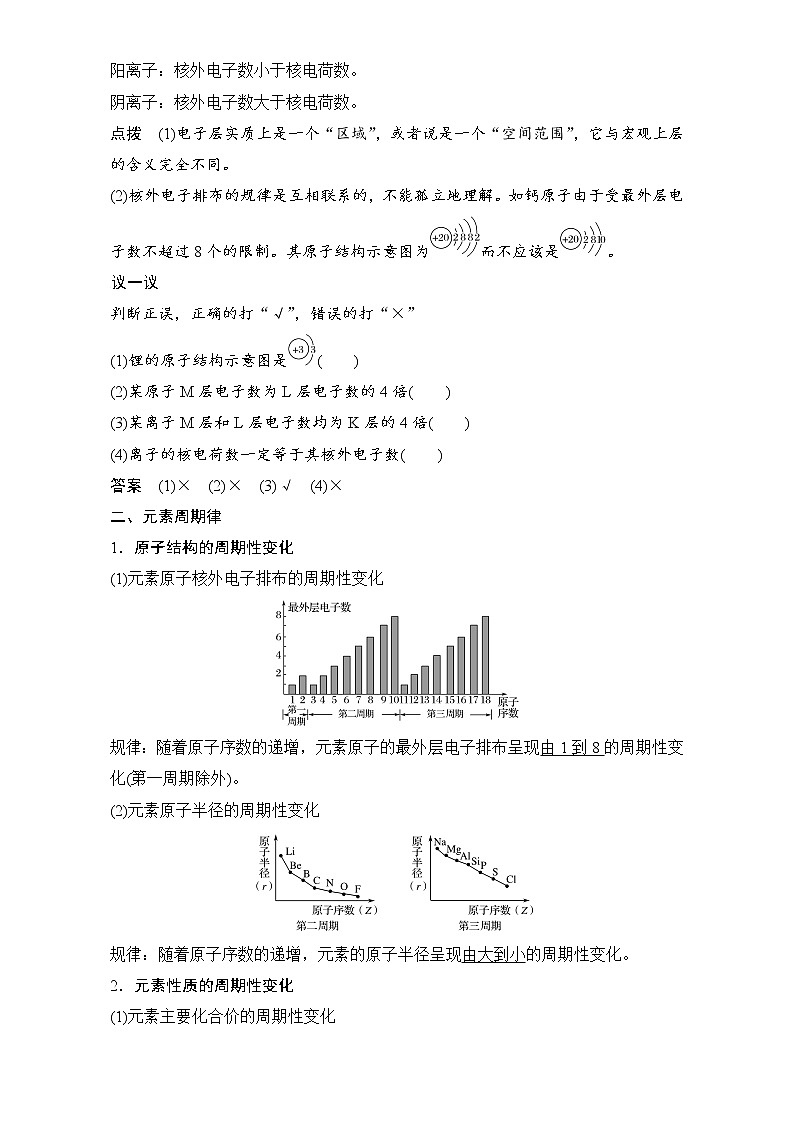
(1)元素原子核外电子排布的周期性变化
规律:随着原子序数的递增,元素原子的最外层电子排布呈现由1到8的周期性变化(第一周期除外)。
(2)元素原子半径的周期性变化
规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
2.元素性质的周期性变化
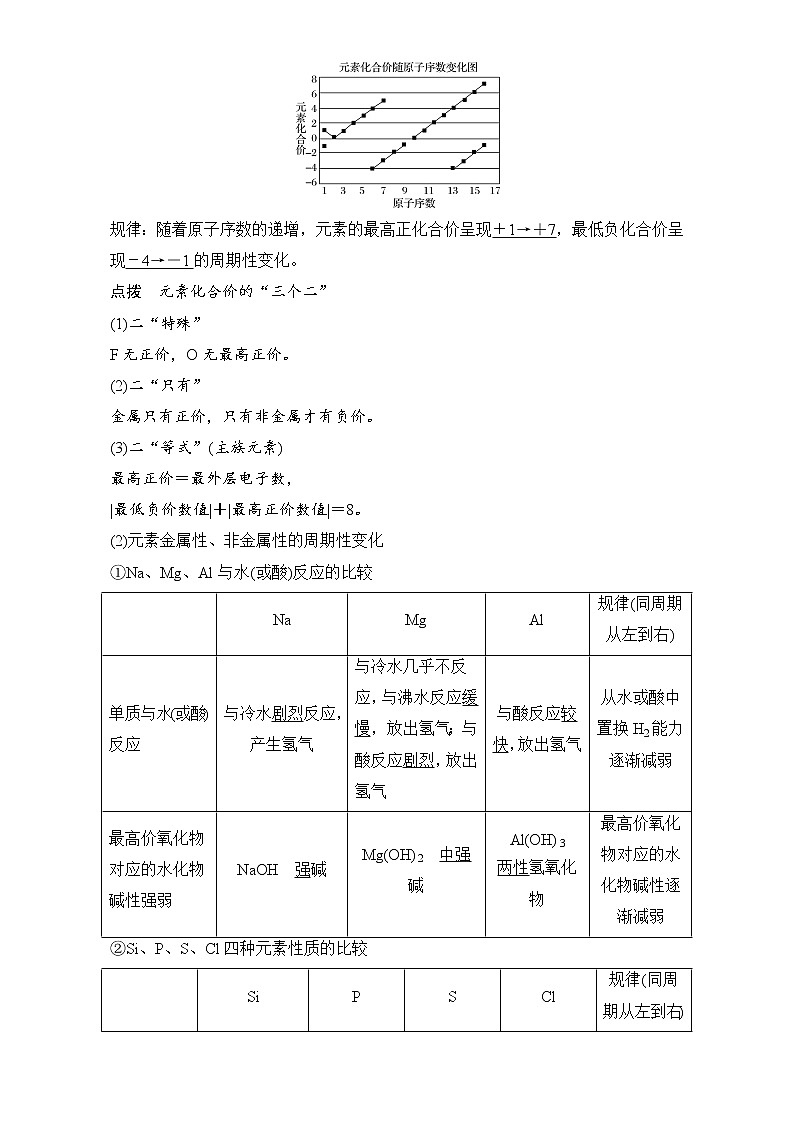
(1)元素主要化合价的周期性变化
规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。
点拨 元素化合价的“三个二”
(1)二“特殊”
F无正价,O无最高正价。
(2)二“只有”
金属只有正价,只有非金属才有负价。
(3)二“等式”(主族元素)
最高正价=最外层电子数,
|最低负价数值|+|最高正价数值|=8。
(2)元素金属性、非金属性的周期性变化
①Na、Mg、Al与水(或酸)反应的比较
②Si、P、S、Cl四种元素性质的比较
结论:随着原子序数的递增,元素的金属性、非金属性呈现周期性的变化。
eq \(――→,\s\up7(Na Mg Al Si P S Cl),\s\d5( 金属性减弱, 非金属性增强))
3.元素周期律
内容:元素的性质随着原子序数的递增而呈现周期性变化的规律。
实质:元素周期律是核外电子排布发生周期性变化的必然结果。
点拨 (1)元素的性质包括:原子半径、元素的主要化合价、金属性、非金属性等。
(2)物质的性质:
物理性质:颜色、状态、气味、挥发性、溶解性、密度、硬度、熔沸点、导电性、延展性等。
化学性质:氧化性、还原性、稳定性、酸性、碱性等。
议一议
在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是________(填元素符号)。
(2)金属性最强的元素是________(填元素符号)。
(3)最高价氧化物对应水化物酸性最强的是________(用化学式回答,下同)。
(4)最不稳定的气态氢化物是________。
(5)最高价氧化物对应水化物碱性最强的是________。
(6)氧化物中具有两性的是________。
答案 (1)Cl (2)Na (3)HClO4 (4)SiH4
(5)NaOH (6)Al2O3
解析 (1)第三周期元素从左到右原子半径逐渐减小,原子半径最小的是Cl。
(2)金属性最强的元素在最左边,应为Na。
(3)非金属性最强的元素,其最高价氧化物对应水化物的酸性最强,氯的非金属性最强,其对应的酸是HClO4。
(4)非金属性最弱的元素Si的气态氢化物最不稳定。
(5)金属性最强的Na对应的NaOH的碱性最强。
(6)铝的氧化物Al2O3具有两性。
一、原子核外电子排布规律的应用
例1 已知A、B、C三种元素的原子中,质子数为A
A________,B________,C________。
(2)画出三种元素的原子结构示意图:
A________,B________,C________。
解析 由A元素的原子最外层电子数是次外层电子数的2倍,可知A是碳元素;B元素的原子核外M层电子数是L层电子数的一半,可知B为硅元素;C元素的原子次外层电子数比最外层电子数多1个,可知C应为氯元素。
答案 (1)碳C 硅Si 氯Cl
(2)
归纳总结
1.确定元素的种类
根据原子核外电子排布的某些特点可以确定元素的种类,注意1~20号元素原子结构的特殊关系。
2.推断元素的性质
特别提醒 (1)通常把最外层有8个电子(K层为最外层时电子数是2个)的结构,称为相对稳定结构。稀有气体的原子就是上述结构,一般不与其他物质发生化学反应。当元素的原子最外层电子数小于8(K层小于2)时是不稳定结构。在化学反应中,不稳定结构总是通过各种方式(如得失电子、共用电子等)趋向达到相对稳定结构。
(2)过渡元素原子最外层电子数不超过2个,若原子最外层有n个电子:
①n=1,位于第ⅠA族或过渡元素区。
②n=2,位于第ⅡA族、0族或过渡元素区。
③n≥3时,则一定位于第n主族(n=8时,位于0族)。
变式训练1 短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
A.C>D>B>A B.D>B>A>C
C.A>D>C>B D.B>A>C>D
答案 A
解析 A元素原子的次外层电子数只能是2,最外层电子数是4,A的原子序数为6;B元素的内层电子总数只能是2,最外层电子数为6,B的原子序数为8;C元素原子有3个电子层,L层必有8个电子,M层有4个电子,C的原子序数为14;D的阳离子与B的阴离子(即O2-)电子层结构相同,D为Na,原子序数为11;故原子序数:C>D>B>A。
二、元素周期律
例2 已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
A.气态氢化物的稳定性:HX>H2Y>ZH3
B.非金属活泼性:Y<X<Z
C.原子半径:X>Y>Z
D.原子最外层电子数:X
答案 A
归纳总结
1.元素周期表中元素(主族元素)及其单质和化合物性质的变化规律
2.元素的金属性、非金属性强弱判断规律
(1)金属性强弱的判断依据
①元素的单质与水或酸置换出氢气的反应越容易进行,则其金属性越强。
②元素的最高价氧化物的水化物的碱性越强,则其金属性越强。
③金属元素的单质与盐在水溶液中进行置换反应,若A能置换出B,则A的金属性强于B。
④在金属活动性顺序表中,前面的金属性强于后面的金属性。
⑤金属阳离子的氧化性越强,则其单质的还原性越弱,元素的金属性越弱(注:Fe的阳离子仅指Fe2+)。
(2)非金属性强弱的判断依据
①非金属元素的单质与氢气化合生成气态氢化物的反应越容易进行,则其非金属性越强。
②非金属元素气态氢化物的稳定性越强,则元素的非金属性越强。
③元素的最高价氧化物的水化物的酸性越强,则其非金属性越强。
④非金属元素的单质与盐在水溶液中进行置换反应,若A能置换出B,并且A体现出氧化性,则A的非金属性强于B。
⑤非金属阴离子的还原性越强,则其单质的氧化性越弱,元素的非金属性越弱。
变式训练2 X、Y两元素是同周期的非金属主族元素,如果X原子半径比Y的大,下面说法正确的是( )
A.最高价氧化物对应水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
答案 C
解析 X原子半径比Y的大,说明X在Y的左边,原子序数X比Y小,X的非金属性比Y的弱,因此最高价氧化物对应水化物的酸性X比Y的弱,X的阴离子比Y的阴离子还原性强,X的气态氢化物不如Y的稳定。
三、微粒半径大小的比较——“四同”规律
例3 下列微粒半径大小的比较中,正确的是( )
A.Na+<Mg2+<Al3+<O2-
B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S
D.Cs<Rb<K<Na
解析 四种离子核外电子数相同,随着核电荷数的增多,离子半径依次减小,即微粒半径:Al3+<Mg2+<Na+<O2-,A项错;因S2-、Cl-比Na+、Al3+多一个电子层,则S2-、Cl-半径比Na+、Al3+大,再根据“序小径大”的规则,则微粒半径:S2->Cl->Na+>Al3+,B项正确;Na、Mg、Al、S的原子半径依次减小,C项错;Na、K、Rb、Cs最外层电子数相同,电子层数依次增多,半径依次增大,D项错。
答案 B
规律总结 粒子半径大小的比较——“四同”规律
(1)同周期——“序大径小”
①规律:同周期,从左往右,原子半径逐渐减小。
②举例:第三周期中:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
(2)同主族——“序大径大”
①规律:同主族,从上到下,原子(或离子)半径逐渐增大。
②举例:碱金属:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs),r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)。
(3)同元素
①同种元素的原子和离子半径比较——“阴大阳小”。
某原子与其离子半径比较,其阴离子半径大于该原子半径,阳离子半径小于该原子半径。
如:r(Na+)<r(Na);r(Cl-)>r(Cl)。
②同种元素不同价态的阳离子半径比较规律——“数大径小”。
带电荷数越多,粒子半径越小。
如:r(Fe3+)<r(Fe2+)<r(Fe)。
(4)同结构——“序大径小”
①规律:电子层结构相同的离子,核电荷数越大,离子半径越小。
②举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
特别提醒 所带电荷、电子层均不同的离子可选一种离子参照比较。例:比较r(Mg2+)与r(K+)可选r(Na+)为参照,可知r(K+)>r(Na+)>r(Mg2+)。
变式训练3 已知下列原子的半径:
根据以上数据,P原子的半径可能是( )
A.1.10×10-10 m B.0.80×10-10 m
C.1.20×10-10 m D.0.70×10-10 m
答案 A
解析 根据元素周期律可知,磷原子的半径应在Si和S原子之间,故答案为选项A。
1.下图微粒的结构示意图,正确的是( )
答案 A
解析 B中微粒结构示意图是Cl-而不是Cl,C中Ar的原子结构示意图应为,D中K的原子结构示意图应为。
2.下列比较中正确的是( )
A.原子半径:Na>Mg
B.碱性:NaOH>KOH
C.结合H+的能力:COeq \\al(2-,3)
解析 同周期从左到右原子半径依次减小,则原子半径为Na>Mg,A正确;金属元素的金属性越强,对应最高价氧化物水化物的碱性越强,金属性:K>Na,则碱性:KOH>NaOH,B错误;酸性越强,对应酸的酸根离子结合氢离子的能力越弱,酸性:H2CO3
3.下列有关原子结构、元素性质的说法正确的是( )
A.Si、P、S、Cl元素的单质与氢气化合越来越容易
B.元素原子最外层电子数越多,元素金属性越强
C.元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族
D.F-、O2-、Mg2+、Na+离子半径逐渐减小
答案 A
解析 Si、P、S、Cl为同周期元素非金属性依次增强,单质与氢气化合越来越容易,A正确;元素原子最外层电子数越多,失去电子能力越弱,金属性越弱,B错误;元素周期表共有18列,第3列是第ⅢB族,第17列是第ⅦA族,C错误;F-、O2-、Mg2+、Na+离子具有相同的电子数,离子半径O2-、F-、Na+、Mg2+逐渐减小,D错误。
4.已知33As、35Br位于同一周期。下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4
答案 C
解析 同一周期原子半径从左到右依次减小,A选项中P的原子半径大于Cl,A错;非金属性越强,其气态氢化物越稳定,其最高价氧化物对应的水化物酸性越强,故B选项中热稳定性:HCl>HBr>AsH3,D选项中酸性:H2SO4>H3PO4>H3AsO4,B、D均错;S和Cl处于同一周期,故还原性:S2->Cl-,而As和Se处于同一周期,还原性:As3->Se2-,而S和Se又处于同一主族,还原性:Se2->S2-,故C正确。
5.原子序数为11~17号的元素,随核电荷数的递增,以下各项内容的变化是填“增大(强)”、“减小(弱)”或“相同(不变)”]
(1)各元素的原子半径依次________,其原因是_________________________________
________________________________________________________________________。
(2)各元素原子的电子层数________,最外层电子数依次________。
(3)元素的金属性逐渐________,而非金属性逐渐________,元素失电子能力逐渐________,得电子能力逐渐________。
答案 (1)减小 电子层数相同时,随核电荷数增大,原子核对最外层电子的引力增大,因此原子半径减小
(2)相同 增大 (3)减弱 增强 减弱 增强
解析 原子序数为11~17号的元素,在元素周期表中位于第三周期,根据同周期元素的原子结构和性质的变化,可解答本题。
基础过关]
题组1 原子核外电子的排布
1.下列有关主族元素的说法中肯定错误的是( )
A.某原子K层上只有一个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
答案 B
解析 K、L、M电子层上最多容纳的电子数分别为2、8、18;K层上可排1个电子,也可排2个电子,A有可能;当M层上排有电子时,L层上一定排满8个电子,而M层上最多只能排18个电子,又18<8×4,B一定是错误的;K层上最多只能排2个电子,2×4=8,即M层和L层都为8个电子的离子结构示意图为,K+、Ca2+等均有可能;最外层电子数可为2或8,核电荷数与最外层电子数相等,可有两种情况,一种是均为2,但这种情况只能是原子,另一种是均为8,核电荷数为8的元素为氧,氧离子的最外层电子数也为8,D有可能。
2.根据下图微粒结构示意图的共同特征,可以把三种微粒、、归为一类,下列微粒中也可以归为这一类的是( )
A. B.
C. D.
答案 C
题组2 元素周期律及其应用
3.短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
A.原子序数A>B B.电子总数A->B2+
C.离子半径A->B2+ D.原子半径A>B
答案 C
4.下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
答案 D
解析 根据原子半径的递变规律,X为O,Y为Na,Z为Al,M为Si,N为Cl。离子半径:Cl->Al3+,A错误;沸点:H2O>HCl,B错误;SiO2既能与HF反应,也能与NaOH溶液反应,C错误;Al2O3是两性氧化物,既可以和NaOH溶液反应,又能与盐酸反应,D正确。
5.运用元素周期律分析下面的推断,其中推断错误的是( )
A.氢氧化铍Be(OH)2]的碱性比氢氧化镁弱
B.砹(At)为有色固体,HAt不稳定
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
答案 D
解析 Be和Mg同主族,金属性不如镁的强,故Be(OH)2的碱性比Mg(OH)2弱,A正确;卤族元素的单质从上到下,颜色加深,氢化物越来越不稳定,B正确;Sr和Ba同主族,化学性质相似,故SrSO4也难溶于水,C正确;Se的非金属性不如S强,故H2Se不如H2S稳定,D错误。
6.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6价
D.若X的最高正化合价为+5价,则五种元素都是非金属元素
答案 B
解析 同一短周期元素,随着原子序数的递增,元素的金属性依次减弱,形成的最高价氧化物对应的水化物的碱性依次减弱,A错;X元素的氧化物对应的水化物HnXOm是强酸,说明X是活泼性非金属,而Y和X在同一周期且位于X的右边,Y的非金属性比X的非金属性更强,B正确;当Y为氧时,Z为氟,氟没有正价,当Y为硫时,Z为氯,氯的最高正价为+7价,C错;当Y为第三周期时,X为磷,R为铝,铝是金属元素,D错。
题组3 “位、构、性”关系考查
7.A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。A和B分别是( )
A.硅原子和钠原子 B.硼原子和氦原子
C.氯原子和碳原子 D.碳原子和铝原子
答案 D
解析 设x、y分别为A的L层和M层的电子数。依题意有
由于B的M层上有电子,故其L层肯定充满电子,2x=8,x=4。由于A的L层未充满电子,故其M层无电子,y=0。所以A、B的核外电子数分别为6、13,是碳原子和铝原子。
8.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
A.氢化物的沸点为H2T
D.L2+与R2-的核外电子数相等
答案 C
解析 由信息表中的原子半径和主要化合价可以判断出T为O,R为S,Q为Be,M为Al,L为Mg。H2O的沸点比H2S的沸点高,Mg的金属性比Be强,Al2O3是两性氧化物,Mg2+、S2-的核外电子数分别为10、18。
9.A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三元素名称:______、______、______。
(2)C在元素周期表中的位置是_______________________________________________。
(3)B的原子结构示意图为________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径:A________(填“>”或“<”)C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:______________________________________。
答案 (1)氮 硫 氟 (2)第二周期ⅦA族
(3) HF H2S
(4)> NH3+HNO3===NH4NO3
解析 据A、B、C在周期表中的位置可知,A、C处于第二周期,B处于第三周期,设B的原子序数为x,则A为x-9,C为x-7,据题意有x-9+x-7=x,则x=16,又由于B原子核内质子数和中子数相等,则B的中子数为16,即为S,那么A为N,C为F。
能力提升]
10.(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________。
(2)已知某粒子的结构示意图为。
试回答:
①当x-y=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称)
________、________、________、________、________。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式________________________________________________________________________。
答案 (1)
(2)①原子 ②氩原子 氯离子 硫离子 钾离子 钙离子 ③Al(OH)3+3H+===Al3++3H2O
解析 (1)设:核电荷数=质子数=a,元素原子的电子层数为x,最外层电子数为y,依题意:a=5x,a=3y,则5x=3y,x=3y/5。因原子的最外层电子数不超过8,即y为1~8的正整数,故仅当y=5,x=3合理,该元素的核电荷数为15。
(2)①当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子。②当y=8时,应为有18个电子的粒子,所以可能为氩原子、氯离子、硫离子、钾离子、钙离子。③y=3时为铝原子、y=7时为氯原子,其最高价氧化物对应的水化物分别为氢氧化铝和高氯酸,反应的离子方程式为Al(OH)3+3H+===Al3++3H2O。
11.下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号分别是__________和__________________________________。
(2)表中最活泼的金属是__________,非金属性最强的元素是__________。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是__________,分别写出该元素的氢氧化物与⑥和⑨最高价氧化物的水化物反应的化学方程式:___________________________________,
________________________________________________________________________。
(4)请设计一个实验,比较⑦⑩单质氧化性的强弱:
________________________________________________________________________。
答案 (1)Si Ar (2)K F
(3)Al 2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O
Al(OH)3+KOH===KAlO2+2H2O
(4)取无色溴化钠的水溶液少许,加入新制氯水,溶液变橙红色
解析 根据周期表中元素的位置可以确定各种元素,如下表所示:
拓展探究]
12.某同学在研究元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究________元素性质递变规律。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液、酚酞溶液等。
仪器:________、________、________、试管夹、胶头滴管、镊子、小刀、玻璃片、砂纸、火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
①________________________________________________________________________;
②________________________________________________________________________;
此实验的结论:______________________________________________
________________________________________________________________________。
(4)请用原子结构的知识简单解释上述实验结论:_______________________________
________________________________________________________________________。
答案 (1)同周期 (2)试管 酒精灯 滤纸
(3)B F A C D E
①Mg+2H2Oeq \(=====,\s\up7(△))Mg(OH)2+H2↑
②Cl2+Na2S===S↓+2NaCl
随着原子序数的递增,同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强
(4)同周期元素从左到右,随着核电荷数的逐渐增加,原子半径逐渐减小,原子核对外层电子束缚能力增强,原子得电子能力逐渐增强,失电子能力逐渐减弱
电子层(n)符号
eq \(\s\up7(1),\s\d5(K)) eq \(\s\up7(2),\s\d5(L)) eq \(\s\up7(3),\s\d5(M)) eq \(\s\up7(4),\s\d5(N)) eq \(\s\up7(5),\s\d5(O)) eq \(\s\up7(6),\s\d5(P)) eq \(\s\up7(7),\s\d5(Q))
离核远近
能量高低
Na
Mg
Al
规律(同周期从左到右)
单质与水(或酸)反应
与冷水剧烈反应,产生氢气
与冷水几乎不反应,与沸水反应缓慢,放出氢气;与酸反应剧烈,放出氢气
与酸反应较快,放出氢气
从水或酸中置换H2能力逐渐减弱
最高价氧化物对应的水化物碱性强弱
NaOH 强碱
Mg(OH)2 中强碱
Al(OH)3
两性氢氧化物
最高价氧化物对应的水化物碱性逐渐减弱
Si
P
S
Cl
规律(同周期从左到右)
单质与氢气反应的条件
高温
磷蒸气与氢气能反应
加热
光照或点燃时发生爆炸而化合
与H2化合能力逐渐增强
形成的气态氢化物的热稳定性
SiH4很不稳定
PH3不稳定
H2S受热分解
HCl稳定
氢化物稳定性逐渐增强
最高价氧化物对应的水化物(含氧酸)酸性强弱
H2SiO3弱酸
H3PO4中强酸
H2SO4强酸
HClO4强酸(比H2SO4酸性强)
最高价氧化物对应的水化物酸性逐渐增强
特殊关系
元素
最外层电子数等于次外层电子数的一半
Li、Si
最外层电子数等于次外层电子数
Be、Ar
最外层电子数等于次外层电子数的2倍
C
最外层电子数等于次外层电子数的3倍
O
最外层电子数等于次外层电子数的4倍
Ne
最外层电子数等于电子层数
H、Be、Al
最外层有1个电子
H、Li、Na、K
最外层有2个电子
He、Be、Mg、Ca
内层电子数之和是最外层电子数2倍的元素
Li、P
电子总数为最外层电子数2倍的元素
Be
元素
最外层
电子数
得失电
子能力
化学性质
主要
化合价
稀有气体元素
8(He为2)
一般不易
得失电子
较稳定,一般不参与化学反应
金属元素
<4
易失电子
金属性
只有正价,一般是+1→+3
非金属元素
≥4
易得电子
非金属性
既有正价
又有负价
项目
同周期(左→右)
同主族(上→下)
原
子
结
构
核电荷数
逐渐增大
逐渐增大
电子层数
相同
增多
最外层电子数
增多
相同
原子半径
逐渐减小
逐渐增大
元素的化合价
最高正价:+1→+7
负价数=族序数-8
最高正价(O、F除外)、负价数相同,最高正价=族序数
金属性
减弱
增强
非金属性
增强
减弱
原子
N
S
O
Si
半径r/10-10 m
0.75
1.02
0.74
1.17
K
L
M
A
2
x
y
B
2
2x
y+3
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.089
0.102
0.074
主要化合价
+2
+3
+2
+6、-2
-2
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
4
⑨
⑩
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
①N
②F
3
③Mg
④Al
⑤Si
⑥S
⑦Cl
⑧Ar
4
⑨K
⑩Br
实验步骤
实验现象
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色
②向新制的Na2S溶液中滴加新制的氯水
B.有气体产生,溶液变成浅红色
③将一小块金属钠放入滴有酚酞溶液的冷水中
C.剧烈反应,迅速产生大量无色气体
④将镁条投入稀盐酸中
D.反应不十分剧烈,产生无色气体
⑤将铝条投入稀盐酸中
E.生成白色胶状沉淀,继而沉淀消失
⑥向AlCl3溶液中滴加NaOH溶液至过量
F.生成淡黄色沉淀
实验内容
①
②
③
④
⑤
⑥
实验现象
(填A~F)
高中化学基态原子核外电子的排布规则练习: 这是一份高中化学基态原子核外电子的排布规则练习,共6页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
2022年高中化学必修2暑期练习:1.2.1 原子核外电子的排布元素周期律 Word版含解析: 这是一份2022年高中化学必修2暑期练习:1.2.1 原子核外电子的排布元素周期律 Word版含解析,共19页。试卷主要包含了原子核外电子的排布规律,75等内容,欢迎下载使用。
2022年高中化学必修2暑假同步检测:1.2.1元素周期律+Word版含答案: 这是一份2022年高中化学必修2暑假同步检测:1.2.1元素周期律+Word版含答案,共4页。试卷主要包含了下列说法中正确的是,已知aAn+、bB等内容,欢迎下载使用。













