







所属成套资源:2022~2023学年高中化学人教版(2019)必修二 课件+练习
人教版 (2019)必修 第二册第一节 化学反应与能量变化图文ppt课件
展开
这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化图文ppt课件,文件包含第一节第2课时化学反应与电能pptx、第一节第2课时化学反应与电能docx等2份课件配套教学资源,其中PPT共58页, 欢迎下载使用。
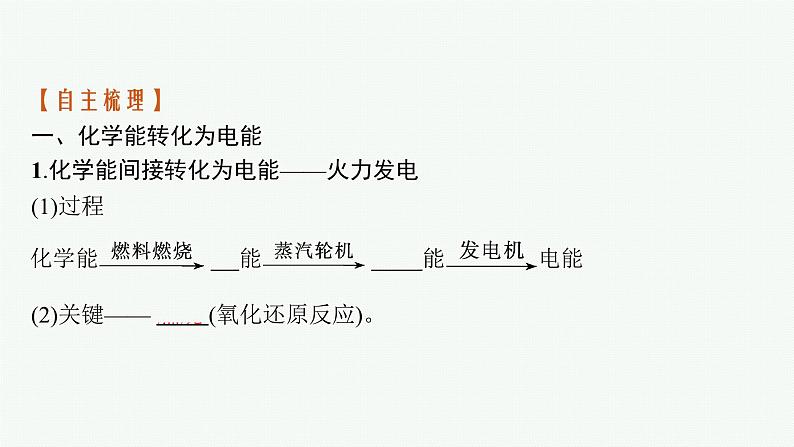
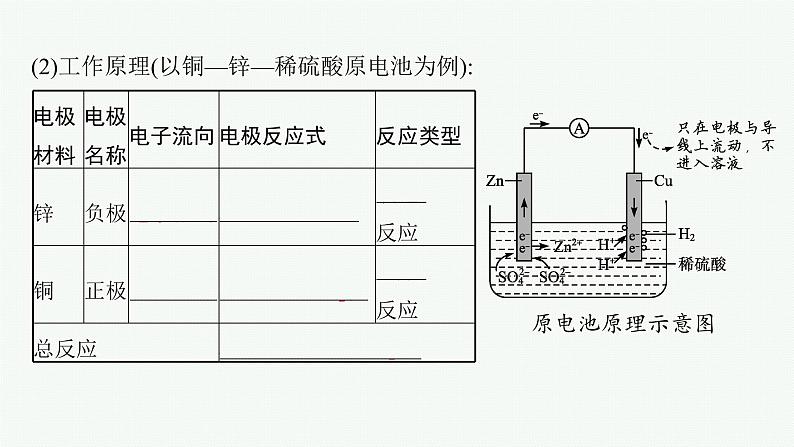
第2课时 化学反应与电能合格考达标练1.(2021山东青岛平度高一期中)如图为番茄电池装置示意图,下列说法正确的是 ( )A.铜片上发生氧化反应B.电子由锌片通过导线流向铜片C.锌片质量减小,发生还原反应D.番茄中的阳离子移向锌片答案B解析番茄汁呈酸性,属于电解质溶液,可以导电;锌片和铜片通过导线连接,插入番茄中形成原电池,由于Zn比Cu活泼,则锌片是负极,失电子发生氧化反应,电极反应式为Zn-2e-Zn2+,生成的Zn2+进入电解质溶液中,故锌片质量减小,C错误。铜片是正极,溶液中H+得电子发生还原反应生成H2,A错误。原电池中,电子由负极流向正极,故电子由锌片通过导线流向铜片,B正确。电解质溶液中阳离子移向正极,故番茄中的阳离子移向铜片,D错误。2.银锌纽扣电池的构造如图所示,其电池反应方程式为Ag2O+Zn+H2O2Ag+Zn(OH)2。下列说法正确的是( ) A.锌粉为正极B.Ag2O发生氧化反应C.电池工作时,电子从锌粉经过KOH溶液流向Ag2OD.正极的电极反应式为Ag2O+H2O+2e-2Ag+2OH-答案D解析由电池总反应可知,Zn发生氧化反应生成Zn(OH)2,则锌粉为负极,A错误;Ag2O为正极,发生还原反应,电极反应式为Ag2O+H2O+2e-2Ag+2OH-,B错误,D正确;电池工作时,电子从锌粉流向Ag2O,但不能经过KOH溶液,C错误。3.为将反应2Al+6H+2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)( )答案B解析A、B、C三项中的装置均能将化学能转化为电能,A项中反应为2Al+2OH-+2H2O2Al+3H2↑,A项错误;B项符合题目的要求,正确;C项中反应为Al和硝酸反应生成NO,故C项达不到目的;D项中两电极全是Al,因而不能构成原电池,即不能将化学能转化为电能。4.如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( ) 选项MNPA锌铜稀硫酸B铜铁稀盐酸C银锌硝酸银溶液D锌铁硝酸铁溶液 答案C解析M棒变粗,N棒变细,说明N棒是负极,金属活动性相对于M棒较强。M棒变粗说明M棒上有金属析出。5.(2021四川成都七中高一检测)下列关于如图所示原电池装置的叙述正确的是( )A.铜片是正极,电极上发生氧化反应B.铜片质量逐渐减少C.电流从锌片经导线流向铜片D.铜离子移向铜片被还原答案D解析Zn比Cu活泼,形成原电池时,铜片是正极,该电极上发生还原反应,A错误;铜片上发生的反应为Cu2++2e-Cu,则铜片质量增加,B错误;锌片是负极,铜片是正极,则电流由铜片经导线流向锌片,C错误;电解质溶液中阳离子移向正极,故Cu2+移向铜片,并得电子被还原为Cu,D正确。6.(2021河南新乡高一期中)X、Y、Z、M、N代表五种金属单质,有以下反应:①Y与M用导线连接放入稀硫酸中,M上冒气泡;②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路流入N极;③Z+2H2O(冷水)Z(OH)2+H2↑;④水溶液中,X+Y2+X2++Y。则这五种金属的活泼性由强到弱的顺序为( )A.Z>X>Y>M>N B.Z>Y>X>M>NC.Z>X>Y>N>M D.X>Y>M>N>Z答案A解析①Y与M用导线连接放入稀硫酸中,形成原电池,M上冒气泡,则M是正极,活泼性:Y>M;②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路流入N极,则M是负极,活泼性:M>N;③Z能与冷水反应生成H2,则Z是非常活泼的金属;④X能置换出Y,则活泼性:X>Y,综上所述,金属的活泼性:Z>X>Y>M>N。7.市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。(1)“热敷袋”放出的热量是利用铁发生 反应放出热量。 (2)炭粉的主要作用是 。 (3)加入氯化钠的主要作用是 。 (4)木屑的作用是 。 答案(1)氧化(2)与铁、NaCl溶液构成原电池,并作为正极,加速铁的氧化(3)溶于水形成电解质溶液(4)让“热敷袋”产生的热量均匀地向外散失、传递解析日常生活中铁生锈过于缓慢,热量的释放也非常缓慢,难以觉察到。倘若提供适当的条件(如电解质溶液、导电且不活泼的固体物质)让铁成为原电池的负极材料,铁的氧化速率就会增大。木屑的作用是让“热敷袋”产生的热量均匀地向外散失、传递。等级考提升练8.某同学用如图所示实验来探究构成原电池的一般条件,下列说法正确的是(提示:苯是非电解质)( )A.左瓶的灯泡发光 B.右瓶的铜棒变粗C.右瓶中铁棒为正极 D.左瓶:Fe-2e-Fe2+答案B解析苯是非电解质,不能导电,Fe和Cu相连插入苯中,不能形成原电池,故左瓶的灯泡不发光,A、D均错误;右瓶中Fe和Cu相连插入CuSO4溶液中,形成原电池,Fe是负极,电极反应式为Fe-2e-Fe2+,Cu是正极,电极反应式为Cu2++2e-Cu,故右瓶的铜棒变粗,B正确,C错误。9.(双选)如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是( )A.外电路的电流方向为X→外电路→YB.若两电极分别为Fe和石墨棒,则X为Fe,Y为石墨棒C.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极材料都是金属,则它们的活动性顺序为X>Y答案BD解析外电路的电子流向与电流方向相反,A项错误;由电子流向可知,X极为负极,Y极为正极,则X应为Fe,Y为石墨棒,B项正确;X极发生氧化反应,Y极发生还原反应,C项错误;X极的金属应比Y极的金属活泼,D项正确。10.某小组为研究电化学原理,设计如图装置。下列叙述正确的是( )A.a和b不连接时,铁片上会有H2产生B.a和b用导线连接时,铁片上发生的反应为Cu2++2e-CuC.a和b用导线连接时,电子由a流向bD.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色答案D解析a和b不连接时,铁和Cu2+发生置换反应而析出铜,没有氢气生成,错误;B项,a和b用导线连接时构成原电池,铁是负极,铁片上发生氧化反应:Fe-2e-Fe2+,错误;C项,Fe比铜活泼,形成原电池时Fe为负极,则电子由b流向a,错误;D项,无论a和b是否连接,铁片均会溶解,都生成亚铁离子,溶液由蓝色变为浅绿色,D正确。11.(双选)(2021山东师大附中高一检测)2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )A.多孔碳材料电极为负极B.锂电极发生氧化反应C.电池工作时,外电路电子由锂电极流向多孔碳材料电极D.正极的电极反应式:O2+4e-+2H2O4OH-答案BC解析多孔碳材料电极是正极,A错误;锂电极是电池的负极,发生氧化反应生成Li+,B正确;电池工作时,外电路中电子由负极流向正极,故外电路电子由锂电极流向多孔碳材料电极,C正确;该电池为非水电解质体系,故正极上O2与Li+在多孔碳材料电极处生成Li2O2-x,D错误。12.如图所示,杠杆A、B两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )A.杠杆不论为导体还是绝缘体,均为A端高B端低B.杠杆不论为导体还是绝缘体,均为A端低B端高C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高答案D解析根据题意,若杠杆为绝缘体,滴入CuSO4溶液后,在铁球表面析出Cu,铁球质量增大,B端下沉;若杠杆为导体,滴入CuSO4溶液后,形成原电池,在铜球表面析出Cu,A端下沉。13.(2021黑龙江哈尔滨三中高一期中)H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述不正确的是( )A.电池工作时,化学能转化为电能和热能B.电极b上发生的电极反应式为O2+4e-+4H+2H2OC.电极a是负极,电池工作时,电子的流动方向:电极a→负载→电极b→质子膜→电极aD.当电路中通过4 mol电子时,有4 mol H+经质子膜进入正极区答案C解析质子膜H2S燃料电池工作时,将化学能转化为电能,部分转化为热能,A正确;由图可知,电极b上O2被还原生成H2O,电极反应式为O2+4e-+4H+2H2O,B正确;电极a上H2S被氧化生成S2,则电极a是负极,电子流向:电极a→负载→电极b,电子不能经过质子膜,C错误;根据电极反应O2+4e-+4H+2H2O可知,通过4 mol电子时,有4 mol H+经质子膜进入正极区,D正确。14.将纯锌片和纯铜片按下图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:(1)下列说法中正确的是 (填序号)。 A.甲、乙均为化学能转变为电能的装置B.乙中铜片上没有明显变化C.甲中铜片质量减小、乙中锌片质量减小D.两烧杯中H+的浓度均减小(2)在相同时间内,两烧杯中产生气泡的速率:甲 乙(填“>”“<”或“=”)。 (3)当甲中产生1.12 L(标准状况)气体时,理论上通过导线的电子数目为 。 (4)当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1。试确定原稀硫酸中c(H2SO4)= 。 答案(1)BD (2)> (3)0.1NA(或6.02×1022)(4)1.0 mol·L-1解析(1)甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,故A项错误;乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故B项正确;甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减小,故C项错误;两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,故D项正确。(2)甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速率:甲>乙。(3)甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-H2↑,根据电极反应式知,当产生1.12 L气体时,通过电子的物质的量=×2=0.1 mol,通过导线的电子数目为0.1NA或6.02×1022。(4)当乙中产生1.12 L(标准状况)即0.05 mol氢气气体时,根据2H+~H2↑,则消耗的氢离子物质的量是0.1 mol,剩余的氢离子的物质的量是0.1 mol,所以原稀硫酸中氢离子的物质的量是0.2 mol,硫酸的物质的量是0.1 mol,原稀硫酸中c(H2SO4)==1.0 mol·L-1。15.(1)原电池原理的应用之一是可以设计原电池装置。请利用反应Cu+2Fe3+2Fe2++Cu2+设计一个原电池,在方框内画出原电池的装置图,标出正、负极,并写出电极反应式。 正极反应: ; 负极反应: 。 若外电路中转移电子的物质的量为1.5 mol,则溶解铜的质量是 。 (2)实验室在用锌与稀硫酸反应制备氢气时,可向反应液中滴加少量硫酸铜溶液,其作用是 ,这体现了原电池原理的另一个应用。 答案(1)2Fe3++2e-2Fe2+ Cu-2e-Cu2+ 48 g(2)形成Zn-Cu原电池,增大化学反应的速率解析(1)分析Fe3+与Cu的反应中的氧化剂、还原剂,然后依据原电池原理,设计原电池装置。依据反应2Fe3++Cu2Fe2++Cu2+,Cu失电子,应为原电池的负极,正极选用石墨棒或铂丝等,电解质溶液选用FeCl3溶液;由转移2 mol电子时溶解64 g铜,可计算出转移1.5 mol电子时溶解铜的质量为48 g。新情境创新练16.镍镉可充电电池在现代生活中有着广泛的应用,它的充、放电反应为Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2。请回答下列问题:(1)放电时,还原反应在 (填“a”或“b”)极进行,负极的电极反应式为 ,在放电过程中,正极附近的电解质溶液碱性会 (填“增强”或“减弱”)。 (2)镍镉废旧电池必须进行回收并集中处理,最主要的原因是 。 答案(1)b Cd-2e-+2OH-Cd(OH)2 增强(2)镍镉废旧电池中残留的Cd2+、Ni2+等重金属离子易对土壤和水源造成污染解析(1)由题给示意图知,镍镉电池中,电流方向是由b极流向a极,故a极为负极,b极为正极;放电时,正极发生反应NiOOH+H2O+e-Ni(OH)2+OH-,是还原反应;镉在负极发生氧化反应,分两步:Cd-2e-Cd2+,Cd2++2OH-Cd(OH)2,负极反应式为Cd-2e-+2OH-Cd(OH)2;正极附近电解质溶液的碱性增强,负极附近电解质溶液的碱性减弱。(2)镍镉废旧电池中残留的Cd2+、Ni2+等重金属离子易对土壤和水源造成污染。
相关课件
这是一份高中化学第六章 化学反应与能量第一节 化学反应与能量变化教课内容课件ppt,共26页。PPT课件主要包含了原电池的工作原理,原电池的构成条件,氧化反应,还原反应,课堂练习等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化完美版ppt课件,共28页。PPT课件主要包含了学习目标,原电池正负极判断,新课导入,火力发电,化学能,燃料燃烧,蒸汽轮机,发电机,机械能,活动研究等内容,欢迎下载使用。
这是一份2020-2021学年第一节 化学反应与能量变化示范课课件ppt,文件包含第一节第1课时化学反应与热能pptx、第一节第1课时化学反应与热能docx等2份课件配套教学资源,其中PPT共53页, 欢迎下载使用。










