




苏教版选修4 化学反应原理第一单元 化学反应速率课文ppt课件
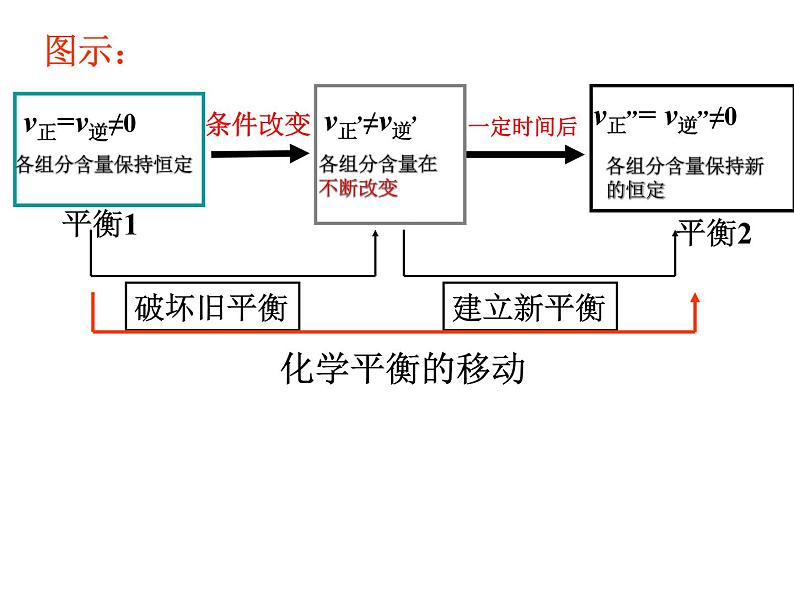
展开回忆:一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
思考:当条件改变,使V正≠ V逆时,会怎样呢?
1、概念:改变外界条件,破坏原有的平衡状态,建立起新的平 衡状态的过程。
3、移动的原因:外界条件发生变化。
平衡向正反应方向移动。
平衡向逆反应方向移动。
2、研究对象: 已达到平衡的可逆反应体系
【思考】 如何通过改变条件来打破旧平衡?
可通过改变影响反应速率的条件来打破原有平衡,建立新平衡。
二、影响化学平衡移动的条件
已知铬酸根和重铬酸根离子间存在如下平衡:
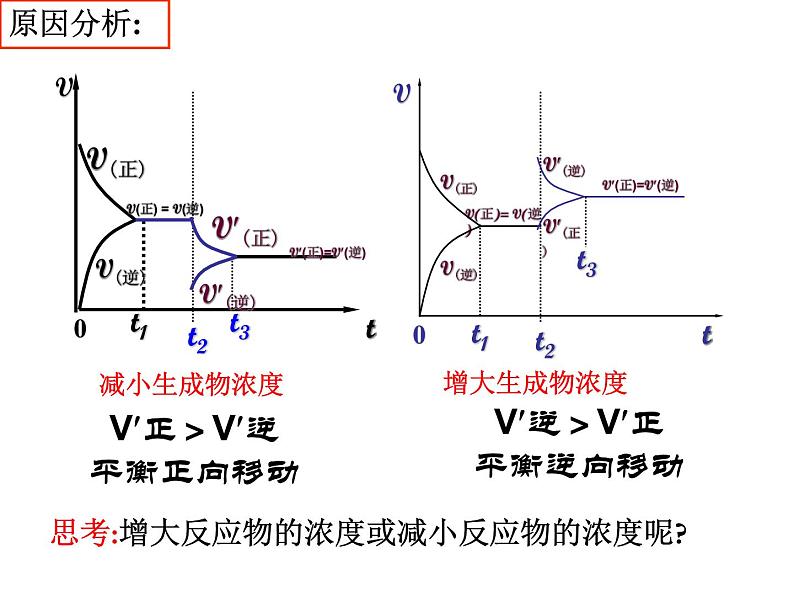
减小生成物浓度,可使化学平衡向正反应方向移动
增大生成物浓度,可使化学平衡向逆反应方向移动
浓度变化对化学平衡的影响
V正>V逆 平衡正向移动
V逆>V正 平衡逆向移动
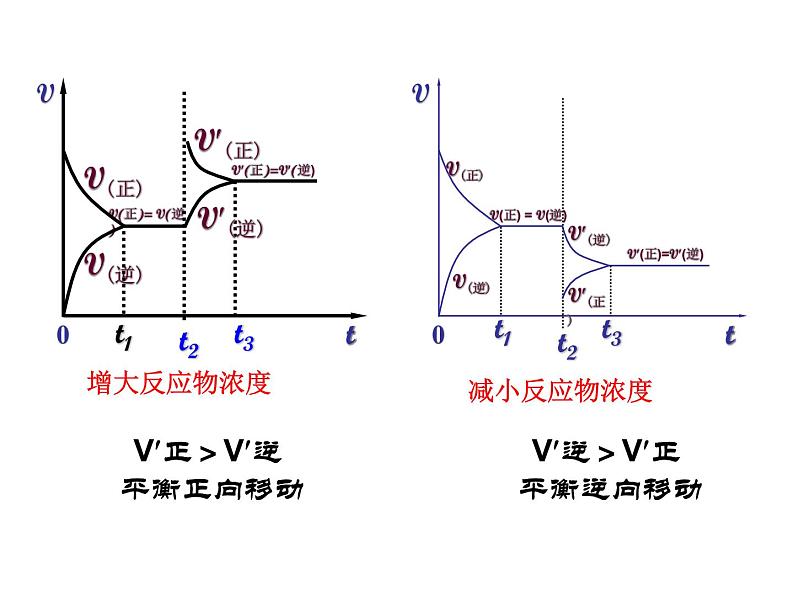
思考:增大反应物的浓度或减小反应物的浓度呢?
结论:其它条件不变的情况下
①增大反应物浓度或减小生成物浓度,平衡向正方向移动
②增大生成物浓度或减小反应物浓度,平衡向逆方向移动
平衡向浓度变化相反的方向移动
1、改变固体或纯液体的用量,对化学平衡无影响。
2、判断平衡移动方向的唯一依据是V正 与 V逆 的相对大小。
V正 > V逆 时 平衡向 方向移动
V正 < V逆 时 平衡向 方向移动
在工业生产中适当增大廉价反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本
1:在新制的氯水中存在平衡:Cl2 + H2O ≒ HCl + HClO;若向氯水中投入少量CaCO3粉末,则: A 平衡不移动。 B平衡向正反应方向移动, Cl2的转化率增大C 平衡移动,且HClO浓度减小 D平衡移动,且HClO浓度增大
2、已知 FeCl3(棕黄)+3KSCN(无色) Fe(SCN)3(血红色)+3KCl,充分反应后,采取下列 措施将会导致混合体系的颜色加深。(1)向混合体系中加入氯化铁固体(2)向混合体系中加入硫酸铁固体(3)向混合体系中加入氯化钠固体(4)向混合体系中加入氯化钾固体(5)向混合体系中加入NH4SCN固体
3、在定温定容的容器中发生N2+3H2 2NH3,当反应达到平衡后,下列措施将会对化学平衡产生什么影响?(填正向移动或逆向移动或不移动)(1)向容器中充氮气 (2)向容器中充氢气(3)向容器中充氨气 (4)向容器中充氦气(5)向容器中充入氯化氢气体
根据图2-19数据,分析压强的改变时如何影响合成氨的平衡的
二、压强对化学平衡的影响
苏教版 (2019)选择性必修1第三单元 化学平衡的移动图文ppt课件: 这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动图文ppt课件,共60页。PPT课件主要包含了图说考点,基础知识,物质组成,过程表示,溶液从橙色变为黄色,正反应,逆反应,向右移动,向左移动,不移动等内容,欢迎下载使用。
苏教版选修4 化学反应原理第三单元 化学平衡的移动课文ppt课件: 这是一份苏教版选修4 化学反应原理第三单元 化学平衡的移动课文ppt课件,共15页。PPT课件主要包含了化学平衡的移动,课时目标,化学平衡状态,化学平衡状态的判断,平衡移动,化学平衡移动,影响移动因素等内容,欢迎下载使用。
2021学年第一单元 化学反应速率图片课件ppt: 这是一份2021学年第一单元 化学反应速率图片课件ppt,共60页。PPT课件主要包含了第2讲,基础再现·深度思考,质量或浓度,反应物,生成物,保持不变,或浓度,化学平衡,浓度幂之积,规律方法·解题指导等内容,欢迎下载使用。













