
贵阳专版中考化学总复习模块1身边的化学物质课时6金属的化学性质精讲习题学案
展开课时6 金属的化学性质
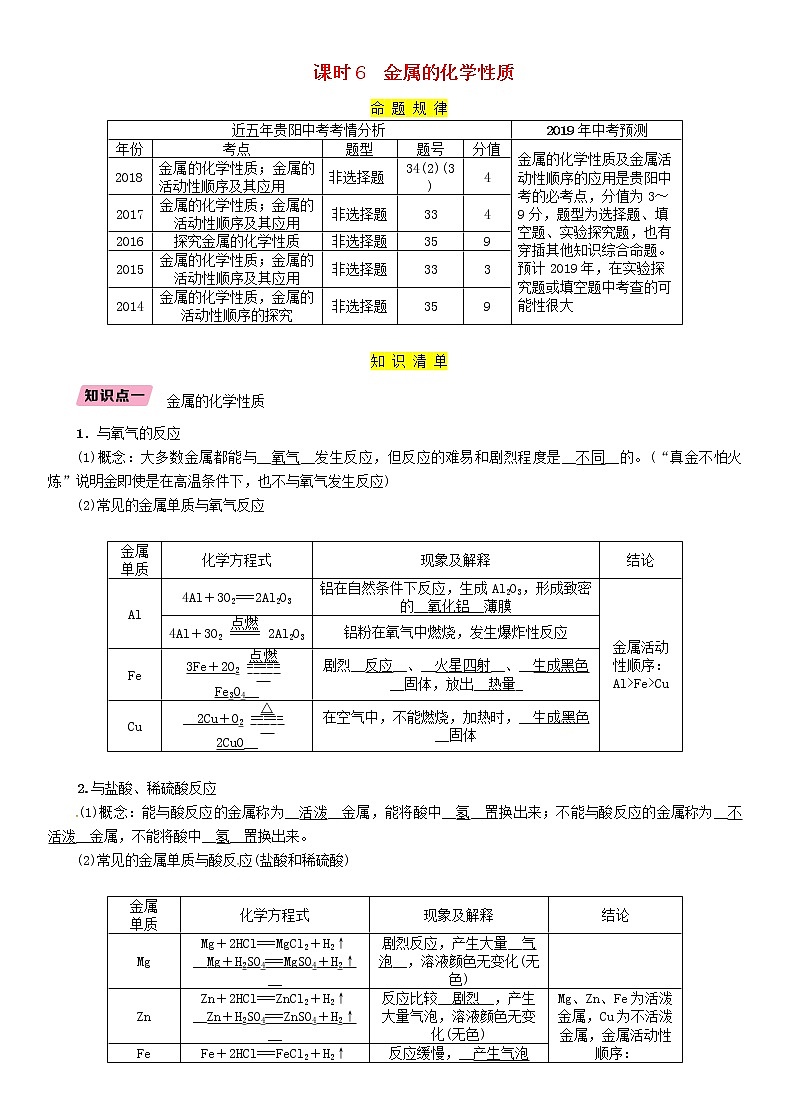
命 题 规 律
近五年贵阳中考考情分析 | 2019年中考预测 | ||||
年份 | 考点 | 题型 | 题号 | 分值 | 金属的化学性质及金属活动性顺序的应用是贵阳中考的必考点,分值为3~9分,题型为选择题、填空题、实验探究题,也有穿插其他知识综合命题。预计2019年,在实验探究题或填空题中考查的可能性很大 |
2018 | 金属的化学性质;金属的活动性顺序及其应用 | 非选择题 | 34(2)(3) | 4 | |
2017 | 金属的化学性质;金属的活动性顺序及其应用 | 非选择题 | 33 | 4 | |
2016 | 探究金属的化学性质 | 非选择题 | 35 | 9 | |
2015 | 金属的化学性质;金属的活动性顺序及其应用 | 非选择题 | 33 | 3 | |
2014 | 金属的化学性质,金属的活动性顺序的探究 | 非选择题 | 35 | 9 | |
知 识 清 单
金属的化学性质
1.与氧气的反应
(1)概念:大多数金属都能与__氧气__发生反应,但反应的难易和剧烈程度是__不同__的。(“真金不怕火炼”说明金即使是在高温条件下,也不与氧气发生反应)
(2)常见的金属单质与氧气反应
金属 单质 | 化学方程式 | 现象及解释 | 结论 |
Al | 4Al+3O2===2Al2O3 | 铝在自然条件下反应,生成Al2O3,形成致密的__氧化铝__薄膜 | 金属活动性顺序:Al>Fe>Cu |
4Al+3O22Al2O3 | 铝粉在氧气中燃烧,发生爆炸性反应 | ||
Fe | 3Fe+2O2Fe3O4__ | 剧烈__反应__、__火星四射__、__生成黑色__固体,放出__热量_ | |
Cu | __2Cu+O22CuO__ | 在空气中,不能燃烧,加热时,__生成黑色__固体 |
2.与盐酸、稀硫酸反应
(1)概念:能与酸反应的金属称为__活泼__金属,能将酸中__氢__置换出来;不能与酸反应的金属称为__不活泼__金属,不能将酸中__氢__置换出来。
(2)常见的金属单质与酸反应(盐酸和稀硫酸)
金属 单质 | 化学方程式 | 现象及解释 | 结论 |
Mg | Mg+2HCl===MgCl2+H2↑ __Mg+H2SO4===MgSO4+H2↑__ | 剧烈反应,产生大量__气泡__,溶液颜色无变化(无色) |
|
Zn | Zn+2HCl===ZnCl2+H2↑ __Zn+H2SO4===ZnSO4+H2↑__ | 反应比较__剧烈__,产生大量气泡,溶液颜色无变化(无色) | Mg、Zn、Fe为活泼金属,Cu为不活泼金属,金属活动性顺序:Mg>Zn>Fe>Cu |
Fe | Fe+2HCl===FeCl2+H2↑ __Fe+H2SO4===FeSO4+H2↑__ | 反应缓慢,__产生气泡__,溶液由无色变为__浅绿色__ | |
Cu | Cu+HCl≠ Cu+H2SO4≠ | 无明显现象,不反应 |
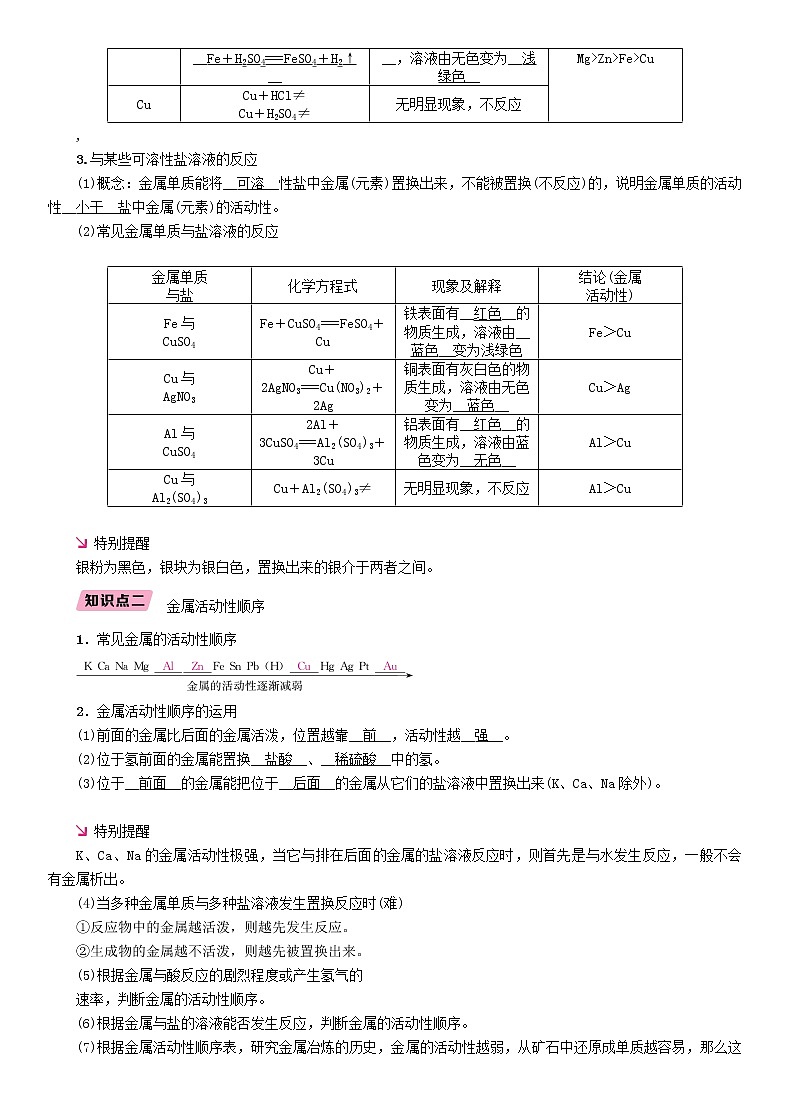
,
3.与某些可溶性盐溶液的反应
(1)概念:金属单质能将__可溶__性盐中金属(元素)置换出来,不能被置换(不反应)的,说明金属单质的活动性__小于__盐中金属(元素)的活动性。
(2)常见金属单质与盐溶液的反应
金属单质 与盐 | 化学方程式 | 现象及解释 | 结论(金属 活动性) |
Fe与 CuSO4 | Fe+CuSO4===FeSO4+Cu | 铁表面有__红色__的物质生成,溶液由__蓝色__变为浅绿色 | Fe>Cu |
Cu与 AgNO3 | Cu+2AgNO3===Cu(NO3)2+2Ag | 铜表面有灰白色的物质生成,溶液由无色变为__蓝色__ | Cu>Ag |
Al与 CuSO4 | 2Al+3CuSO4===Al2(SO4)3+3Cu | 铝表面有__红色__的物质生成,溶液由蓝色变为__无色__ | Al>Cu |
Cu与 Al2(SO4)3 | Cu+Al2(SO4)3≠ | 无明显现象,不反应 | Al>Cu |
特别提醒
银粉为黑色,银块为银白色,置换出来的银介于两者之间。
金属活动性顺序
1.常见金属的活动性顺序
2.金属活动性顺序的运用
(1)前面的金属比后面的金属活泼,位置越靠__前__,活动性越__强__。
(2)位于氢前面的金属能置换__盐酸__、__稀硫酸__中的氢。
(3)位于__前面__的金属能把位于__后面__的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
特别提醒
K、Ca、Na的金属活动性极强,当它与排在后面的金属的盐溶液反应时,则首先是与水发生反应,一般不会有金属析出。
(4)当多种金属单质与多种盐溶液发生置换反应时(难)
①反应物中的金属越活泼,则越先发生反应。
②生成物的金属越不活泼,则越先被置换出来。
(5)根据金属与酸反应的剧烈程度或产生氢气的
速率,判断金属的活动性顺序。
(6)根据金属与盐的溶液能否发生反应,判断金属的活动性顺序。
(7)根据金属活动性顺序表,研究金属冶炼的历史,金属的活动性越弱,从矿石中还原成单质越容易,那么这种金属的冶炼和使用年限越早。
实验突破:金属活动性顺序的探究
1.实验原理:用金属单质与酸、盐溶液能否发生反应来判断。
2.探究方法:探究金属活动性顺序有两种方法。
方法一:金属单质与酸反应判断金属活动性顺序
金属与酸 | 化学方程式 | 现象 | 结论 | 顺序 |
M+HCl | M+2HCl===MCl2+H2↑ | 有气泡 产生 | M在H之前 | M>N |
N+HCl | N+HCl≠ | 无明显 现象 | 不反应,N在H之后 |
方法二:金属单质与盐反应判断金属活动性顺序
金属与盐 | 化学方程式 | 现象 | 结论 | 顺序 |
M+ NCl2 | M+NCl2===MCl2+N | M的表面析出N | M排在N之前 | M>N>Q (两金夹一盐)
|
Q+ NCl2 | Q+NCl2≠ | 无明显现象(不反应) | Q排在N之后 | |
Y+ XSO4 | Y+XSO4===YSO4+X | Y的表面析出X | Y排在X之前 | Z>Y>X (两盐夹一金) |
Y+ZCl2 | Y+ZCl2≠ | 无明显现象(不反应) | Z排在Y之前 |
|
3.比较几种金属的活动性顺序
(1)可以用上述方法二先判断一种金属顺序,再用方法一判断另一种金属的活泼性。也可以将两种方法综合利用。
(2)可以用两盐两金综合判断。
体 验 中 考
金属的化学性质
1.[2018贵阳第34(2)(3)题4分]人类社会发展离不开金属材料。如图是某硬铝的主要成分。
(2)将适量硬铝(已砂纸打磨处理)放入足量稀硫酸中,观察到现象为__固体部分溶解__,反应的化学方程式有__Mg+H2SO4===MgSO4+H2↑,2Al+3H2SO4===Al2(SO4)3+3H2↑__。
(3)将足量硬铝粉末放入硝酸银溶液中,充分反应后,溶液出现蓝色,出现蓝色的原因是__铜和硝酸银反应生成了易溶于水的硝酸铜__,写出此时溶液中溶质成分并说明理由__铜在三种金属中最不活泼,既然铜和硝酸银已经反应,则铝、镁都已经完全反应,因此溶质有硝酸铝、硝酸镁、硝酸铜__。
2.[2017贵阳第33(1)(2)题2分]金属与生活密切相关。阅读下列材料,回答问题。
材料一 合金是人类应用最早的金属材料,如青铜、黄铜(铜、锌合金,外观与黄金极其相似)。合金比组成它的纯金属有更多优良性能,如抗腐蚀性好、硬度大等。
材料二 锂是银白色固体、质软、自然界密度最小的金属,跟水反应生成氢气和氢氧化锂。在电池、航空航天等领域有广泛的用途。
材料三 锂的原子结构示意图及它与钠在周期表中信息如图所示。
(1)一块由黄铜冒充的黄金,检验其真伪发生反应的化学方程式为__Zn+2HCl===ZnCl2+H2↑__。
(2)金属锂与钠有相似的化学性质,其原因是 __原子最外层电子数相同__。
3.(2015贵阳第33题节选2分)人类生产和生活都离不开金属。早在春秋战国时期,我国就开始生产和使用金属。
Ⅲ.铝合金不但用于日常生活,还用于火箭、飞机的制造。某铝合金只含铝和另一种金属X。为确定其成分,在实验室将m g该铝合金投入稀硫酸中,发现合金完全溶解,并生成n g氢气,铝与稀硫酸反应的化学方程式为__2Al+3H2SO4===Al2(SO4)3+3H2↑__。若要确定该合金中金属X的相对原子质量还需要的条件是__合金中铝的质量和金属X的化合价__。
金属的活动性顺序及其应用
4.[2017贵阳第33(3)题2分]将一定量的铜和锌同时投入硝酸银溶液,充分反应后过滤,得到固体和蓝色滤液。由此,能否判断金属活动性: Zn>Cu>Ag,说明理由:__由于溶液呈蓝色,则固体一定无锌。若固体只有金属银,无法判断锌和铜的活动性,则无法判断三种金属的活动性;若固体为银白色的银和红色的铜,溶液中一定有Zn2+__、Cu2+,说明锌可以置换银,铜不能置换锌,银不能置换铜,则说明金属活动性Zn>Cu>Ag__。
金属活动性顺序的探究
5.(2016贵阳第35题9分)化学活动课上同学们对金属的性质及合金的成份进行了探究,请你参与。
(1)取等质量的金属,分别加入足量稀硫酸,完成如表四组实验。
序号 药品 | A | B | C | D |
金属 | 铜粉 | 锌粉 | 锌粉 | 镁粉 |
稀硫酸 | 9.8%硫酸 | 19.6%硫酸 | 9.8%硫酸 | 9.8%硫酸 |
①写出实验中一个反应的化学方程式:__Zn+H2SO4===ZnSO4+H2↑或Mg+H2SO4===MgSO4+H2↑__。
②根据表中__ACD__(填序号)实验,即可判断Mg、Cu、Zn三种金属的活动性顺序。
(2)探究合金的成分,某合金可能由Mg、Cu、Zn、Al四种金属中的两种组成。
【提出问题】合金由哪两种金属组成?
【实验探究】
①取该合金m1 g,在足量氧气中反应,生成固体质量为m2 g,m1与m2的关系如图所示,则(m2-m1) g表示的意义是__参加反应的氧气的质量__。
②再向m2 g的固体中加入稀硫酸,微热,固体全部溶解,得溶液M,继续进行如下实验,补充完成实验内容。
实验操作 | 实验现象 | 结论和化学方程式 |
向M中加入a g铁粉,搅拌 | __溶液由蓝色变为浅绿色,有红色固体析出,并有气体产生 | 化学方程式: __Fe+CuSO4 ===FeSO4+Cu__ Fe+H2SO4===FeSO4+H2↑__ M中的溶质:__CuSO4、H2SO4__
|
过滤,把所得固体洗涤、干燥,称其质量也为a g,并向此固体中加入稀硫酸 | 无明显现象 |
【分析结论】
③若m1=4,m2=7.2,结合上述实验分析,合金的成份是__铜和铝__。
(3)根据上述实验总结金属的化学性质:__金属能与氧气反应,活泼金属能与酸反应,金属还能与某些盐溶液反应__。
6.(2015贵阳第33题1分节选)人类生产和生活都离不开金属。早在春秋战国时期,我国就开始生产和使用金属。
Ⅱ.锰钢是一种合金,可用于高铁建设。若金属活动性:锰>铁。请设计实验加以验证。
实验方案是__将金属锰加入到硫酸亚铁溶液中__(不用描述实验现象)。
重 难 突 破
金属的化学性质
例1 (2018枣庄中考)某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生下列说法正确的是( )
A.滤液中一定含有Zn2+和Fe2+,一定没有Ag+
B.滤液中一定含有Zn2+,一定没有Fe2+和Ag+
C.滤渣中一定含有银,可能含有锌和铁
D.滤渣中一定含有银和铁,可能含有锌
【解题思路】锌比铁活泼,铁比银活泼,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉时,锌先和硝酸银反应,后和硝酸亚铁反应;锌、铁能和稀盐酸反应生成盐和氢气,银不能和稀盐酸反应。滤渣中一定有Ag,溶液中一定没有Ag+,一定有Zn2+,可能有Fe2+,滤渣有三种可能铁、铁和锌、锌。
金属的活动性顺序
例2 有X、Y、Z三种金属它们能发生如下反应:X放入Z的盐溶液中能得到Z,Y放入X的盐溶液中能得到X,Y放入Z的盐溶液中能得到Z,三种金属的活动性顺序由强到弱排列为________。
【解题思路】排在前面的金属可把排在后面的金属从它的盐溶液中置换出来。从活动性上讲:X能置换出Z,说明X比Z强;Y能置换出X,说明Y比X强;Y又能置换出Z说明Y比Z强。
1.(2018咸宁中考)近年来,我国航空、航天、高铁等得到长足发展,跻身世界前列。大飞机C919试飞成功,标志着我国的航空强国梦又迈出了一大步。大飞机使用的化学材料如甲图。请回答:
(1)橡胶属于__合成__(填“金属”或“合成”)材料。
(2)图乙是钛原子结构示意图,则x=__8__;钛元素位于元素周期表第__4__周期。
(3)铁比铝的强度大,但制造飞机却用铝合金而不用铁合金,主要原因是铝比铁的密度小且抗腐蚀性能强。铝具有很好的抗腐蚀性的原因是__4Al+3O2===2Al2O3__(用化学方程式表示)。
2.(2018温州中考)根据金属活动性顺序判断,下列容器与所盛溶液不会发生化学反应的是( B )
A.用铁制容器盛盐酸
B.用铜制容器盛盐酸
C.用铁制容器盛硝酸银溶液
D.用铜制容器盛硝酸银溶液
课 堂 评 价
1.(2018平凉中考)2017年春季,在张献忠沉银现场,考古学家发现了金币、银币、铜币和银锭,还有铁刀、铁矛等兵器,金币银币光亮如初,铁刀铁矛锈迹斑斑。下列说法不正确的是( C )
A.金银铜铁都是重要的金属资源
B.金银的化学性质比铁更稳定
C.自然界中,金、银、铜、铁主要以単质的形式存在
D.可以用银、铁、硫酸铜溶液验证银、铁、铜三种金属的活动性顺序
2.(2018广东中考)2017年冬天,某小伙子为了取暖在卫生间里贴满了“暖宝宝”(该产品的部分说明书为:“暖身更暖心,升温快。发热成分:高纯度铁粉、水、盐……;发热时间: 10 h;平均温度:52 ℃),他把门窗关闭以防暖气泄漏。几分钟后,他失去意识而倒地,幸而被门外的朋友及时救起。请回答:
(1)铁氧化发热,主要生成物的化学式为__Fe2O3__;盐是催化剂,其质量和__化学性质__不变。
(2)该小伙子失去意识并不是温度过高和身体本身的原因,而是__铁与氧气反应,导致室内缺氧__。
3.(2018安徽中考)废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
已知:Sn+SnCl4===2SnCl2
(1)SnCl4中锡元素的化合价是__+4__。
(2)铜的金属活动性比锡的__弱__(填“强”或“弱”),固体A中一定含有的金属元素是__Cu__。
(3)写出步骤②发生反应的化学方程式:__2SnCl2Sn+SnCl4__。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是__避免焚烧塑料产生污染,更加环保__(回答一点即可)。
4.(2018重庆中考B卷)我国自主设计的大型客机成功试飞,首艘国产航母正式下水,标志着我国的合金制造技术取得重大突破。根据所学知识回答问题。
(1)生铁和钢都是铁的合金,其中含碳量较高的是__生铁__。
(2)探究Al与酸的反应前,用砂纸打磨铝条,是为了除去__Al2O3__(填化学式)。
(3)某合金中含有金属钪(Sc)。相同条件下,取相同状态的金属钪和锌分别与相同浓度的盐酸反应,钪产生气泡速率明显更快,则金属活动性Sc__>__(填“>”或“<”)Zn。根据上述结论,下列说法不正确的是__B__(填序号)。
A.将Sc投入CuSO4溶液中有红色物质析出
B.仅用Fe(NO3)2溶液、Sc(NO3)3溶液、Ag能验证钪和铁的活动性强弱
C.仅用Fe、Sc、稀H2SO4溶液能验证钪和铁的活动性强弱
(4)已知Sc与稀盐酸发生置换反应,生成+3价化合物。写出该反应的化学方程式:__2Sc+6HCl===2ScCl3+3H2↑__。
5.化学实验是学习化学的重要方法。请完成下列金属性质的实验。
实验:镁、锌、铁三种金属与酸的反应。
【实验】取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象。
【结论】活泼金属能与酸反应。
【分析】
(1)三个反应的共同特点是__都是置换反应__;写出其中一个反应的化学方程式:__Mg+H2SO4===MgSO4+H2↑(或Zn+H2SO4===ZnSO4+H2↑或Fe+H2SO4===FeSO4+H2↑)__。
(2)若完全反应后,三个反应生成氢气的质量相等,原因是__当三种金属过量,硫酸完全反应时,则生成氢气质量相等;当硫酸过量三种金属完全反应,且质量比为Mg∶Zn∶Fe=24∶65∶56时,根据比例关系,则生成氢气质量相等__。
6.实验室有一包纯净的铁粉,小明为了探究金属的化学性质并测定铁的相对原子质量,设计了如图的实验。
【实验步骤】
①取两份质量同为w g的铁粉,分别置于质量相等的A、B烧杯中。
②向装有铁粉的A烧杯中加入50 g足量的稀硫酸;向装有铁粉的B烧杯中加入50 g足量的硫酸铜溶液。
③充分反应后进行称量。C烧杯和烧杯内物质的总质量为m g,D烧杯和烧杯内物质的总质量为n g。
(1)请写出C烧杯中发生反应的化学方程式:__Fe+H2SO4===FeSO4+H2↑__。通过C烧杯中发生的化学反应,你能得出的结论是__铁能置换出酸中的氢__。
(2)D烧杯中发生反应的化学方程式为__Fe+CuSO4===FeSO4+Cu__。此反应可以证明铁的金属活动性比铜__强__(填“强”或“弱”)。
(3)铁的相对原子质量的表达式为____。
教材基础实验突破五 金属活动性顺序的探究
7.(2018吉林中考)用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为__Al__>(H)>__Cu__;发生反应的基本反应类型是__置换反应__;铝丝使用前需用砂纸打磨的原因是__除去铝表面致密的氧化铝薄膜,防止其影响反应__。
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是__将铜丝浸入硝酸银溶液中__。
8.为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。
方案A | 方案B |
(1)能验证三种金属活动性顺序的方案是__A__(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是__③中产生气泡,②中无现象__。
贵阳专版中考化学总复习模块3物质的化学变化课时12质量守恒定律精讲习题学案: 这是一份贵阳专版中考化学总复习模块3物质的化学变化课时12质量守恒定律精讲习题学案,共6页。
贵阳专版中考化学总复习模块2物质构成的奥秘课时9构成物质的微粒元素精讲习题学案: 这是一份贵阳专版中考化学总复习模块2物质构成的奥秘课时9构成物质的微粒元素精讲习题学案,共8页。
贵阳专版中考化学总复习模块5科学探究课时17常见气体的制取精讲习题学案: 这是一份贵阳专版中考化学总复习模块5科学探究课时17常见气体的制取精讲习题学案,共6页。学案主要包含了解题思路等内容,欢迎下载使用。












