





高中化学第二节 电解池课文课件ppt
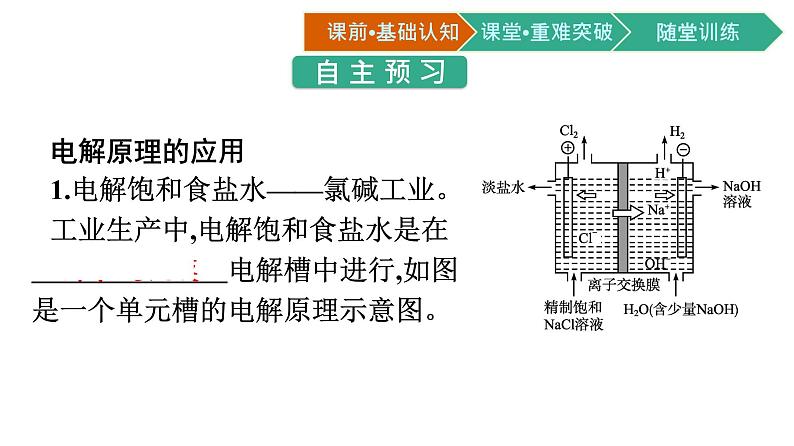
展开电解原理的应用1.电解饱和食盐水——氯碱工业。工业生产中,电解饱和食盐水是在 离子交换膜 电解槽中进行,如图是一个单元槽的电解原理示意图。
微思考1工业上电解饱和食盐水时,若将电解槽中的阳离子交换膜去掉,对产品会有什么影响?提示:阳极产生的Cl2会扩散至阴极区,与阴极产物NaOH反应,降低产率,且使产品不纯。
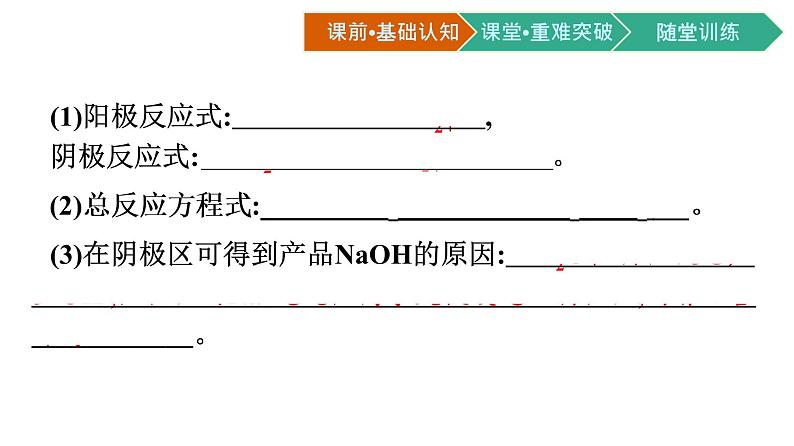
2.电镀。电镀是一种利用 电解 原理在某些金属表面镀上一薄层 其他金属或合金 的加工工艺。如图是在铁钥匙上镀铜的工作示意图,据此回答问题: (1)镀件(钥匙)作 阴 极,镀层金属(铜)作 阳 极,含有 镀层金属离子 (Cu2+)的溶液作电镀液。 (2)阳极上发生的电极反应为 Cu-2e-══Cu2+ ;阴极上发生的电极反应为 Cu2++2e-══Cu 。
微思考2电镀进行一段时间后,电镀液的浓度是如何变化的?提示:因阳极溶解的Cu和阴极析出的Cu的量相等,所以电镀液的浓度基本不变。
3.电解精炼铜。(1)利用电解原理进行电解精炼铜时,以粗铜作 阳 极,以纯铜作 阴 极,通常用 CuSO4溶液 作电解质溶液。 (2)粗铜中含有Zn、Fe、Ni、Ag、Au等杂质金属,其中 Zn、Fe、Ni、Cu 可在阳极放电变成相应的金属离子进入溶液中, Ag、Au 等金属则沉淀在阳极底部形成阳极泥。写出阳极上发生的电极反应: Zn-2e-══Zn2+,Fe-2e-══Fe2+,Ni-2e-══Ni2+,Cu-2e-══Cu2+ ; 写出阴极上发生的电极反应: Cu2++2e-══Cu 。
微思考3电解精炼铜时,当电解进行一段时间后,CuSO4溶液的浓度是如何变化的?提示:阳极除溶解Cu外,还溶解Zn、Fe、Ni等金属,而阴极只析出Cu,所以CuSO4溶液的浓度会减小。
4.电冶金。电解法是冶炼金属的一种重要方法,利用电解法可以冶炼Na、Ca、Mg、Al等活泼金属。用直流电电解熔融NaCl制取金属钠的化学方程式为 2NaCl(熔融) 2Na+Cl2↑ 。阳极反应为 2Cl--2e-══Cl2↑ ;阴极反应为 Na++e-══Na 。
1.判断正误,正确的画“√”,错误的画“×”。(1)用石墨电极电解饱和食盐水,阳极附近生成NaOH。( )(2)利用电解法可以实现Cu+2H+══Cu2++H2↑。( )(3)电镀铜时应将铜连接电源的负极作阴极。( )(4)电解冶炼镁、铝时,通常电解熔融的MgCl2和Al2O3。( )(5)金属铜用热还原法冶炼,所以不能使用电解法冶炼。( )
2.用石墨作电极,电解饱和NaCl溶液,下列叙述正确的是( )。A.电解时在阳极得到氯气B.电解时在阴极得到金属钠C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性答案:A
3.若在铜片上镀银,下列叙述正确的是( )。①将铜片接在电源的正极上②将银片接在电源的正极上③在铜片上发生的反应是Ag++e-══Ag④在银片上发生的反应是4OH--4e-══O2↑+2H2O⑤可以用硫酸铜溶液作电镀液⑥可以用硝酸银溶液作电镀液A.①③⑥ B.②③⑥C.①④⑤ D.②③④⑥答案:B
解析:若在铜片上镀银,铜作阴极与电源负极相连,电解质溶液中的银离子得到电子发生还原反应生成银;银作阳极与电源正极相连,银失电子发生氧化反应生成银离子;电解质溶液为硝酸银溶液。铜片应接在电源的负极上,①错误;将银片接在电源的正极上,②正确;在铜片上发生的反应是Ag++e-══Ag,③正确;铜片上镀银,银为阳极,在银片上发生的反应是Ag-e-══Ag+,④错误;若用硫酸铜溶液作电镀液,阴极析出铜,⑤错误;可以用硝酸银溶液作电镀液,⑥正确。
4.电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液。①电解池中X极上的电极反应式为 。 ②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。 ③该反应的总反应方程式是 。 (2)如要用电解方法精炼粗铜,电解质溶液a选用CuSO4溶液。①X电极的材料是 ,电极反应式是 。 ②Y电极的材料是 ,主要电极反应式是 。
答案:(1)①2H++2e-══H2↑②2Cl--2e-══Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极所在一侧的支管口处,试纸变蓝色③2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2)①精铜 Cu2++2e-══Cu②粗铜 Cu-2e-══Cu2+解析:(1)X为阴极:2H++2e-══H2↑。Y为阳极:2Cl--2e-══ Cl2↑,用湿润的碘化钾淀粉试纸可检验Cl2。(2)精炼铜时,粗铜作阳极,精铜作阴极。
一 电解原理的应用重难归纳1.氯碱工业的生产过程。
2.电镀铜与精炼铜的比较。(电解质溶液均为CuSO4溶液)
(1)甲池、乙池分别是原电池还是电解池?提示:有外接电源,甲池、乙池都是电解池。
(2)若用导线替代外接电源,甲池、乙池分别是原电池还是电解池?提示:甲池符合原电池组成条件,乙池不符合原电池组成条件,甲池是原电池,充当电源,对乙池电解,乙池是电解池(也是电镀池)。
【拓展延伸】 能否用Cu电极来代替Fe电极?请简述理由。
学以致用如图中的A为直流电源,B为浸透氯化钠饱和溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请回答下列问题:
(1)电源A的a为 极。 (2)滤纸B上发生的总反应方程式为 。 (3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为 ,电极f上发生的反应为 ,槽中盛放的电镀液可以是 或 (只要求填两种电解质溶液)。
二 电解的有关计算重难归纳1.计算的原则。(1)阳极失去的电子数等于阴极得到的电子数。(2)串联电路中通过各电解池的电子总数相等。(3)电源输出的电子总数和电解池中转移的电子总数相等。
2.计算的方法。(1)得失电子守恒法计算:用于串联电路、通过阴阳两极的电量相同等类型的计算,其依据是电路上转移的电子数相等。(2)总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。(3)关系式计算:借得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。电解计算时常用的定量关系为4e-~4H+~4OH-~2H2~O2~2Cu ~4Ag。
3.计算的步骤。(1)正确书写电极反应式(要注意阳极材料)。(2)当溶液中有多种离子共存时,要确定放电离子的先后顺序。(3)最后根据得失电子守恒进行相关的计算。
用惰性电极电解100 mL饱和食盐水,生成112 mL氢气(标准状况)时,溶液的pH是多少?提示:设生成NaOH的物质的量为x。2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 21 x 0.005 ml得:x=0.01 ml
典例剖析常温下用惰性电极电解200 mL 氯化钠、硫酸铜的混合溶液,所得气体的体积随时间变化如下图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)(1)曲线 (填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。 (2)氯化钠的物质的量浓度为 ,硫酸铜的物质的量浓度为 。
答案:(1)Ⅱ (2)0.1 ml·L-1 0.1 ml·L-1解析:(1)阴极上Cu2+首先放电,故开始时,阴极上无气体生成,故Ⅱ表示阳极产生气体的变化。
【拓展延伸】 t2时所得溶液的pH是多少?
学以致用1.用惰性电极电解硫酸铜溶液。若阳极上产生气体的物质的量为0.01 ml,阴极无气体逸出,则阴极上析出铜的质量为( )。 g g g答案:B
解析:用惰性电极电解硫酸铜溶液,在阳极产生的气体为氧气,由4OH--4e-══2H2O+O2↑知,产生0.01 ml的氧气转移0.04 ml电子,则根据Cu2++2e-══Cu可推出应析出0.02 ml的铜,其质量为1.28 g。
2.在100 mL H2SO4与CuSO4的混合液中,用石墨作电极电解,两极上均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )。A.1 ml·L-1B.2 ml·L-1C.3 ml·L-1D.4 ml·L-1答案:A
1.工业上电解饱和食盐水的阴极区产物是( )。A.氯气B.氢气和氯气C.氢气和氢氧化钠D.氯气和氢氧化钠答案:C解析:电解食盐水生成三种产物,在阴极区生成氢气和氢氧化钠,在阳极区生成氯气。
2.关于镀铜和电解精炼铜,下列说法中正确的是( )。A.都用粗铜作阳极、纯铜作阴极B.电解质溶液的浓度都保持不变C.阳极反应都只有Cu-2e-══Cu2+D.阴极反应都只有Cu2++2e-══Cu答案:D解析:A项,电镀时镀件作阴极;B项,电解精炼铜时电解质溶液浓度改变;C项,电解精炼铜时,杂质中若有比铜活泼的金属如锌,则还会发生Zn-2e-══Zn2+的反应。
3.下列描述中,不符合生产实际的是( )。A.电解熔融的氧化铝制取金属铝,用铁作阳极B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极D.在镀件上电镀锌,用锌作阳极答案:A
解析:电解池的阳极发生失电子的氧化反应,阴极发生得电子的还原反应。电解熔融的Al2O3制Al时,若用Fe作阳极,会发生反应Fe-2e-══Fe2+,Fe2+移动到阴极上发生反应Fe2++2e-══Fe,使得到的Al不纯。
4.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解氯化钠饱和溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。下列对电极名称和消毒液的主要成分判断正确的是( )。A.a为正极,b为负极,NaClO和NaClB.a为负极,b为正极,NaClO和NaClC.c为阳极,d为阴极,HClO和NaClD.c为阴极,d为阳极,HClO和NaCl答案:B
解析:用石墨作电极电解氯化钠饱和溶液时,在阳极上氯离子失电子生成氯气,在阴极上氢离子得电子生成氢气,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,所以一定要让氯气在d电极产生,所以d电极是阳极,c电极是阴极,故a为负极,b为正极,d极生成的Cl2与c极区的NaOH反应生成NaClO和NaCl。
5.将两个铂电极插入500 mL AgNO3溶液中进行电解,通电一段时间后,某一电极增重0.108 g,若电解时该电极无气体生成,且不考虑离子的水解和溶液体积变化,则此时溶液中氢离子浓度为( )。A.4×10-3 ml·L-1B.2×10-3 ml·L-1C.1×10-3 ml·L-1D.1×10-7 ml·L-1答案:B
6.某同学设计一个燃料电池(如下图所示)用于探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:(1)通入氢气的电极为 (填“正极”或“负极”),该电极反应式为 。 (2)石墨电极为 (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液, (填“铁极”或“石墨极”)区的溶液先变红。 (3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 (填“增大”“减小”或“不变”)。精铜电极上的电极反应式为 。
答案:(1)负极 H2+2OH--2e-══2H2O(2)阳极 铁极(3)减小 Cu2++2e-══Cu
人教版 (2019)选择性必修1第二节 电解池图文课件ppt: 这是一份人教版 (2019)选择性必修1第二节 电解池图文课件ppt,共41页。PPT课件主要包含了拓展延伸,方法技巧等内容,欢迎下载使用。
高中人教版 (2019)第二节 电解池背景图课件ppt: 这是一份高中人教版 (2019)第二节 电解池背景图课件ppt,共43页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
化学选择性必修1第二节 电解池作业课件ppt: 这是一份化学选择性必修1第二节 电解池作业课件ppt,共26页。PPT课件主要包含了逐渐变浅,∶2∶2∶2,AgNO3等内容,欢迎下载使用。













