





化学鲁教版第七单元 常见的酸和碱综合与测试教学演示ppt课件
展开3、掌握酸的通性、碱的通性、酸碱中和反应及其应用
1、掌握盐酸、硫酸的物理性质和化学性质
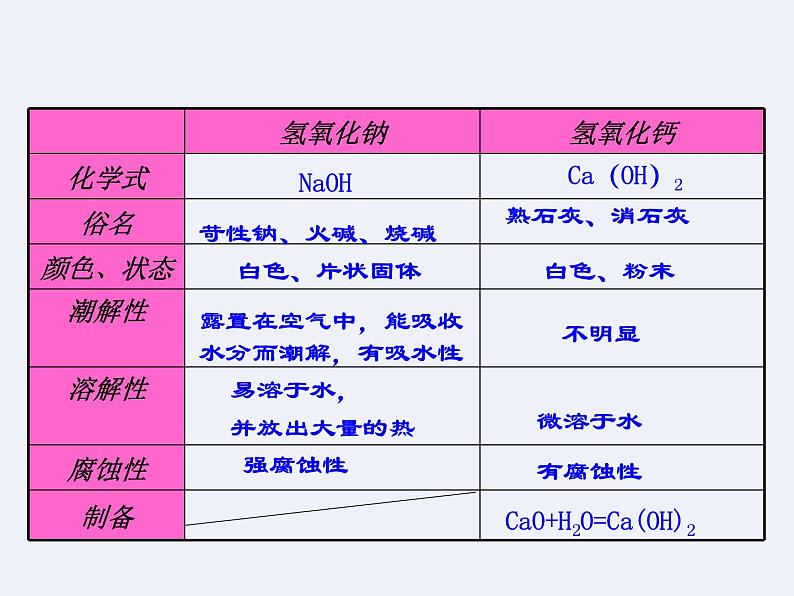
2、掌握氢氧化钠、氢氧化钙物理性质和化学性质
吸水性、脱水性、腐蚀性
固体易潮解; 强腐蚀性
浓盐酸:挥发性、 腐蚀性
H++OH- =H2O
化去氢建工除氧筑原油化业料污钙用
一、常见的酸和碱1.常见的酸有:相应化学式为:常见的碱有:相应化学式:
盐酸、 硫酸、 碳酸、 硝酸、 醋酸 等
氢氧化钠、氢氧化钙、氢氧化钾、氨水等
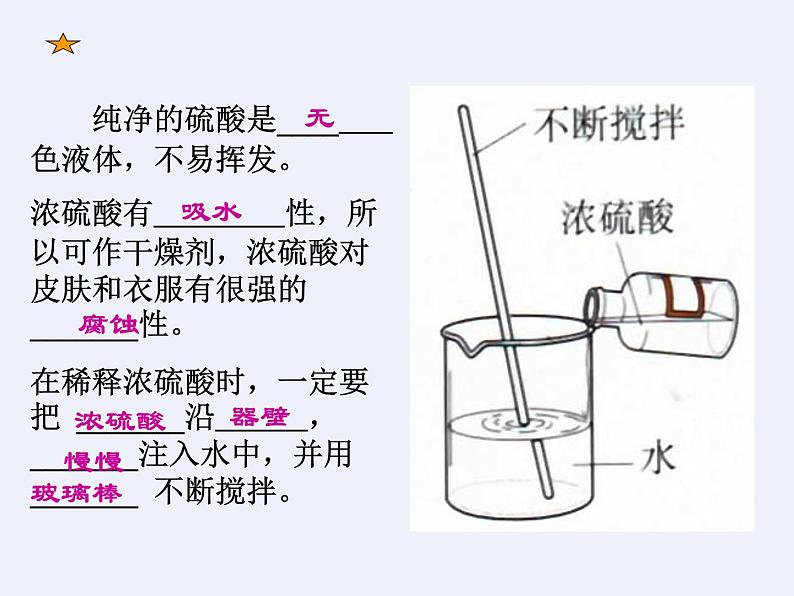
纯净的硫酸是____ 色液体,不易挥发。浓硫酸有 性,所以可作干燥剂,浓硫酸对皮肤和衣服有很强的_______性。在稀释浓硫酸时,一定要把 _______沿 , _______注入水中,并用 _______ 不断搅拌。
浓盐酸是 色液体,有 气味,打开浓盐酸瓶盖,会见到 ,原因是什么?
浓盐酸挥发出的氯化氢气体遇到空气中的水蒸气形成了盐酸小液滴
浓盐酸挥发出了氯化氢气体使浓盐酸中的溶质质量变小。而浓硫酸则吸收了空气中的水蒸气,使溶剂质量变大。
浓盐酸、浓硫酸长期敞口放置在空气中,溶质质量分数将如何变化?为什么?
露置在空气中,能吸收水分而潮解,有吸水性
易溶于水,并放出大量的热
CaO+H2O=Ca(OH)2
(1)酸有一些相似的化学性质,其原因是不同的酸溶液中含有相同的_____。
(2)碱有一些相似的化学性质,其原因是不同的碱溶液中含有相同的_____。
(一)酸和碱有相似化学性质的原因
注意:酸溶液、酸性溶液以及碱溶液、碱性溶液之间的联系和区别
(二)酸和碱的化学性质
1.酸能与指示剂反应。
遇酸溶液变红色,遇碱溶液变蓝色
2.酸能与多种活泼金属反应,生成盐和氢气
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
★注意:金属活动性在H以前
Al分别与这两种酸反应的方程式?
3.酸能与某些金属氧化物反应,生成盐和水。
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
4.酸和碱发生中和反应,生成盐和水。
注意:酸与碱作用生成盐和水的反应,叫中和反应。 H+ + OH – -------- H2O
酸的化学性质1、跟指示剂的反应2、跟金属的反应3、跟金属氧化物的反应4、跟碱的反应5、跟某些盐反应(见后)
2.碱能与某些非金属氧化物反应,生成盐和水。
3.酸和碱发生中和反应,生成盐和水。
碱的化学性质1、跟指示剂的反应2、跟非金属氧化物的反应3、跟酸的反应4、跟某些盐反应(见后)
溶液的酸碱性常用________________来测出.
溶液的酸程度用_____来表示,常用 来测出
pH<7,溶液呈_____性, pH越小,酸性越___pH=7,溶液呈_____性pH>7,溶液呈_____性,pH越大,碱性越____
1.烧开水的铝壶壁上沉积的水垢(主要成分是碳酸钙)可以加入适量的盐酸把它除掉,用化学方程式表示除水垢的原理为_____________________________________盐酸要“适量”的原因用化学方程式表示为__________________________________________________________________________
CaCO3 +2HCl= CaCl2+H2O+CO2↑
Al2O3+6HCl= 2Al2O3 + 3H2O
2Al + 6HCl =2AlCl3 + 3H2 ↑
2.一家镀锌厂在把铁管镀锌之前,常要用 ______ 去除铁锈,除锈的化学反应方程式_____________________除锈后的溶液往往变成 色,若除锈后铁管仍然放在酸溶液中,则可见到 的现象,原因是__________________(用化学方程式表示)
Fe2O3+6HCl= 2FeCl3 + 3H2O
Fe+2HCl= FeCl2 + H2 ↑
3.硫酸厂的尾气中常含较多的二氧化硫,能否直接将尾气排放到空气中?_______ ,原因是________________________________________________ 可将该尾气通入 ______ ______________来处理,化学方程式为___________________________________________________
二氧化硫有毒,排放到空气中,会污染空气
2NaOH +SO2 = Na2SO3 +H2O
4.市售消化药片中常含氢氧化镁,该药片适合于治疗胃酸过多的病人,其化学反应原理是 ______________________________________ 用化学方程式表示为___________________________________________________
氢氧化镁与胃酸的主要成分盐酸反应 , 除去过多的胃酸
Mg(OH)2+2HCl = MgCl2+2H2O
如何鉴别实验室失去标签的稀盐酸和氢氧化钙两瓶无色溶液 ?(每小组至少形成一种方案)
如何鉴别实验室失去标签的稀盐酸和氢氧化钙两瓶无色溶液 ?
分别取待检样品少量于试管中, 并分别通入二氧化碳气体
变浑浊的液体是氢氧化钙溶液,不变浑浊的液体是稀盐酸
分别放入锌粒于2个试管中, 并向其中分别加入少量待检样品
有气泡产生的液体稀盐酸,无气泡产生的液体是氢氧化钙溶液
分别放入生锈的铁钉, 于试管中,并向其中加入少量待检样品
铁锈消失,溶液变黄色的液体是稀盐酸, 铁锈不消失的液体是氢氧化钙溶液
分别取待检样品少量于试管中, 并滴入1-2滴酚酞试液
不变色的液体是稀盐酸, 变红色的液体是氢氧化钙溶液
分别用滴管滴一滴待检样品于pH试纸上,并与标准比色卡对照.
PH<7的液体稀盐酸PH>7的的液体是氢氧化钙溶液
分别放入一粒石灰石于试管中,并向其中加入少量待检样品
有气泡产生的液体稀盐酸无气泡产生的液体是氢氧化钙溶液
紫色石蕊溶液也能鉴别吗?
桌上有两瓶失去标签的无色溶液,只知道它们是稀盐酸和石灰水。可用下列方法鉴别它们:
4. 活泼金属如:锌粒
5. 碳酸盐如:碳酸钙
7. 生锈铁钉或氧化铜粉末
1.氢氧化钠固体应如何保存?为什么?如何检验一瓶氢氧化钠溶液是否已变质 ?
取待检样品少量于试管中并加入足量稀盐酸,若有气泡产生,该则氢氧化钠溶液已变质,若无气泡产生,该则氢氧化钠溶液没变质。
因为氢氧化钠固体露置在空气中易吸收空气中的水分而潮解,并易吸收空气中的二氧化碳而变质.
初中化学鲁教版九年级下册第七单元 常见的酸和碱综合与测试示范课ppt课件: 这是一份初中化学鲁教版九年级下册第七单元 常见的酸和碱综合与测试示范课ppt课件,共19页。PPT课件主要包含了实验现象记录,酸碱盐溶液的导电性,课堂练习等内容,欢迎下载使用。
初中化学第九单元 金属综合与测试课前预习ppt课件: 这是一份初中化学第九单元 金属综合与测试课前预习ppt课件,共40页。PPT课件主要包含了重温教材,金属在生活中的应用,金属的物理性质,我会总结,练一练,性能的改变,火眼金睛,鉴别方法,盐溶液,氧化物等内容,欢迎下载使用。
初中化学鲁教版九年级下册第十单元 化学与健康综合与测试课文配套课件ppt: 这是一份初中化学鲁教版九年级下册第十单元 化学与健康综合与测试课文配套课件ppt,共29页。













